辅助T细胞多巴胺受体(DR)表达对类风湿关节炎(RA)患者疾病活动度的影响
2015-06-24马莉莉纪宗斐张卓君戴晓敏吴万龙姜林娣
魏 蕾 孙 颖 马莉莉 纪宗斐 张卓君 戴晓敏 吴万龙 岳 涛 朱 琦 沈 杰 姜林娣△
(1复旦大学附属中山医院风湿免疫科 上海 200032; 2上海光华中西医结合医院类风关内科 上海 200052)
辅助T细胞多巴胺受体(DR)表达对类风湿关节炎(RA)患者疾病活动度的影响
魏 蕾1▲孙 颖1▲马莉莉1纪宗斐1张卓君1戴晓敏1吴万龙1岳 涛2朱 琦2沈 杰2姜林娣1△
(1复旦大学附属中山医院风湿免疫科 上海 200032;2上海光华中西医结合医院类风关内科 上海 200052)
目的 检测类风湿关节炎(rheumatoid arthritis,RA)患者外周血辅助T淋巴细胞(T helper cells,Th cells)不同亚群细胞膜表面多巴胺受体(dopamine receptor,DR)水平,分析其与疾病活动度、实验室指标及功能状态之间的关系。方法 选取25位初诊或3个月内未接受DMARDs治疗的RA患者(DAS28>3.2),12位健康对照及13位同期年龄匹配的骨关节炎(osteoarthritis,OA)患者。采用流式细胞术检测患者外周血Th细胞亚群表面DR1~DR5的表达情况,分析Th细胞DR表达水平与人口学资料、实验室检查、功能状态及疾病活动度之间的相关性。结果 RA组Th2细胞百分比为1.28%(0.74%~2.68%),较健康对照组(中位数0.18%,四分位数间距0.11%~0.31%,P<0.001)及OA组(中位数0.48%,四分位数间距0.03%~1.47%,P=0.029)明显升高。RA组Th2细胞DR2表达水平为25.40%(四分位数间距3.79%~37.10%),明显高于健康对照组(中位数3.74%,四分位数间距0.00%~12.98%,P=0.006)及OA组(中位数3.45%,四分位数间距0.00%~20.55%,P=0.040)。RA组Th2细胞DR4表达量也高于健康对照组和OA组(健康对照组vs.RA组,P=0.022;OA组vs.组,P=0.010)。Th2细胞与关节肿胀数(swollen joint count,SJC)和简化疾病活动指数(SDAI)呈正相关(分别为r=0.421,P=0.036;r=0.396,P=0.050)。Th1细胞DR5百分比分别为2.22% (四分位数间距0.57%~12.24%)与SJC及临床疾病活动指数(CDAI)呈正相关(分别为r=0.492,P=0.012;r=0.445,P=0.026)。Th2细胞DR1和DR3百分比分别为11.15%(四分位数间距2.93%~36.20%)、9.80%(1.62%~23.05%),均与健康评估问卷(Health Assessment Questionnaire,HAQ)评分呈负相关(分别为r=-0.469,P=0.018;r=-0.464,P=0.019)。结论 RA患者Th2细胞多巴胺受体DR2和DR4明显升高,Th细胞DR水平与RA患者SJC、CDAI及HAQ存在相关性。
类风湿关节炎(RA); 辅助T细胞; 多巴胺受体; 疾病活动度
类风湿关节炎(rheumatoid arthritis,RA)是以四肢小关节为主的慢性炎症性、进展性疾病,环境、遗传以及两者交互作用在RA发病中起重要作用,但其确切发病机制目前尚不明确。近年来发现,多巴胺与免疫系统的关系十分密切:在多发性硬化以及系统性红斑狼疮动物模型的脑组织中[1],以及RA患者滑液[2]和炎症性肠病患者结肠黏膜炎症组织中[3],均发现多巴胺含量异常;流行病学调查显示,RA合并精神分裂症的患病率仅为0.09%[4],明显低于人群中RA的患病率。因此,关于多巴胺调节免疫系统的基础研究可能是对现有发病机制的重要补充。
多巴胺受体(dopamine receptor,DR)属于七次跨膜G蛋白偶联受体,包括DR1~DR5在内的5种亚型,根据其结构和药理学特点的不同分为2类,即D1样受体和D2样受体。D1样受体包括DR1和DR5受体,D2样受体包括DR2、DR3、DR4受体,D1样受体和D2样受体分别激活Gas和Gai亚单位,相应引起腺苷酸环化酶的活化或抑制,最终催化ATP变成cAMP的含量升高或减少,进一步引起下游信号通路的改变。本文将RA患者外周血辅助T细胞(T helper cells,Th cells)亚群DR水平与疾病活动度、功能状态以及血清学指标做相关性研究,探索DR在RA中的作用。
材 料 和 方 法
研究对象 2013年7月至2014年4月就诊于复旦大学附属中山医院风湿免疫科门诊和上海光华中西医结合医院门诊RA患者共25人。入选标准:(1)符合1987年美国风湿病学会(ACR)修订的分类标准;(2)初发未使用改善病情的抗风湿药物(disease-modifying antirheumatic drugs,DMARDs)药物或近3个月内未使用DMARDs治疗;(3)疾病处于活动期(DAS28-CRP>3.2)。排除标准包括:(1)高血压、冠心病等心血管疾病;(2)甲状腺功能亢进、糖尿病等内分泌系统疾病;(3)恶性肿瘤;(4)急、慢性感染;(5)近期有明显应激事件发生;(6)使用各种可能影响交感神经系统的药物;(7)神经精神障碍,包括精神分裂症、帕金森病、抑郁症等。同期复旦大学附属中山医院骨科病房接受膝关节置换术的原发性膝骨关节炎(osteoarthritis,OA)患者13名以及健康志愿者12名为对照,膝骨关节炎诊断符合1986年美国风湿病学会公布的膝骨关节炎修订标准。对照均满足排除标准。
主要试剂 兔抗人DR D1、D3、D4、D5多克隆抗体(德国Merk Millipore公司),D2(美国LifeSpan BioSciences公司)。APC-H7 标记的CD4 (Cod.560158,clone RPA-T4)、APC标记的IFN-γ (Cod.551385,clone 4S.B3)、PerCP-CyTM5.5 标记的IL-4 (Cod.561234,clone 8D4-8)、PE conjugated IL-17A(Cod.560436,clone SCPL1362) 鼠抗人单克隆(lgG1-κ)流式抗体及其同型对照抗体(美国Becton Dickinson公司)。佛波酯(phorbolmyristate acetate,PMA)、离子霉素(ionomycin)以及蛋白转运抑制剂布雷菲德菌素A(brefeldin A)、染色缓冲液以及固定破膜剂(美国Becton Dickinson公司)。淋巴细胞分离液、二甲亚砜(DMSO)、CF405 M标记羊抗兔抗体、青霉素、链霉素(美国Sigma公司)。1640培养液(RPMI-1640)、灭活胎牛血清(FBS) (美国GibcoBre公司),兔lgG抗体(美国 Santa Cruz公司)。
临床评估 记录RA患者、骨OA患者以及健康志愿者一般资料,RA患者临床评估包括:28关节关节压痛数(tender joint count,TJC)、关节肿胀数(swollen joint count,SJC)、疼痛评分、患者总体评分(patient global score,PGA)和医生总体评分(evaluator global test,EGA)均用100 mm视觉模拟量表(visual analog scale,VAS)、血沉(魏氏法),C反应蛋白(CRP)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸肽抗体(抗CCP抗体)。疾病活动度根据DAS28-CRP、简化疾病活动指数(SDAI)和临床疾病活动指数(CDAI)公式进行评分,公式分别为:DAS28-CRP=0.56×sqrt(TJC28)+0.28×sqrt(SJC28)+0.36×ln[CRP(mg/L)+1]+0.014×PGA(mm)+0.96;其中sqrt是开平方根,ln是取自然对数,TJC28代表28个关节压痛数,SJC28代表28个关节压痛数[5]。CDAI=SJC+TJC+PGA(cm)+EGA(cm)[6];SDAI=SJC+TJC+PGA(cm)+EGA(cm)+CRP(mg/dL)[7]。
实验方法
分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs) 抽取清晨空腹肘静脉血10 mL,EDTA抗凝,423×g离心10 min后上层血浆冻存于-80 ℃冰箱保存,下层细胞用Ficoll密度梯度离心法800×g离心20 min分离PBMC,调整细胞终浓度至1×106/mL,冻存于含有10%DMSO的FBS冻存液中,置于程序降温盒于-80 ℃保存。
细胞复苏与刺激 冻存管在37 ℃水浴中迅速摇晃解冻,1~2 min融化后,423×g离心10 min,弃上清,用含10%胎牛血清的1640培养液重悬细胞,台盼蓝染色,计算细胞存活率(>90%)。调整细胞浓度(终浓度为1×106/mL),接种于24孔板中,每孔加入佛波酯(50 ng/mL)、离子霉素(1 000 ng/mL)及阻断剂布雷菲德菌素A,予37 ℃、体积分数为5%CO2条件下培养6 h。
流式细胞术检测Th1、Th2、Th17细胞DR亚群 每个样本加入500 μL含有1%牛血清白蛋白(BSA)的PBS放置于4°冰上封闭30 min,423×g离心10 min后用250 μL染色缓冲液混匀,制成细胞悬液。每管流式细胞管加入50 μL细胞悬液。细胞染色分为3步:第一步加入APC-H7标记的CD4抗体及分别对应兔抗人DR抗体D1~D5 (1∶100稀释),4 ℃避光孵育30 min,加入染色缓冲液1 mL洗涤后,用90 μL染色缓冲液重悬,加入CF405 M标记羊抗兔二抗(1∶1 000稀释),4 ℃避光孵育30 min,染色缓冲液洗涤1遍后加入破膜/固定液250 μL,置于4 ℃避光保存30 min,加入1 mL破膜/固定缓冲液洗涤2遍后,50 μL重悬细胞,加入小鼠抗人APC标记IFN-γ、PerCP-CyTM5.5 标记的IL-4以及PE偶联IL-17A抗体混合液,4 ℃孵育30 min,破膜/固定缓冲液1 mL洗涤2遍后,加入250 μL染色缓冲液上机检测。检测采用美国BD公司Conto Ⅱ流式细胞仪,FACS Diva 软件获取数据并用Flow jo 7.6.1进行数据分析,每管检测细胞数目约为(0.5~1.5)×106个,结果以阳性细胞百分比表示,DR+Th细胞表示DR阳性的各类Th亚群细胞占该亚群细胞的百分比。
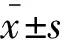
结 果
人口学资料 RA组患者平均年龄为(54±12)岁,其中男性4例、女性21例;OA组平均年龄(60±10)岁,其中男性5例、女性8例;健康对照组平均年龄为(25±2)岁,其中男性和女性各6名。RA组和OA组年龄差异无统计学意义(P=0.098),但均高于健康对照组(P<0.001)。RA组临床资料见表1。
外周血Th细胞亚群分析 RA组CD4细胞阳性率为42.20%±7.67%,接近于OA组(41.59%±8.99%,P=0.977),明显高于健康对照组(32.51%±6.76%,P=0.04)。Th1细胞百分比在RA组、OA组、健康对照组间无明显差异(P=0.88)。RA组Th2细胞百分比为1.28%(0.74%~2.68%),明显高于健康对照组和OA组(P值分别为<0.001和0.029),RA组Th17细胞百分比高于健康对照组(P=0.007),较OA组升高,但差异无统计学意义(P=0.096)。外周血Th细胞亚群流式图见图1,3组外周血Th1、Th2、Th17细胞百分比统计结果见表2。

表1 RA患者人口学资料Tab 1 The demographics of patients with rheumatoid arthritis
TJC:Tender joint count; SJC:Swollen joint count; ESR:Erythrocyte sedimentation rate; CRP:C reactive protein; Anti-CCP antibody:Anti-cyclic citrullinated protein; RF:Rheumatoid factor; PGA:Patient global assessment; EGA:Evaluator global assessment; HAQ:Health assessment questionnaire; DAS28:Disease activity score based on 28 joints; CDAI:Clinical disease activity index; SDAI:Simplified disease activity index.
表2 RA、OA患者及健康人外周血Th细胞亚群百分比检测结果Tab 2 Detection results of Th cell subsets in peripheral blood of RA,OA patients and healthy controls
(1)vs.healthy controls,(2)vs.osteoarthritis group,P<0.05; Con:Healthy control group.
流式细胞术检测Th1、Th2、Th17细胞表面D1~D5表达 外周血Th2细胞D1~D5代表性的流式图见图2。RA组Th2细胞DR2受体表达量为25.40% (3.79%~37.10%),健康对照组和OA组分别为3.74% (0.00%~12.98%)和3.45%(0.00%~20.55%),RA组Th2细胞表面DR2阳性显著高于后两组(RA组vs.健康对照组,P=0.006;RA组vs. OA组,P=0.040,图3A);Th2细胞DR4受体在RA组、OA组和健康对照组表达水平分别为10.30%(3.61%~14.75%)、2.98%(0.00%~5.67%)、2.26%(0.00%~8.08%),RA组Th2细胞DR4受体显著升高(健康对照组vs. RA组,P=0.022;OA组vs. RA组,P=0.010,图3B),分布见表3。RA组DR2+Th1细胞百分比为 1.93%(0.66%~5.41%),健康对照组为0.62%(0.28%~1.25%),显著低于RA组(P=0.006);RA组和OA组Th1细胞DR4表达分别为2.38%(0.69%~4.36%)和2.04%(0.65%~4.24%),明显高于健康对照组0.48%(0.16%~1.02%)(RA组vs.健康对照组,P=0.001;OA组vs.健康对照组,P=0.015;RA组vs.OA组,P=0.622)。RA组Th1和Th17细胞DR1~DR5的表达及与其他两组的比较见表4。
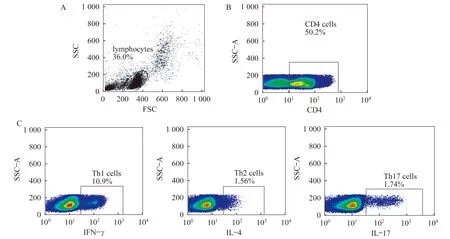
图1 RA患者Th细胞亚群流式细胞图Fig 1 FACs of proportions of Th cell subtypes in RA patients
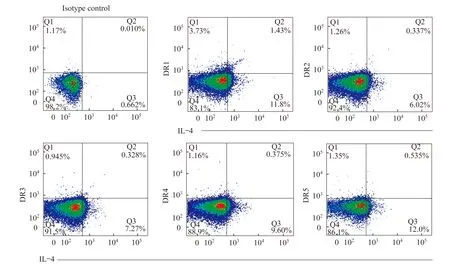
图2 RA患者DR+Th2典型流式细胞图Fig 2 Representative FACs of proportions of DR+Th2 cells in RA patients
Th细胞亚群以及细胞表面DR表达与临床指标相关性 RA患者Th1细胞百分比与TJC(r=0.427,P=0.033)、疼痛评分(r=0.397,P=0.049)、EGA(r=0.417,P=0.038)、DAS28(r=0.477,P=0.016)以及SDAI(r=0.432,P=0.031)呈正相关。Th2细胞百分比与SJC和SDAI呈正相关(分别为r=0.421,P=0.036;r=0.396,P=0.050)。Th1细胞DR5受体和SJC以及CDAI呈正相关(分别为r=0.492,P=0.012;r=0.445,P=0.026),Th2细胞DR1和DR3与健康评估问卷评分(HAQ)呈负相关(分别为r=-0.469,P=0.018;r=-0.464,P=0.019)。Th17DR1~DR5与疾病活动度、功能状态及炎症指标无明显相关性。
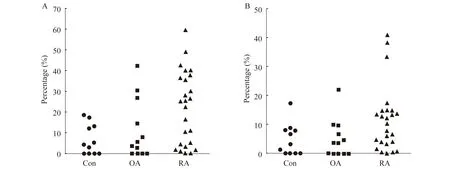
图3 Th2细胞DR2(A)和DR4(B)表达Fig 3 The DR2(A) and DR4(B) expression on Th2 cells
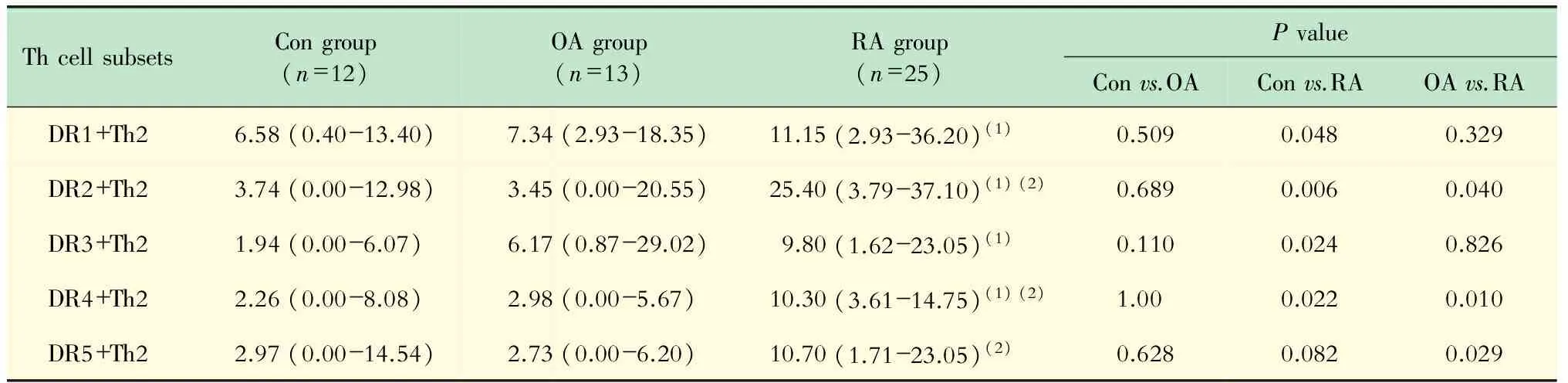
表3 Th2细胞DR表达水平Tab 3 The expression level of DR on Th2 cells(mean and 25%-75% range,%)
(1)vs.healthy controls,(2)vs.osteoarthritis group,P<0.05.
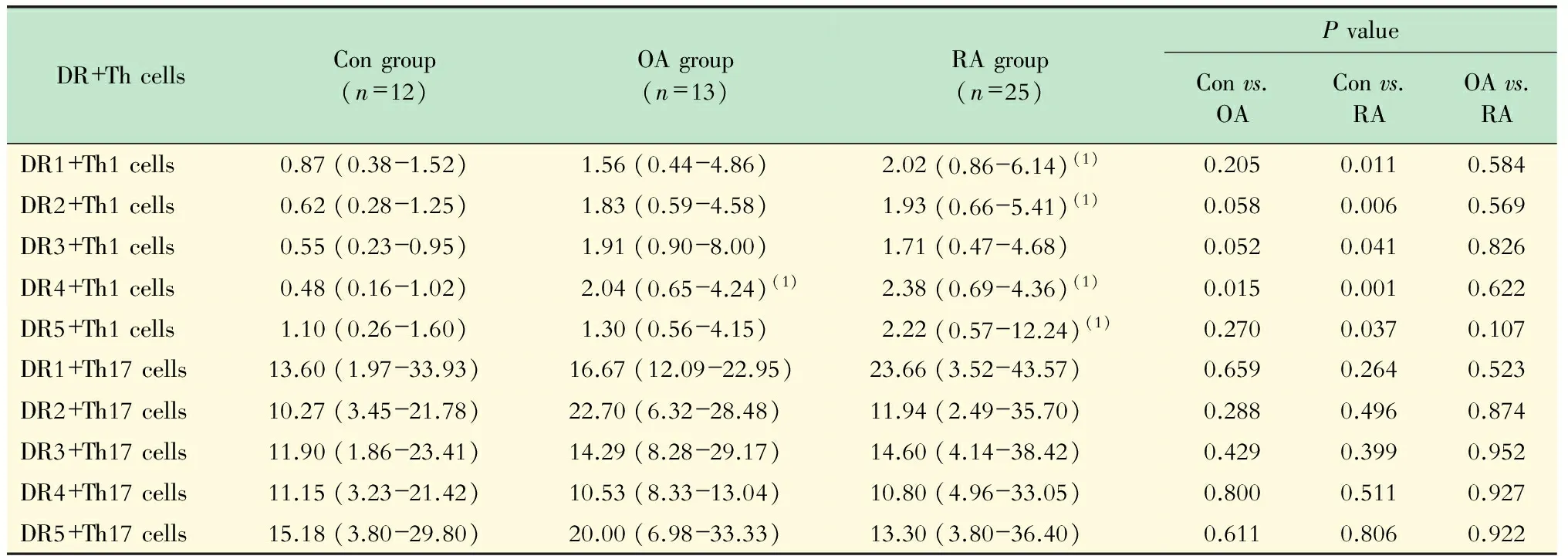
表4 Th1和Th17细胞DR表达水平Tab 4 The DR expression levels on Th1 and Th17 cells (mean and 25%-75% range,%)
vs. healthy controls,P<0.05.
讨 论
多巴胺是单胺类神经递质,作为肾上腺素和去甲肾上腺素的前体在神经系统发挥重要功能,参与情绪、情感、运动、记忆、摄食、学习等多种生命活动的调节。中枢及外周多巴胺水平的异常,可造成多种精神神经功能障碍,表现为精神分裂症、抑郁、杜氏抽动症、帕金森病等疾病。多巴胺与其特异性的DR组成多巴胺能系统,可通过下丘脑-垂体-肾上腺轴、交感/副交感神经纤维、初级和次级淋巴结以及免疫细胞发挥作用,包括树突状细胞和T细胞在内的多种免疫细胞以及滑膜成纤维细胞[8]可以合成、储存、运输多巴胺,通过旁分泌和自分泌的方式作用于多种免疫细胞胞膜上的特异性DR,影响免疫细胞的分化、活化、静息、凋亡以及细胞因子的分泌。多巴胺的不同药理生理学效应取决于多巴胺的浓度、作用细胞的类型及功能状态以及结合的DR类型。现有研究已证实淋巴细胞、巨噬细胞、树突状细胞等多种细胞表达DR1~DR5五种类型受体。
多巴胺参与多种自身免疫性疾病的发病,有关RA的研究较为广泛。本研究发现RA患者关节滑液和外周血中的多巴胺浓度较对照组明显升高。早期有研究探讨了多巴胺激动剂/抑制剂在RA尤其是难治性RA患者中的药理学作用[9-10]。通过RA动物模型发现,多巴胺D1样受体激动剂可以改善胶原诱导关节炎动物模型的关节评分及影像学病变[11],在SCID小鼠与RA患者滑膜组织嵌合模型中,D2样受体拮抗剂氟哌啶醇可以诱导IL-6和Th17细胞大量聚集,加速软骨破坏,与之相反的是D1样受体拮抗剂SCH23390可以抑制软骨破坏,进一步发现滑膜组织中的树突状细胞可以储存和释放多巴胺,通过结合D1样受体,依赖IL-6升高上调IL-17水平[2]。RA患者滑膜成纤维细胞DR mRNA较OA患者滑膜组织明显增高,且两组滑膜成纤维细胞DR表达以D2样受体为主,外源性的多巴胺与RA患者滑膜成纤维细胞共培养后显著抑制炎症因子IL-6 和IL-8的产生[8]。
虽然DR DR1~DR5根据药理学和结构特点的不同分为D1样和D2样受体,但是,即使是同一类受体,其表达和功能也不同。T细胞DR1~DR5表达量较B细胞、NK细胞、嗜酸性粒细胞及巨噬细胞低,DR3和DR5在免疫细胞中的水平较为稳定,DR2和DR4波动性较大[12]。通过激活DR4受体可以抑制ERK1/ERK2磷酸化,上调Krupple样因子2表达诱导T细胞处于静息状态[13]。DR2受体活化可增加IL-10的合成,抑制效应T细胞的功能[14],激活DR3受体可促进IFN-r分泌[15]。活化T细胞(effective T cells)较原始T细胞(naive T cells)D1样受体和DR2样受体均升高[16],表明DR水平不仅取决于细胞种类的不同,同时也受细胞功能状态的影响。
DR DR1~DR5在Th1和Th2细胞分布的不同,与Th1和Th2细胞在RA发病中的作用不同。Th1主要发挥促炎功能,而Th2细胞通过分泌抑制性细胞因子起抑炎作用。本研究中RA组Th2细胞比例显著高于健康对照及OA组,且与STC及SDAI呈正相关,这一发现也与既往报道相符。van Roon等[17]发现RA患者外周血T细胞较正常人分泌更多的IL-4,而IFN-r分泌下降,且IL-4水平与血沉、C反应蛋白、TNF-α以及关节破坏正相关,而IL-4是Th2细胞分化和分泌的重要细胞因子。此外,Th2细胞还可分泌IL-10,发挥免疫抑制功能,与Th1和Th17相比,起免疫负向调控作用。本研究初步探索了RA患者外周血Th细胞亚群多巴胺受体的表达情况,结果发现,Th2细胞DR2和DR4受体表达均较对照组上调,两者同属D2样受体,Th1DR2低下,DR4升高,且与临床指标有一定相关性;其在RA中确切的免疫调节机制尚不清楚,需体外实验及动物实验进一步研究多巴胺及其受体在RA中的作用。样本量偏小是本研究的不足之处,此外,树突状细胞、巨噬细胞和成纤维细胞DR间的相关性尚需以后研究补充。
[1] Ballok DA,Earls AM,Krasnik C,etal.Autoimmune-induced damage of the midbrain dopaminergic system in lupus-pronemice[J].JNeuroimmunol,2004,152(1-2):83-97.
[2] Nakano K,Yamaoka K,Hanami K,etal.Dopamine induces IL-6-dependent IL-17 production via D1-like receptor on CD4 naive T cells and D1-like receptor antagonist SCH-23390 inhibits cartilage destruction in a human rheumatoid arthritis/SCID mouse chimera model[J].JImmunol,2011,186(6):3745-3752.
[3] Magro F,Vieira-Coelho MA,Fraga S,etal.Impaired synthesis or cellular storage of norepinephrine,dopamine,and 5-hydroxytryptamine in human inflammatory bowel disease[J].DigDisSci,2002,47(1):216-224.
[4] Eaton WW,Hayward C,Ram R.Schizophrenia and rheumatoid arthritis:a review[J].SchizophrRes,1992,6(3):181-192.
[5] Prevoo ML,van′t Hof MA,Kuper HH,etal.Modified disease activity scores that include twenty-eight-joint counts.Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis[J].ArthritisRheum,1995,38(1):44-48.
[6] Greenberg JD,Harrold LR,Bentley MJ,etal.Evaluation of composite measures of treatment response without acute-phasereactants in patients with rheumatoid arthritis[J].Rheumatology(Oxford),2009,48(6):686-690.
[7] Smolen JS,Breedveld FC,Schiff MH,etal.A simplified disease activity index for rheumatoid arthritis foruse in clinical practice[J].Rheumatology(Oxford),2003,42(2):244-257.
[8] Capellino S,Cosentino M,Luini A,etal.Increased expression of dopamine receptors in synovial fibroblasts of rheumatoid arthritis patients-inhibitory effects of dopamine on IL-8 and IL-6[J].ArthritisRheumatol,2014,66(10):2685-2693.
[9] Erb N,Pace AV,Delamere JP,etal.Control of unremitting rheumatoid arthritis by the prolactin antagonist cabergoline[J].Rheumatology,2001,40(2):237-239.
[10] Eijsbouts A,van den Hoogen F,Laan RF,etal.Treatment of rheumatoid arthritis with the dopamine agonist quinagolide [J].JRheumatol,1999,26(10):2284-22855.
[11] Nakashioya H,Nakano K,Watanabe N,etal.Therapeutic effect of D1-like dopamine receptor antagonist on collagen-induced arthritis of mice[J].ModRheumatol,2011,21(3):260-266.
[12] Kustrimovic N,Rasini E,Legnaro M,etal.Expression of dopaminergic receptors on human CD4+ T lymphocytes:flow cytometric analysis of naive and memory subsets and relevance for the neuroimmunology of neurodegenerative disease[J].JNeuroimmunePharmacol,2014,9(3):302-312.
[13] Sarkar C,Das S,Chakroborty D,etal.Cutting edge:stimulation of dopamine D4 receptors induce T cell quiescence by up-regulating Kruppel-like factor-2 expression through inhibition of ERK1/ERK2 phosphorylation[J].JImmunol,2006,177(11):7525-7529.
[14] Besser MJ,Ganor Y,Levite M.Dopamine by itself activates either D2,D3 or D1/D5 dopaminergic receptors in normal human T cells and triggers the selective secretion of either IL-10,TNF alpha or both[J].JNeuroimmunol,2005,169(1-2):161-171.
[15] Ilani T,Strous RD,Fuchs S.Dopaminergic regulation of immune cells via D3 dopamine receptor:a pathway mediated by activated T cells[J].FASEBJ,2004,18(13):1600-1602.
[16] Kustrimovic N,Rasini E,Legnaro M,etal.Expression of dopaminergic receptors on human CD4+ T lymphocytes:flowcytometric analysis of naive and memory subsets and relevance for the neuroimmunology of neurodegenerative disease[J].JNeuroimmunePharmacol,2014,9(3):302-312.
[17] van Roon JA,Verhoef CM,van Roy JL,etal.Decrease in peripheral type1 over type2 T cell cytokine production in patients with rheumatoid arthritis correlates with an increase in severity of disease[J].AnnRheumDis,1997,56(11):656-660.
The influence of dopamine receptor (DR) expressed in T helper cell subsets on the disease activity of rheumatoid arthritis (RA) patients
WEI Lei1▲, SUN Ying1▲, MA Li-li1, JI Zong-fei1, ZHANG Zhuo-jun1, DAI Xiao-min1, WU Wan-long1, YUE Tao2, ZHU Qi2, SHEN Jie2, JIANG Lin-di1△
(1DepartmentofImmunologyandRheumatology,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2DepartmentofRheumatology,ShanghaiGuanghuaHospitalofIntegratedChinese&WesternMedicine,Shanghai200052,China)
Objective To detect the expressions of dopamine receptor D1-D5 among different T helper (Th) cells in patients with rheumatoid arthritis (RA) and to analyze the correlation between dopamine receptor (DR) and disease activity,laboratory tests and functional status. Methods Patients with RA (n=25),or osteoarthritis (OA) (n=13) diagnosed according to the ACR criteria,as well as healthy donors (n=12) were recruited in this study.RA patients were all treatment naive or free of disease-modifying antirheumatic drugs (DMARDs) at least for 3 months.Flow cytometry was performed to detect the dopamine receptor D1-D5 in Th1,Th2 and Th17 cells in three groups.Correlation analyses were made between the demographics,clinical data,functional status,disease activity and dopamine receptor expressions on Th cell subsets. Results The percentage of Th2 cells in patients with RA was 1.28% (0.74%-2.68%) and significantly higher than that in healthy controls (median 0.18%,IQR:0.11%-0.31%,P<0.001) and patients with OA (median 0.48%,IQR:0.03%-1.47%,P=0.029).Meanwhile,the dopamine receptor DR2 expressed on Th2 cells in rheumatoid arthritis group (median 25.40%,IQR:3.79%-37.10%) were remarkably elevated than that in healthy donors (median 3.74%,IQR:0.00%-12.98%,P=0.006) and OA patients (median 3.45%,IQR:0.00%-20.55%,P=0.040).Th2 cells also expressed higher level of DR4 in RA group than that in healthy controls and OA group (P=0.022 andP=0.010,respectively).A positive correlation was found between Th2 cells percentage and swollen joint count (SJC) (r=0.421,P=0.036) as well as SDAI (r=0.396,P=0.050).DR5 expressed on Th1 cells in RA group was 2.22%(IQR:0.57%-12.24%)and had positive correlations with SJC (r=0.492,P=0.012) and CDAI(r=0.445,P=0.026).DR1 and DR3 on Th2 cells were 11.15%(IQR:2.93%-36.20%) and 9.80%(IQR:1.62%-23.05%),and all negatively related with Health Assessment Questionnaire (HAQ) (DR1:r=-0.469,P=0.018;DR3:r=-0.464,P=0.019).Conclusions Dopamine receptor DR2 and DR4 on Th2 cells were highly expressed.Dopamine receptor levels in Th cells are correlated with SJC,CDAI and HAQ in RA patients.
rheumatoid arthritis (RA); T helper cells; dopamine receptor; disease activity
R 593.2
A
10.3969/j.issn.1672-8467.2015.02.001
2014-07-25;编辑:张秀峰)
上海市科委基础研究重点项目(12JC1402500)
▲Co-first authors
△Corresponding author E-mail:zsh-rheum@hotmail.com
*This work was supported by the Major Program of Shanghai Committee of Science and Technology (12JC1402500).
