Cp G ODN对Treg细胞及Th17细胞分化的影响*
2015-06-24李洁琼纪玉强姚英民刘青光
李洁琼, 纪玉强, 杨 威, 姚英民, 刘青光, 郭 成△
1西安交通大学第一附属医院肝胆外科,西安 710061
2西安市第一医院心内科,西安 710002
Cp G ODN对Treg细胞及Th17细胞分化的影响*
李洁琼1, 纪玉强2, 杨 威1, 姚英民1, 刘青光1, 郭 成1△
1西安交通大学第一附属医院肝胆外科,西安 710061
2西安市第一医院心内科,西安 710002
目的 研究免疫佐剂CpG ODN对小鼠脾细胞中Treg细胞、Th17细胞分化的影响,为进一步的临床免疫治疗应用奠定基础。方法 体外分离小鼠脾细胞后,加入抗CD3单抗及抗CD28单抗培养,并相应加入诱导Treg细胞分化的细胞因子TGF-β、IL-2或诱导Th17细胞分化的细胞因子TGF-β、IL-6、IL-23,培养24 h后加入CpG1982、CpG1826继续培养48 h,培养结束后收集细胞进行细胞内染色流式细胞术检测Treg/Th17细胞,利用实时定量PCR检测Foxp3、RORγt、IL-10、IL-17 mRNA的水平,Western blot检测Foxp3、RORγt蛋白表达,ELISA检测脾细胞培养上清IL-10、IL-17水平。结果 在细胞因子TGF-β、IL-2的诱导下,CD4+Foxp3+Treg细胞数量明显增多,核转录因子Foxp3 m RNA和蛋白水平均增高,且细胞培养上清中IL-10的水平也升高,在细胞因子诱导的同时加入CpG1826培养后CD4+Foxp3+Treg细胞数量明显减少,Foxp3水平降低,培养上清中IL-10的水平降低,差异具有统计学意义(均P<0.05);单独加入Cp G1826以及在培养液中加入细胞因子TGF-β、IL-6、IL-23后,Th17细胞数量均明显增加,核转录因子RORγt水平升高,细胞培养上清中IL-17水平增加,与对照组相比差异均有统计学意义(均P<0.05),Cp G1826联合细胞因子组则对Th17细胞分化具有更加明显的刺激效应(P<0.05)。结论 免疫佐剂CpG1826具有抑制小鼠脾细胞中Treg细胞分化、促进Th17细胞分化的作用,从而发挥对Treg/Th17系统的调节功能。
Cp G ODN; 免疫调节; Treg细胞; Th17细胞
CD4+CD25+Treg细胞、Th17细胞是T细胞中具有特异细胞膜表面分子和核转录因子的两类细胞亚群,叉头样螺旋转录因子3(Foxp3)对于CD4+CD25+Treg细胞的发育与功能维持具有重要的作用[1-3],维甲酸相关孤儿受体(RORγt)是Th17细胞分化过程中关键的转录激活因子[4-5]。CD4+CD25+Treg细胞是一类具有免疫抑制功能的CD4 T淋巴细胞亚群,而Th17细胞作为效应T细胞亚群,在防御感染、肿瘤相关免疫中具有重要作用,Treg/Th17的动态平衡在机体免疫调节方面发挥着至关重要的作用。
Cp G ODN是指一类人工合成的含Cp G基序的寡聚脱氧核糖核苷酸,作为免疫佐剂Cp G ODN被较为广泛地应用于肿瘤免疫治疗。研究发现,Cp G ODN可以通过刺激DC细胞分泌IL-12促进T细胞向Th1细胞方向分化,同时Cp G ODN具有抑制CD4+CD25+Treg细胞的功能[6],但Cp G ODN对CD4+CD25+Treg细胞与Th17细胞分化的调节尚未清楚。本实验利用体外培养小鼠脾细胞,加入不同诱导因素,同时加入Cp G ODN,研究CpG ODN对Treg细胞、Th17细胞分化的影响,探讨通过人为干预,改变细胞微环境中CD4+CD25+Treg/Th17动态平衡的效果,并在此基础上,未来进一步研究细胞微环境中CD4+CD25+Treg/Th17动态平衡对肿瘤细胞生长的影响,为Cp G ODN在肿瘤免疫治疗中的应用,提供良好的研究基础。
1 材料与方法
1.1 实验材料
1.1.1 实验对象 健康雌性C57BL/6小鼠50只,清洁级动物,6~8周龄,体重18~21 g,平均20 g,由西安交通大学医学院动物中心提供。
1.1.2 主要试剂 PE抗小鼠Foxp3、PE大鼠Ig G2b,κ同型对照、小鼠Foxp3缓冲液、BD Cytofix/CytopermTMFixation/Permeabilization Kit购自美国BD公司;FITC抗小鼠CD4、Alexa Fluor®647抗小鼠IL-17 A、Alexa Fluor®647大鼠IgG2a同型对照购自美国eBioscience公司;rh TGF-β、rmIL-2、rmIL-6、rmIL-23购自英国Pepro Tech公司;ELISA检测试剂盒购自美国R&D公司。
1.1.3 主要仪器 细胞培养箱(芬兰Thermo公司);酶联免疫检测仪(Bio-tekEL×800);荧光定量PCR扩增仪(美国Bio-Rad);流式细胞仪FACS Calibur(美国贝克曼公司);DENLEY DRAGON Wellscan MK 3酶标仪(芬兰Thermo公司)。
1.2 实验方法
1.2.1 小鼠脾细胞悬液制备 参照我实验室既往常用方法制备小鼠脾细胞悬液[7]。
1.2.2 实验分组 在24孔板中每孔加入1.0 m L脾细胞悬液,培养24 h后根据文献[8-12]加入不同细胞因子,进行脾细胞诱导刺激,实验分组如下:①正常脾细胞对照;②脾细胞+CpG1982(无免疫活性的对照Cp G ODN);③脾细胞+Cp G1826(B型 CpG ODN);④脾细胞+TGF-β+IL-2;⑤脾细胞+TGF-β+IL-2+Cp G1982;⑥脾细胞+TGF-β+IL-2+CpG1826;⑦脾细胞+TGF-β+IL-6+IL-23;⑧脾细胞+TGF-β+IL-6+IL-23+Cp G1982;⑨脾细胞+TGF-β+IL-6+IL-23+Cp G1826。
每孔脾细胞培养液中加入抗CD3单抗(3 ng/mL)及抗CD28单抗(3 ng/m L),第4、5、6组分别加入TGF-β(3 ng/m L)、IL-2(5 ng/m L),第7、8、9组分别加入TGF-β(3 ng/m L)、IL-6(20 ng/m L)、IL-23(20 ng/m L);脾细胞培养48 h后第2、5、8组加入CpG1982(3μg/m L),第3、6、9组加入CpG1826(3 μg/m L),所有试剂浓度都为在激活混合物中的终浓度,每组做5个复孔。
1.2.3 流式细胞术检测Treg、Th17细胞 将每组脾细胞悬液分为4管,一管用于检测Treg细胞,一管用于检测Th17细胞,另两管分别为相应同型对照。分别加入FITC-CD4抗体、PE-Foxp3、Alexa Fluor®647-IL-17抗体进行固定、破膜、染色后,应用FACS Calibur型流式细胞仪检测,通过Cellquest软件分析数据。
1.2.4 实时定量PCR测定Foxp3、RORγt、IL-10、IL-17 m RNA的表达 参照本实验室既往常用方法进行定量PCR检测[13]。根据文献报道合成Foxp3、RORγt、IL-17引物,根据Primer Premier 5.0软件参照GenBank cDNA序列设计IL-10、HPRT引物,并遵循以下原则:引物与模板的序列紧密互补;引物与引物之间避免形成稳定的二聚体或发夹结构;引物不在模板的非目的位点引发DNA聚合反应(即错配)。委托上海生物工程技术公司合成(表1)。

表1 PCR引物Table 1 PCR primer sequences
1.2.5 Western blot检测Foxp3、RORγt蛋白表达参照本实验室既往常用方法进行Western blot检测[13]。
1.2.6 ELISA检测脾细胞培养上清IL-10、IL-17水平 参照本实验室既往常用方法[7]。
1.3 统计学分析
计量资料采用均数±标准差(¯x±s)表示。利用SPSS 13.0软件进行统计学处理,根据方差齐性采用单因素方差分析(ANOVA)或非参数检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 CpG ODN对Treg细胞分化的影响
2.1.1 Cp G ODN对Treg细胞数量的影响 分离小鼠脾细胞后,加入抗CD3单抗(3 ng/m L)及抗CD28单抗(3 ng/m L)培养,并相应加入诱导Treg细胞分化的细胞因子TGF-β(3 ng/m L)、IL-2(5 ng/mL),培养24 h后加入3μg/mL Cp G1982、CpG1826继续培养48 h,培养结束后收集细胞进行细胞内染色流式细胞检测,以CD4+细胞设门进行分析。CpG ODN对Treg细胞分化的影响结果见图1,结果显示:CD4+Foxp3+Treg细胞在正常小鼠脾细胞中占CD4+T细胞的(12.98±1.35)%,单独加入Cp G1982(无免疫活性的对照Cp G)、CpG1826(B型)培养后CD4+Foxp3+Treg细胞占CD4+T细胞的(13.06±1.21)%、(13.64±1.30)%,与对照组相比差异无统计学意义(均P>0.05);在小鼠脾细胞培养液中加入TGF-β、IL-2后CD4+Foxp3+Treg细胞数量明显升高,占CD4+T细胞的(23.96± 1.97)%,与对照组相比差异具有统计学意义(P<0.05);加入TGF-β、IL-2的同时加入CpG1982培养后CD4+Foxp3+Treg细胞占CD4+T细胞的(24.05±1.98)%,与不加CpG组相比差异无统计学意义(P>0.05),而加入Cp G1826培养后CD4+Foxp3+Treg细胞数量明显减少,占CD4+T细胞的(15.80±1.47)%,与只加细胞因子组及细胞因子加CpG1982组相比差异具有统计学意义(均P<0.05),但仍然高于对照组(P<0.05)。
2.1.2 不同剂量CpG1826对Treg细胞分化的影响 在脾细胞培养液中加入抗CD3单抗(3 ng/m L)及抗CD28单抗(3 ng/m L),并相应加入诱导Treg细胞分化的细胞因子TGF-β(3 ng/m L)、IL-2(5 ng/m L),培养24 h后分别加入1、3、6、9μg/m L CpG1826培养48 h后进行细胞内染色检测CD4+Foxp3+Treg细胞,结果见图2。加入不同浓度的CpG1826均能明显抑制CD4+Foxp3+Treg的分化,但3、6、9μg/m L三个不同剂量的Cp G1826的抑制效果的差异无统计学意义(P>0.05)。
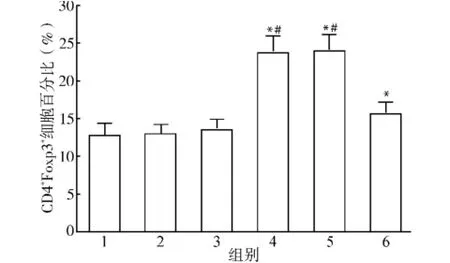
图1 CpG ODN对Treg细胞分化的影响Fig.1 Effects of CpG ODN on cell differentiation
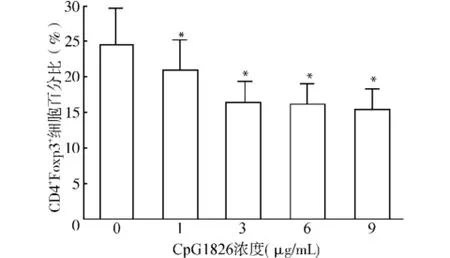
图2 不同剂量CpG1826对Treg细胞分化的影响Fig.2 Effects of Cp G1826 at different doses on cell differentiation
2.1.3 不同作用时间Cp G1826对Treg细胞分化的影响 我们选择3μg/m L Cp G1826作为刺激剂量,并以PBS溶液作阴性对照,观察在不同的作用时间对CD4+Foxp3+Treg的分化的影响,结果见图3,在加入Cp G1826 12 h后就可以发挥抑制作用,作用12、24、48、72、96 h后CD4+Foxp3+Treg细胞占CD4+T细胞分别为:(21.12±1.96)%、(16.80± 2.01)%、(15.16±1.37)%、(16.05±1.68)%、(15.06±1.54)%。作用48 h后抑制达到高峰,48、72、96 h抑制效果未见显著性差异(P>0.05)。
2.2 CpG ODN对Th17细胞分化的影响
更换诱导因子为TGF-β(3 ng/m L)、IL-6(20 ng/m L)、IL-23(20 ng/m L),同法进行细胞内染色检测。Cp G ODN对Th17细胞分化的影响的结果见图4,结果显示:Th17细胞在正常小鼠脾细胞中仅占CD4+T细胞的(0.49±0.16)%,单独加入无免疫活性的CpG1982培养后Th17细胞占CD4+T细胞的(0.62±0.19)%,而单独加入CpG1826后Th17细胞数量明显增加,占CD4+T细胞的(3.01 ±0.75)%,与对照组相比差异具有统计学意义(P<0.05);在小鼠脾细胞培养液中加入TGF-β(3 ng/m L)、IL-6(20 ng/m L)、IL-23(20 ng/m L)后Th17细胞数量明显升高,占CD4+T细胞的(3.68± 0.87)%,同时加入Cp G1982培养后Th17细胞占CD4+T细胞的(3.79±1.02)%,与不加Cp G组相比差异无统计学意义(P>0.05),而同时加入CpG1826培养后Th17细胞占CD4+T细胞的(5.11 ±1.08)%,与单纯细胞因子组及同时加入CpG1982组相比差异具有统计学意义(均P<0.05)。
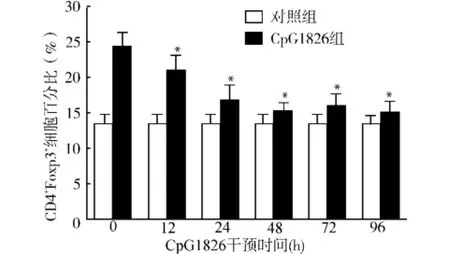
图3 不同干预时间CpG1826对Treg细胞分化的影响Fig.3 Effects of CpG1826 at different time points on cell differentiation
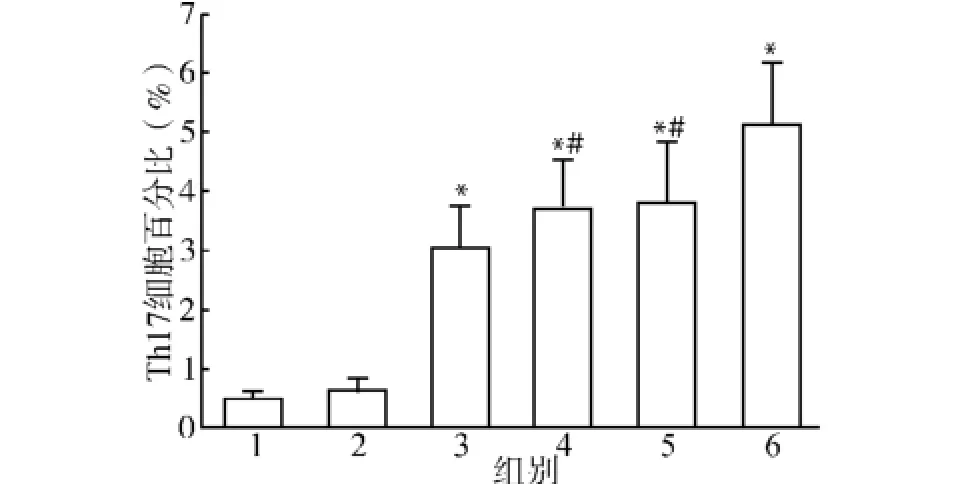
图4 CpG ODN对Th17细胞分化的影响Fig.4 Effects of Cp G ODN on Th17 cell differentiation
2.3 CpG ODN对Foxp3、RORγt、IL-10、IL-17 mRNA表达的影响
2.3.1 CpG ODN对Foxp3、RORγt mRNA表达的影响 实验结果见图5,对照组、单独CpG1982组及单独Cp G1826组Foxp3 mRNA水平分别为(6.46±1.38)、(5.76±1.65)、(7.01±1.80),之间相比差异无统计学意义(P>0.05)。而在细胞因子TGF-β、IL-2诱导下Foxp3 mRNA水平明显增高(16.11±3.76),明显高于对照组、CpG1982组及CpG1826组,相比差异均具有统计学意义(均P<0.05),同时加入CpG1982 Foxp3 mRNA水平(16.39±4.06)与细胞因子组相比差异无统计学意义(P>0.05);在TGF-β、IL-2存在的情况下同时加入CpG1826,Foxp3 mRNA水平降低(10.21± 3.20),与只加TGF-β、IL-2组相比差异具有统计学意义(均P<0.05),但仍然高于对照组。
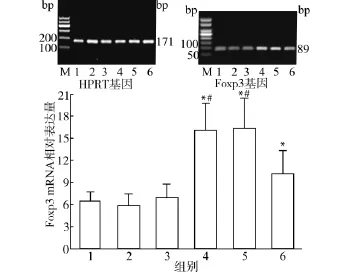
图5 不同诱导因素作用下小鼠脾细胞Foxp3 mRNA的表达Fig.5 Foxp3 mRNA expression in splenocytes of mice under different inducing conditions
而Th17细胞的核转录因子RORγt mRNA水平在细胞因子TGF-β、IL-6、IL-23诱导下表达明显增高(2.43±0.51),明显高于对照组(0.49±0.26)及单独CpG1982组(0.60±0.20),相比差异具有统计学意义(均P<0.05)。单独加入CpG1826后RORγt mRNA水平增高(1.77±0.64),与对照组及单独CpG1982组相比差异具有统计学意义(P<0.05);在TGF-β、IL-6、IL-23存在的情况下加入CpG1826后RORγt mRNA水平(3.91±0.58)高于只加细胞因子组,相比差异具有统计学意义(P<0.05)。见图6。2.3.2 CpG ODN对IL-10、IL-17 mRNA表达的影响 Treg细胞可以分泌IL-10,Th17细胞主要分泌效应分子IL-17,为了研究Cp G ODN对CD4+CD25+Treg细胞、Th17细胞功能的影响,我们利用荧光定量PCR检测了不同诱导因素作用下细胞因子IL-10、IL-17基因表达情况。实验结果发现脾细胞在细胞因子TGF-β、IL-2诱导下IL-10 mRNA水平明显增高(24.25±4.86),明显高于对照组(8.25 ±1.57)、Cp G1982组(9.10±1.97)及Cp G1826组(9.24±2.11),相比差异具有统计学意义(均P<0.05);在TGF-β、IL-2存在的情况下加入CpG1826,IL-10 mRNA水平降低(15.34±3.99),与只加TGF-β、IL-2组相比差异具有统计学意义(P<0.05),但仍然高于正常对照组(P<0.05)。见图7。
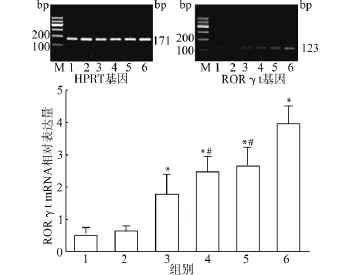
图6 不同诱导因素作用下小鼠脾细胞RORγt m RNA的表达Fig.6 RORγt mRNA expression in splenocytes of mice under different inducing conditions
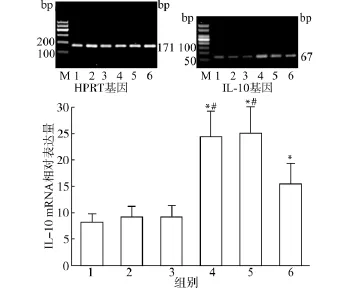
图7 CpG ODN对IL-10 mRNA表达的影响Fig.7 Effect of CpG ODN on IL-10 mRNA expression
在脾细胞培养液中加入细胞因子TGF-β、IL-6、IL-23后IL-17 mRNA水平明显增高(3.88± 1.21),明显高于对照组(0.89±0.21)及CpG1982组(0.98±0.26),差异具有统计学意义(均P<0.05)。单独加入Cp G1826,IL-17 m RNA水平也升高(2.57±0.87),与对照组相比差异具有统计学意义(P<0.05);在TGF-β、IL-6、IL-23存在的情况下加入CpG1826,IL-17 mRNA水平(5.55±1.69)高于只加细胞因子组及细胞因子加Cp G1982组,相比差异具有统计学意义(均P<0.05)(图8)。
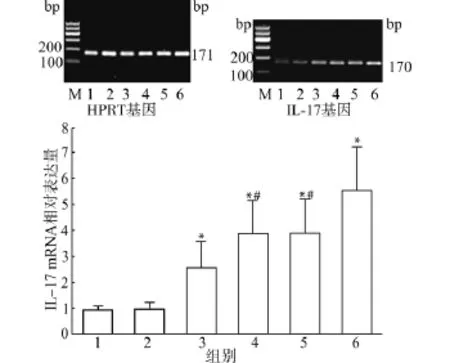
图8 CpG ODN对IL-17 mRNA表达的影响Fig.8 Effect of CpG ODN on IL-17 mRNA expression
2.4 CpG ODN对Foxp3、RORγt、IL-10、IL-17蛋白表达的影响
2.4.1 Cp G ODN对Foxp3、RORγt蛋白表达的影响 Foxp3、RORγt是Treg、Th17细胞特异的核转录因子,为了研究CpG ODN对Treg细胞、Th17细胞分化的影响,我们利用Western blot检测了RORγt、Foxp3蛋白表达水平。实验结果(图9A)发现Treg细胞的核转录因子Foxp3蛋白在细胞因子TGF-β、IL-2诱导下水平明显增高(0.42±0.08),明显高于对照组(0.14±0.03)、CpG1982组(0.15±0.03)及CpG1826组(0.15±0.04),相比差异具统计学意义(均P<0.05);在TGF-β、IL-2存在的情况下加入CpG1826,Foxp3蛋白水平降低(0.26±0.05),与只加TGF-β、IL-2组相比差异具有统计学意义(P<0.05),但仍然高于对照组。Th17细胞的核转录因子RORγt蛋白在细胞因子TGF-β、IL-6、IL-23诱导下水平明显增高(0.28±0.05),明显高于对照组(0.08±0.02)及CpG1982组(0.09±0.02),相比差异具有统计学意义(均P<0.05)。单独加入CpG1826时,RORγt蛋白水平增高(0.22±0.05),与对照组相比差异具有统计学意义(P<0.05);在TGF-β、IL-6、IL-23存在的情况下加入CpG1826,RORγt蛋白水平(0.42±0.08)高于只加细胞因子组及细胞因子加CpG1826组,相比差异具有统计学意义(均P<0.05)。图9B。
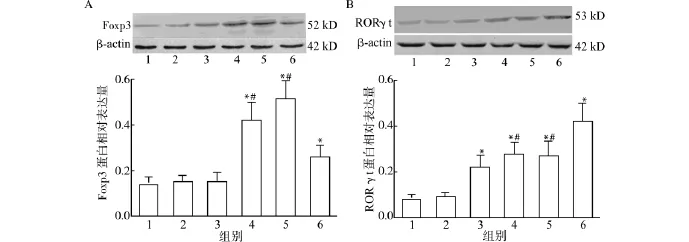
图9 Cp G ODN对Foxp3和RORγt蛋白表达的影响Fig.9 Effect of CpG ODN on Foxp3 and RORγt protein expression
2.4.2 CpG ODN对脾细胞培养上清IL-10、IL-17水平的影响 在培养结束时,收集脾细胞培养上清,利用双抗体夹心ABC-ELISA法检测IL-17、IL-10水平,结果如图10所示。在培养液中加入TGF-β、IL-2时IL-10水平明显增高(211.25±38.57)pg/m L,明显高于对照组(48.24±12.24)pg/m L、CpG1982组(45.21±11.79)pg/m L及CpG1826组(47.58±12.21)pg/m L,相比差异具有统计学意义(均P<0.05),同时再加入Cp G1826培养上清IL-10水平降低(107.27±29.67)pg/m L,与只加TGF-β、IL-2组相比差异有统计学意义(均P<0.05),但仍然高于对照组。在细胞因子TGF-β、IL-6、IL-23诱导下培养上清中IL-17水平明显增高(187.24±37.56)pg/m L,明显高于对照组(24.25 ±6.78)pg/m L及CpG1982组(26.89±7.24)pg/mL,相比差异有统计学意义(均P<0.05)。CpG1982组与对照组相比差异无统计学意义(P>0.05),单独加入Cp G1826时,IL-17水平增高(127.58±26.78)pg/m L,与对照组相比差异有统计学意义(P<0.05);在TGF-β、IL-6、IL-23存在的情况下加入CpG1826,IL-17水平(288.57±61.25)pg/mL)高于只加细胞因子组及细胞因子加CpG1982组,相比差异有统计学意义(均P<0.05)。
3 讨论
机体免疫系统发挥免疫防御作用的过程是复杂而精细的,在识别并清除外来抗原的同时亦伴随相应的调节机制,既要避免对自身抗原的应答又要将免疫应答对宿主组织的病理损伤控制在最小范围,同时还要维持自稳状态,在此过程中,Th细胞和调节性细胞发挥重要的作用。Th17细胞、Treg细胞均属CD4 T细胞亚群,介导细胞因子发挥不同的免疫效应,两者存在动态平衡关系。Th17/Treg失衡参与多种炎症、自身免疫性疾病及肿瘤的发生发展过程[1415]。Treg分化主要受TGF-β诱导,而在TGF-β和IL-6同时作用下CD4 T细胞则分化为Th17细胞,两者之间也存在竞争相关平衡关系,在Th17和Treg细胞间存在相互调控影响的微妙关系[16]。同时,RORγt是Th17细胞分化过程中关键的转录激活因子[1718],主要参与炎症反应、自身免疫性疾病及肿瘤。TGF-β与IL-6可以促进Th0细胞向Th17细胞方向分化,而单独TGF-β可以促进Th0细胞向Treg细胞分化[19],研究证实i Treg细胞可以向Th17细胞方向分化[2021]。CpG是指由胞嘧啶、鸟嘌呤及使两者相连的磷酸酯键组成的二核苷酸(Cytidine-phosphatte-guanine oligodeoxynucl-eotides,Cp G ODN),是一类以非甲基化Cp G为核心的寡聚脱氧核苷酸序列,作为一种免疫佐剂能激活多种免疫细胞[2223]。目前认为Cp G ODN作为免疫佐剂,主要是通过激活机体CTL、NK细胞来发挥免疫增强作用,但关于Cp G ODN对Treg细胞、Th17细胞的影响研究甚少。
我们在体外分离小鼠脾细胞后,在细胞因子TGF-β、IL-2的诱导下,CD4+Foxp3+Treg细胞数量明显增多,核转录因子Foxp3 mRNA和蛋白水平均增高,且细胞培养上清的IL-10的水平也升高,说明TGF-β、IL-2可以上调Foxp3表达,诱导Treg细胞的分化,促进其分泌IL-10。在细胞因子诱导的同时加入CpG1826培养后CD4+Foxp3+Treg细胞数量明显减少,Foxp3水平降低,提示Cp G1826可以通过抑制Foxp3的表达来抑制CD4+Foxp3+Treg细胞的生成,减少分泌IL-10,而加入无免疫原性的CpG1982这种抑制作用则不存在。Treg细胞分n Treg和i Treg两种,为了研究Cp G1826的抑制作用是针对哪种Treg细胞发挥的,我们在没有细胞因子存在的培养条件下单独加入Cp G1826,CD4+Foxp3+Treg细胞与正常对照组相比差异具有统计学意义,提示其对n Treg细胞无明显的抑制作用,而在加入诱导细胞因子的同时加入CpG1826后CD4+Foxp3+Treg细胞数量明显减少,提示CpG1826对iTreg细胞有抑制作用。
既往研究[18]认为Cp G ODN可以促进B细胞分化,刺激B细胞、DC及巨噬细胞分泌IL-6,而IL-6在Treg细胞、Th17细胞分化中起关键作用,TGF-β与IL-6可以促进Th0细胞向Th17细胞方向分化,而单独TGF-β可以促进Th0细胞向Treg细胞分化。因此我们推测,CpG1826可能是通过刺激B细胞、DC及巨噬细胞分泌IL-6,从而发挥其抑制i Treg细胞分化、促进Th17细胞分化的功能,通过改变Treg/Th17的动态平衡而发挥其免疫调节功能。CD4+CD25+Treg细胞与Th17细胞作为免疫系统中两类重要的效应细胞,二者的数量及功能的动态平衡对机体免疫调节发挥着至关重要的作用,免疫功能缺陷或机能失衡是肿瘤发生、发展的重要因素之一,也是众多免疫相关性疾病的致病因素。因此,我们期望未来在本研究的基础上,进一步对Treg/Th17动态平衡的改变在相关疾病免疫治疗中的效应做更加深入的探讨,为免疫佐剂CpG1826在免疫治疗方面的应用奠定更为坚实的理论基础。
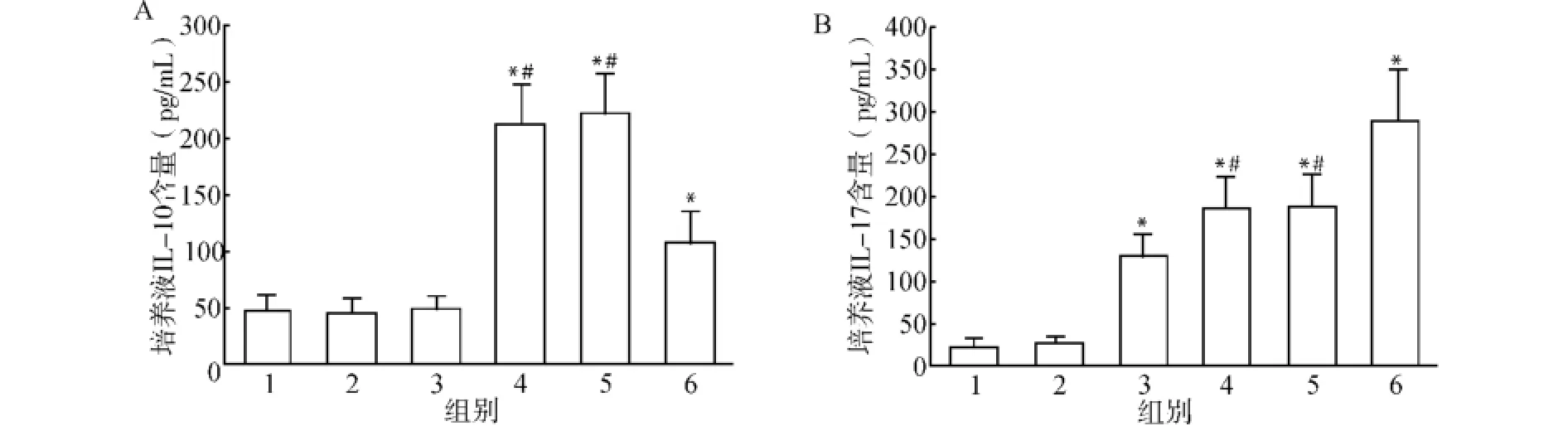
图10 CpG ODN对培养液中IL-10、IL-17水平的影响Fig.10 Effect of Cp G ODN on IL-10 and IL-17 expression in culture solution
[1] Marson A,Kretschmer K,Frampton G M,et al.Foxp3 occupancy and regulation of key target genes during T-cell stimulation[J].Nature,2007,445(7130):931-935.
[2] Wang L,Xie Y,Zhu L J,et a1.An association between immunosenescence and CD4(+)CD25(+)regulatory T cells:a systematic review[J].Biomed Environ Sci,2010,23(4):327-322.
[3] Hossain D M,Panda A K,Manna A,et a1.Foxp3 acts as a cotranscription factor with STAT3 in tumor-induced regulatory T cells[J].Immunity,2013,39(6):1057-1069.
[4] Huh J R,Leung M W,Huang P,et a1.Digoxin and its derivatives suppress TH17 cell differentiation by antagonizing RORγt activity[J].Nature,2011,472(7344):486-490.
[5] Hsieh C S,Lee H M,Lio C W.Selection of regulatory T cells in the thymus[J].Nat Rev Immunol,2012,12(3):157-167.
[6] La Rosa D F,Gelman A E,Rahman A H,et al.CpG DNA inhibits CD4+CD25+Treg suppression through direct My D88-dependent costimulation of effector CD4+T cells[J].Immunol Lett,2007,108(2):183-188.
[7] 郭成,刘青光,杨威,等.融合基因GM-CSF/IL-2转基因疫苗在肝癌特异性免疫治疗中的应用[J].南方医科大学学报,2008,28(2):188-192.
[8] Xiao S,Jin H,Korn T,et al.Retinoic acid increases Foxp3+regulatory T cells and inhibits development of Th17 cells by enhancing TGF-beta-driven Smad3 signaling and inhibiting IL-6 and IL-23 receptor expression[J].J Immunol,2008,181(4):2277-2284.
[9] Gu Y,Yang J,Ouyang X,et al.Interleukin 10 suppresses Th17 cytokines secreted by macrophages and T cells[J].Eur J Immunol,2008,38(7):1807-1813.
[10] Zaph C,Du Y,Saenz S A,et al.Commensal-dependent expression of IL-25 regulates the IL-23-IL-17 axis in the intestine[J].J Exp Med,2008,205(10):2191-2198.
[11] Kopf H,de la Rosa G M,Howard O M,et al.Rapamycin inhibits differentiation of Th17 cells and promotes generation of Foxp3+T regulatory cells[J].Int Immunopharmacol,2007,7(13):1819-1824.
[12] Yang J,Yang M,Htut T M,et al.Epstein-Barr virus-induced gene 3 negatively regulates IL-17,IL-22 and RORgammat[J].Eur J Immunol,2008,38(5):1204-1214.
[13] Guo C,Liu Q G,Zhang L,et al.Double lethal effects of fusion gene of wild-type p53 and JunB on hepatocellular carcinoma cells[J].J Huazhong Univ Sci Technolog[Med Sci],2012,32(5):663-668.
[14] 郑莉,陈紫君,刘纯.Th3、Th17及相关细胞因子在自身免疫性甲状腺疾病发病中的作用[J].中国免疫学杂志,2013,29(1):43-47.
[15] Chu M P,Wang D,Zhang Y Y,et al.Pachymantreatment improves CD4 CD25 Treg counts and serum interleukin 4 and interferon levels in a mouse model of Kawasaki disease[J].Mol Med Rep,2012,5(5):1237-1240.
[16] Darmochwal-Kolarz D,Kludka-Sternik M,Tabarkiewicz J,et a1.The predominance of Th17 lymphocytes and decreased number and function of Treg cells in preeclampsia[J].J Reprod Immunol,2012,93(2):75-81.
[17] Manel N,Unutmaz D,Littman D R.The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat[J].Nat Immunol,2008,9(6):641-649.
[18] Michel M L,Mendes-da-Cruz D,Keller A C,et al.Critical role of ROR-gammat in a new thymic pathway leading to IL-17-producing invariant NKT cell differentiation[J].Proc Natl Acad Sci U S A,2008,105(50):19845-19850.
[19] Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[20] Ayyoub M,Deknuydt F,Raimbaud I,et al.Human memory FOXP3+Tregs secrete IL-17 ex vivo and constitutively express the T(H)17 lineage-specific transcription factor ROR-gamma t[J].Proc Natl Acad Sci U S A,2009,106(21):8635-8640.
[21] Voo K S,Wang Y H,Santori F R,et al.Identification of IL-17-producing FOXP3+regulatory T cells in humans[J].Proc Natl Acad Sci U S A,2009,106(12):4793-4798.
[22] 陈莲一,谢林.Sertoli细胞对同种异体调节性T细胞/辅助性T细胞17分化平衡的调节作用[J].华中科技大学学报:医学版,2014,43(6):626-630,635.
[23] Cerkovnik P,Novakovic B J,Stegel V,et al.Tumor vaccine composed of C-class Cp G oligodeoxynucleotides and irradiated tumor cells induces long-term antitumor immunity[J].BMC Immunol,2010,11(13):45-55.
(2014-12-17 收稿)
Effect of CpG ODN on the Differentiation of Treg/Th17 Cells
Li Jieqiong1,Ji Yuqiang2,Yang Wei1et al
1Department of Hepatobiliary Surgery,First Affiliated Hospital,School of Medicine,Xi’an Jiaotong University,Xi’an 710061,China
2Department of Cardiology,The First Hospital of Xi’an,Xi’an 710002,China
Objective To examine the effects of Cp G ODN on differentiation of Treg/Th17 cells in vitro.Methods Mouse spleen cells separated in vitro were cultured with anti-CD3 and anti-CD28 monoclonal antibody and TGF-β,IL-2 or TGF-β,IL-6,IL-23.After 24 h,CpG1982 or CpG1826 was added to the culture system.Treg/Th17 cells were detected by flow cytometry(FCM)after collecting spleen cells.The m RNA expression levels of Foxp3,RORγt,IL-10 and IL-17 were measured by real time PCR and the protein expression levels of Foxp3 and RORγt were measured by Western blotting.The levels of IL-10 and IL-17 in supernatant were measured by ELISA.Results The number of CD4+Foxp3+Treg cells increased significantly in the presence of TGF-βand IL-2(P<0.05).The mRNA and protein levels of Foxp3 and IL-10 in the cell culture supernatant were significantly increased(P<0.05).CD4+Foxp3+Treg cells were reduced significantly after adding CpG1826(P<0.05).The levels of Foxp3 and IL-10 significantly decreased(P<0.05).The number of Th17 cells was increased significantly in the presence of Cp G1826,or TGF-β,IL-6 and IL-23(P<0.05).The levels of RORγt and IL-10 in the cell culture supernatant were increased(P<0.05).There was a more significant stimulating effect of CpG1826 combined with TGF-β,IL-6 and IL-23 on Th17 cells(P<0.05).Conclusion Cp G1826 can regulate Treg/Th17 cells in vitro through inhibiting differentiation of Treg cells and stimulating differentiation of Th17 cells
CpG ODN; immunoloregulation; Treg; Th17
R392.1
10.3870/j.issn.1672-0741.2015.04.003
*国家自然科学基金资助项目(No.81402039);陕西省自然科学基金资助项目(No.2014JM4103);中央高校基本科研业务费专项资金资助项目(No.xjj2010010)
李洁琼,女,1979年生,副主任护师,博士研究生,E-mail:39251157@qq.com
△通讯作者,Corresponding author,E-mail:guocheng1977@aliyun.com.cn
