短暂性高血糖对大鼠肾细胞缺血再灌注损伤的影响
2015-06-24蒋冠军汪志顺刘修恒
何 立,王 敏,蒋冠军,汪志顺,刘修恒
(武汉大学人民医院泌尿外科,湖北武汉 430060)
·基础研究·
短暂性高血糖对大鼠肾细胞缺血再灌注损伤的影响
何 立,王 敏,蒋冠军,汪志顺,刘修恒
(武汉大学人民医院泌尿外科,湖北武汉 430060)
目的 观察短暂性高血糖症对大鼠肾脏缺血-再灌注损伤的影响。方法 雄性Wistar大鼠18只,随机分为3组:假手术组(Sham)、缺血再灌注组(IR)、缺血再灌注+高糖组(IRH)。缺血再灌注:右肾切除,左肾动脉夹闭25 min后再灌注24 h。高糖:术前葡萄糖溶液2.5 g/kg腹腔注射。取术前(M1)、左肾动脉夹闭25 min后(M2)、再灌注24 h后(M3)的尾静脉血检测血糖、血肌酐和血尿素氮。HE染色观察大鼠肾脏组织学改变;TUNEL法检肾脏细胞的凋亡程度;Western印迹法检测caspase 3蛋白的表达。 结果 在M3时间点,同Sham组相比,IR组血肌酐升高[ (151.68±44.29)mol/L]、caspase 3表达(0.71±0.02)增加、组织学评分(5.14±0.94)升高、 凋亡程度[(42.17±2.52)%]加重(P均<0.05);与IR组相比,IRH组血肌酐[(348.67±9.90) μmol/L]升高、caspase 3表达(1.34±0.02)增加、凋亡程度(70.33±2.85)%加重(P均<0.05)。结论 短暂性高血糖症可加重大鼠肾细胞的缺血-再灌注损伤。
高血糖症;缺血-再灌注损伤;肾脏
现今肾移植的成功率主要受限于缺血-再灌注损伤(ischemia-reperfusion injury,IRI),后者是导致移植肾功能延迟恢复(delayed graft function,DGF)的主要因素。DGF与更高的排斥率有关,在短期可能需要采用透析疗法,并且导致移植存活率下降。加重缺血损伤的因素可以引发DGF,如肾脏的长时间冷藏、供体已死亡等等。最近发现糖尿病可能是另外一个导致DGF的因素。供体的高血糖与更差的移植肾功能恢复有关。动物模型显示,高血糖症可以加重缺血-再灌注损伤[1]。目前,国内尚鲜见关于高血糖症对肾脏缺血-再灌注损伤的研究,而国外对该研究很少、结论不完全一致[2-3]。本研究借助血清指标、组织学改变、免疫组织化学方法探讨短暂性高血糖对肾脏缺血-再灌注损伤的影响。
1 材料与方法
1.1 材料 选取健康雄性Wistar大鼠18只,体重220~260 g,由武汉大学医学院实验动物中心提供,按随机原则分为3组,每组6只:假手术组(sham operation group,Sham);缺血再灌注组(ischemia-reperfusion,IR);缺血再灌注+高糖组(ischemia-reperfusion+hyperglycemia,IRH)。β-actin(内参)、caspase 3抗体购自美国Santa Cruz公司,戊巴比妥、肝素钠自美国Sigma公司购得。
1.2 模型制备 所有动物实验前禁食12 h,自由饮水。sham组大鼠行2%戊巴比妥(45 mg/kg)腹腔注射麻醉,游离双侧肾脏并切除右肾,逐层缝合腹壁。IR组术前进行0.9%氯化钠溶液(1.0 mL/kg)腹腔注射,并在假手术组的基础上,采用无损伤血管钳夹闭左侧肾蒂25 min后解除血流阻断,恢复灌流24 h,肾脏颜色由暗红变为鲜红表明再灌注良好。IRH组手术步骤与缺血再灌注组一致,氯化钠溶液替换为25%葡萄糖溶液(2.5 g/kg)腹腔注射。
1.3 标本采集与检测 取大鼠在术前(M1)、左肾动脉夹闭25 min后(M2)、再灌注24 h后(M3)的尾静脉血,检测血糖值(Glu)、血肌酐(SCr)值和尿素氮值(BUN)。取肾脏血流再灌注24 h后的肾组织标本进行切片,行HE染色观察肾脏的组织学改变,根据评分标准(Paller法:400高倍视野下随机选择10个肾小管进行计分,正常肾小管计0分;刷状缘损伤计1分;肾小管扩张计1分;细胞肿胀或扁平计1分;管腔可见坏死脱落但未形成管型的细胞碎片计1分;刷状缘脱落计2分;形成管型计2分[4]),估算肾小管损伤面积比例,半定量评估肾小管间质的缺血损伤程度。TUNEL法检测肾脏细胞凋亡程度:将留取肾组织进行常规固定,经包埋后切片为5 μm厚度,转到多聚赖氨酸包被的玻片,置于200倍光学显微镜下,随机选取6个互不重叠的视野计数阳性细胞。Western印迹法检测caspase 3蛋白的表达。
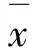
2 结 果
2.1 各组大鼠在M1、M2、M3时间点的血糖值、血肌酐值和血尿素氮值 sham组的Wistar大鼠在M1、M2、M3各时期的血糖均维持在正常水平:由于手术应激,在M2时期略微升高,于M3时期回归基线水平。与IR组相比,IRH组由于术前进行25%葡萄糖溶液(2.5 g/kg)腹腔注射而血糖更高(P<0.05,表1)。
sham组的血肌酐在各时期维持在正常水平,这也侧面印证了血肌酐值相对来说敏感性较差,仅当肾小球滤过率(glomerular filtration rate,GFR)下降50%~60%才开始升高。与sham组相比,IR组在M3时期由于缺血-再灌注损伤而导致肾功能受损,肌酐和血尿素氮略高(P<0.05);与IR组、sham组相比,IRH组在M3时期由于缺血-再灌注损伤而导致肾功能受损程度更重,肌酐和血尿素氮明显升高(P<0.01),表明肾脏急性缺血期的高血糖可能加重缺血-再灌注造成的肾损伤,使肾功能明显下降。见表1。
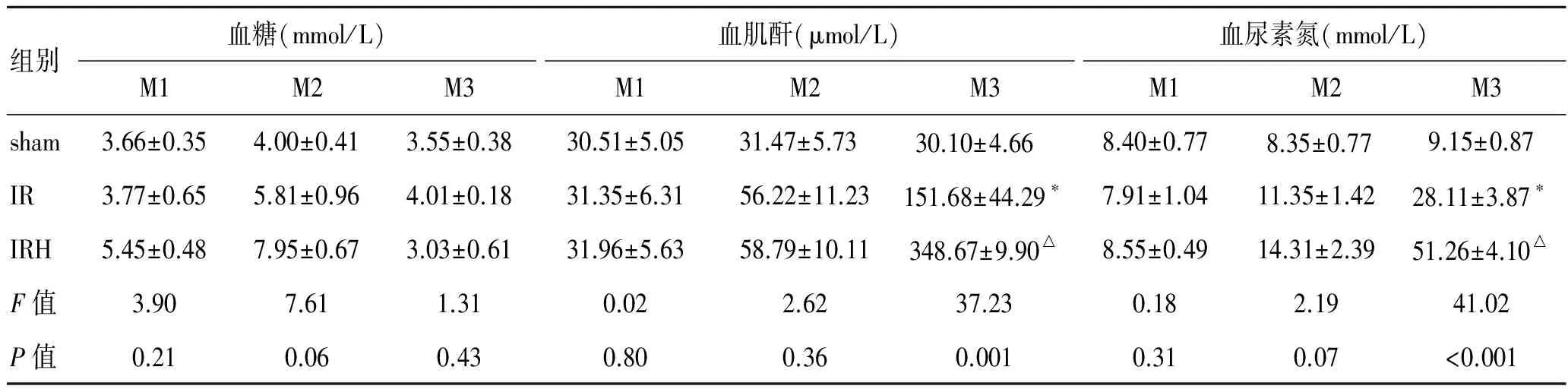
表1 大鼠在M1、M2、M3时间点的血糖、血肌酐和血尿素氮值
*与sham组比较,P<0.05;△与其他2组比较;P<0.01。
2.2 HE染色镜检结果 IR组肾小管间质损伤评分5.14±0.94,镜下可见肾小管结构异常,有炎性细胞浸润,可见细胞水肿及坏死、刷状缘损伤脱落、管型形成,与Sham组0.52±0.60相比,肾小管计分增加(P<0.05)。IRH组评分6.95±0.81,在镜下可见肾小管结构明显异常,炎性细胞广泛浸润,可见大范围细胞坏死、刷状缘损伤脱落、管型形成,与IR组相比肾小管计分差异无统计学意义(P=0.18)。表明缺血-再灌注损伤可以导致肾小管上皮细胞受损坏死。见图1。
2.3 TUNEL法检测肾脏细胞凋亡结果 TUNEL法染色显示Sham组仅有少量凋亡细胞表达;与Sham组相比,IR组的肾脏缺血-再灌注区域凋亡细胞数量增加(P<0.05);与IR组、Sham相比,IRH组的缺血-再灌注区域凋亡细胞数量增加(P<0.05)。表明缺血-再灌注损伤可以导致肾细胞发生凋亡,而急性缺血期的高血糖可以促进这种损伤。见图2。

图1 3组大鼠肾脏组织学HE染色镜检结果(×400)
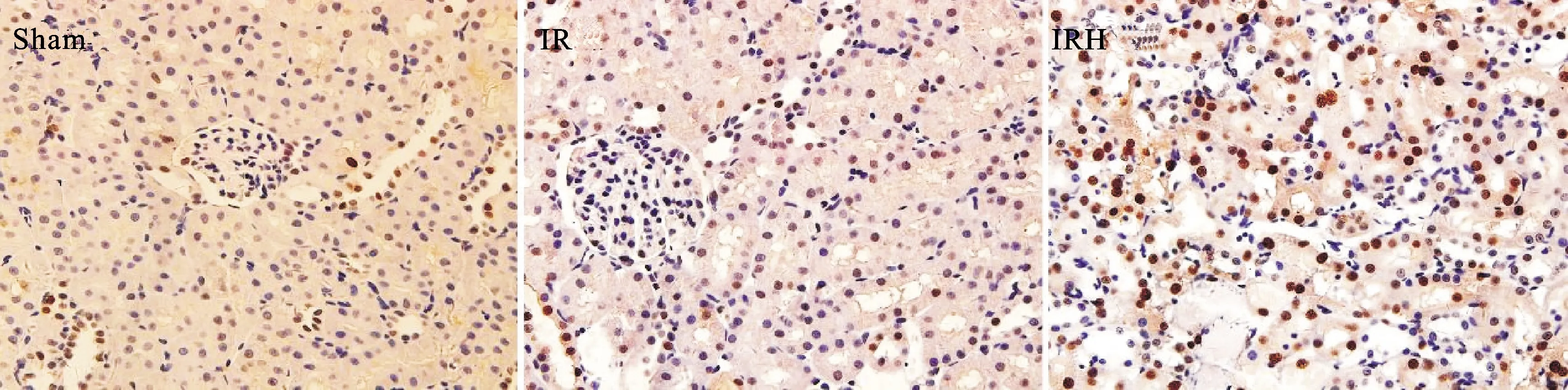
图2 各组TUNEL法检测肾脏细胞凋亡结果
2.4 Western印迹法检测caspase 3蛋白表达结果 同Sham组相比,IR组的caspase 3蛋白表达增加(P<0.05);与IR组、Sham组相比,IRH组的caspase 3蛋白表达增加(P<0.05,图3)。

图3 Western印迹法检测caspase 3蛋白表达结果
3 讨 论
本研究通过血清指标、组织学改变、免疫组织化学方法,表明急性缺血期的短暂性高血糖症可加重大鼠肾细胞的缺血-再灌注损伤。这种效应的机制可能是,高血糖症可以加重肾脏在缺血期间的氧化应激,可以通过活性氧分子数量增加反映。多个通路可以产生活性氧,这些通路包含的酶有过氧化物酶、NADPH氧化酶、黄嘌呤氧化酶,在肾脏的内皮细胞、血管平滑肌细胞中,NADPH氧化酶及其亚型决定了活性氧的含量。动物实验表明,上调肾脏中NADPH氧化酶的表达,可以促进炎性细胞因子、趋化因子、生长因子、粘附分子的产生,从而加重炎症反应和纤维化[5]。此外,高血糖症可通过氧化机制直接升高循环中的细胞因子浓度,而在糖耐量受损(impaired glucose tolerance,IGT)的患者中,这种效应更加明显,表明在糖尿病患者,高血糖症可能与免疫激活存在因果关系。临床研究显示,长期的高血糖症对患者的预后有不良影响[6]。由于高血糖症与活性氧簇(reactive oxygen species,ROS)的形成有关,导致心肌缺血、炎症和心肌细胞死亡,其还被当作造成心脏损伤的首要因素[7]。
腹腔注射葡萄糖诱导大鼠发生短暂性高血糖症,然后在缺血-再灌注发生之前使用促红细胞生成素(erythropoietin,EPO)[8-9],可以显著减少肾小管细胞凋亡。这种效应的机制可能是源于其抗凋亡、抗炎、抗氧化特性,抑制炎性细胞因子IL-10和TNF-α的表达,还抑制caspase家族尤其是caspase 3,而caspase 3是高血糖下介导凋亡的主要因素。多聚ADP-核糖聚合酶(poly-ADP-ribose polymerase,PARP)参与修复DNA损伤,对维护基因的完整性至关重要。在细胞凋亡启动时,PARP被caspase 3剪切成两个片段,使PARP与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能;结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,造成细胞凋亡[10]。EPO和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)已被证明可以调节肾脏缺血损伤,并且在缺血-再灌注损伤之后EPO和VEGF水平都会发生改变。VEGF可明显促进血管再生,有利于恢复血供,因而是细胞抵抗低氧损伤的关键因素。在急性和慢性高血糖症的动物模型,VEGF的表达都发生了降低[11]。低氧状态可以激活EPO的表达,而在肾脏的缺血-再灌注损伤中EPO的表达有所下调。
不同于慢性的血糖水平升高,大多数研究使用的动物的胰岛素水平正常,并且对胰岛素的反应敏感,这些动物在再灌注24 h之后血糖都回归到正常水平[12]。在慢性高血糖症,机体的炎性状态基线升高,增强氧化应激从而加重了器官损伤,在生理应激时这种损伤进一步恶化[13]。高血糖症出现的时刻与缺血损伤紧密关联,在缺血-在灌注损伤之前控制血糖,对肾功能的保护、防止出现菌血症和贫血具有重要意义[14]。高血糖症的持续时间不仅与器官的功能状态有关,还能影响器官对缺血的耐受能力[15]。在腹腔注射葡萄糖之前血糖的轻微上升可能是应激引起的高血糖症,表明可能存在一个血糖的临界点,只有超过这个临界点的血糖浓度才对缺血的肾脏有害。为了寻找这个临界点,还需要进一步研究。
[1] CAETANO AM, VIANNA FILHO PT, CASTIGLIA YM, et al. Erythropoietin attenuates apoptosis after ischemia-reperfusion-induced renal injury in transiently hyperglycemic Wister rats [J].Transplant Proc,2011,43(10):3618-3621.
[2] CARRARETTO AR, VIANNA FILHO PT, CASTIGLIA YM, et al. Do propofol and isoflurane protect the kidney against ischemia/reperfusion injury during transient hyperglycemia? [J].Acta Cir Bras,2013,28(3):161-166.
[3] FRAGIADAKI M, HILL N, HEWITT R, et al. Hyperglycemia causes renal cell damage via CCN2-induced activation of the TrkA receptor: implications for diabetic nephropathy [J].Diabetes,2012,61(9):2280-2288.
[4] GAO J, ZHANG D, YANG X, et al. Lysophosphatidic acid and lovastatin might protect kidney in renal I/R injury by downregulating MCP-1 in rat [J].Ren Fail,2011,33(8):805-8010.
[5] GAO X, YANG T, LIU M, et al. NADPH oxidase in the renal microvasculature is a primary target for blood pressure-lowering effects by inorganic nitrate and nitrite [J].Hypertension,2015,65(1):161-170.
[6] AZRIEL S, CASAL F, DALAMA B, et al. Glycemic control parameters in insulin-naïve patients with uncontrolled type 2 diabetes referred to endocrinologists, and degree of implementation of the national Spanish consensus for the management of hyperglycemia. [J].Endocrinol Nutr,2014,61(10):541-547.
[7] ARSLAN M, COMU FM, ALKAN M, et al. Effect of levosimendan on erythrocyte deformability during myocardial ischaemia-reperfusion injury [J].Bratisl Lek Listy,2015,116(1):47-50.
[8] SHEN S, JIN Y, LI W, et al. Recombinant human erythropoietin pretreatment attenuates acute renal tubular injury against ischemia-reperfusion by restoring transient receptor potential channel-6 expression and function in collecting ducts [J].Crit Care Med,2014,42(10):e663-672.
[9] STOYANOFF TR, TODARO JS, AGUIRRE MV, et al. Amelioration of lipopolysaccharide-induced acute kidney injury by erythropoietin: involvement of mitochondria-regulated apoptosis [J].Toxicology,2014,6:318:13-21.
[10] ZHANG X, QI DD, ZHANG TT, et al. Antitumor activity of adenoviral vector containing T42 and 4xT42 peptide gene through inducing apoptosis of tumor cells and suppressing angiogenesis [J]. Mol Med Rep,2015,11(3):2083-2091.
[11] KRAJEWSKI KM, NISHINO M, RAMAIYA NH, et al. RECIST 1.1 compared with recist 1.0 in patients with advanced renal cell carcinoma receiving vascular endothelial growth factor-targeted therapy [J].AJR Am J Roentgenol,2015,204(3):W282-288.
[12] PERUMAL PS, ANASWARA PV, MUTHURAMAN A, KRISHAN S. Therapeutic potency of saponin rich aqueous extract of Scoparia dulcis L. in alloxan induced diabetes in rats [J].Ayu,2014,35(2):211-217.
[13] PLUMMER MP, BELLOMO R, COUSINS CE, et al. Dysglycaemia in the critically ill and the interaction of chronic and acute glycaemia with mortality [J]. Intensive Care Med,2014,40(7):973-980.
[14] OHASHI N, TSUJI N, NAITO Y, et al. Alogliptin improves steroid-induced hyperglycemia in treatment-naïve Japanese patients with chronic kidney disease by decrease of plasma glucagon levels [J].Med Sci Monit,2014,20:587-593.
[15] ALI HA, ALMAGHRABI OA, AFIFI ME. Molecular mechanisms of anti-hyperglycemic effects of Costus speciosus extract in streptozotocin-induced diabetic rats [J].Saudi Med J,2014,35(12):1501-1506.
(编辑 何宏灵)
Impact of transient hyperglycemia on renal cell ischemia-reperfusion injury in rats
HE Li, WANG Min, JIANG Guan-jun, WANG Zhi-shun, LIU Xiu-heng
(Department of Urology, People’s Hospital of Wuhan University,Wuhan University,Wuhan 430060,China)
Objective To investigate whether transient hyperglycemia exacerbates renal cell ischemia-reperfusion injury in rats. Methods A total of 18 male Wistar rats were randomly divided into 3 groups: sham operation group (sham group); renal ischemia/reperfusion group (IR group), and renal ischemia/reperfusion + hyperglycemia group (IRH group). Hyperglycemia was induced by intraperitoneal injection of dextrose before operation. Serum creatinine (SCr), blood urea nitrogen (BUN) and glucose levels were measured at baseline (M1), right after ischemic period (M2), and 24 hours after reperfusion (M3). Histological alterations were evaluated with HE staining. Renal cell apoptosis was estimated with TUNEL staining assay. The expression of caspase 3 was analyzed with Western blotting. Results At the point of M3,in the IR group, the levels of SCr [(151.68±44.29)μmol/L] and caspase 3 (0.71±0.02) were upregulated, Paller’s score (5.14±0.94) was higher and the number of apoptotic cells [(42.17±2.52)%] was larger, compared with the sham group (allP<0.05). In the IRH group, the levels of SCr [(348.67±9.90)μmol/L] and caspase3 (1.34±0.02) were increased, and the number of apoptotic cells [(70.33±2.85)%] was larger, compared with the IR group (allP<0.05). Conclusion Transient hyperglycemia can deteriorate renal cell ischemia-reperfusion injury in rats.
hyperglycemia; ischemia-reperfusion injury; kidney
2015-02-14
2015-04-07
刘修恒,教授,博士生导师.E-mail:champagnemw@gmail.com
何立(1988-),在读硕士,研究方向为泌尿系统肿瘤及结石的治疗.E-mail: champagnemw@gmail.com.
R619.9
A
10.3969/j.issn.1009-8291.2015.07.018
