大孔吸附树脂纯化裸花紫珠总黄酮的工艺优选*
2015-06-24刘勇张鹏威苏文琴刘晓巩克明项妮
刘勇,张鹏威,苏文琴,刘晓,巩克明,项妮
(1.温州医科大学附属第二医院药剂科,温州 325027;2.海南医学院药学院,海口 571199;3.浙江省温州市中医院,温州 325000;4.盐城卫生职业技术学院,盐城 224005)
·药物制剂与药品质量控制·
大孔吸附树脂纯化裸花紫珠总黄酮的工艺优选*
刘勇1,张鹏威2,苏文琴2,刘晓3,巩克明4,项妮2
(1.温州医科大学附属第二医院药剂科,温州 325027;2.海南医学院药学院,海口 571199;3.浙江省温州市中医院,温州 325000;4.盐城卫生职业技术学院,盐城 224005)
目的 优选裸花紫珠总黄酮的大孔吸附树脂纯化工艺。方法 以总黄酮的吸附率和洗脱率为指标,采用静态吸附优选AB-8 、D-101、HP-20、HP2MG等大孔吸附树脂的型号;通过单因素实验优选裸花紫珠的动态吸附分离参数。结果 HP-20型树脂的吸附效率较高,其最佳的纯化工艺为pH 3.0的4.46 mg·mL-1裸花紫珠提取液,以3 BV·h-1流速上样,3 BV·h-1水洗1 h,再用75%乙醇4 BV,以2 BV·h-1流速进行洗脱,经大孔吸附树脂纯化后的裸花紫珠总黄酮的平均纯度可达47.4%。结论 HP-20型大孔吸附树脂适用于裸花紫珠总黄酮的初步纯化。
裸花紫珠;总黄酮;大孔吸附树脂
裸花紫珠(CallicarpanudifloraHook.et Arn.)为马鞭草科紫珠属植物的干燥地上部分,主要分布于我国广东、广西、海南等地,具有抗菌、止血、散瘀消肿之功效,主治各种炎症、外伤出血、跌打肿痛、风湿肿痛、肺结核咳血、胃肠出血等症[1 ]。文献报道裸花紫珠有效成分主要为总黄酮,如紫珠萜酮、芹菜素、木犀草素、槲皮素、芦丁及其配糖体等黄酮类物质[2-3]。据悉目前上市的裸花紫珠制剂的提取工艺主要为水煎煮提取,定量质量控制主要以芦丁作为对照测定总黄酮[4]。然而目前裸花紫珠水提取物中总黄酮的含量较低,为了提高总黄酮含量,减小服用剂量,笔者采用大孔吸附树脂法纯化裸花紫珠总黄酮,考察了提取工艺参数,为裸花紫珠制剂开发提供科学依据。
1 仪器与试药
UV-1600紫外分光光度计(天津拓普) 。AB-8 和D-101大孔吸附树脂(沧州宝恩吸附材料科技有限公司,批号分别为20100825,20101106),HP-20和HP2MG(日本三菱公司,批号分别为20101203,20101015),芦丁(供含量测定用,中国食品药品检定研究院,批号:100080-200707),其他试剂均为分析纯。裸花紫珠水提取浸膏由海南九芝堂药业有限公司提供(批号:20120302),浸膏含水量为39.2%。
2 方法与结果
2.1 裸花紫珠总黄酮含量测定
2.1.1 标准曲线的绘制 精密称取芦丁对照品10 mg,置50 mL量瓶中,加60%乙醇溶解并稀释到刻度,得芦丁对照品储备液。精密吸取0,1,2,3,4,5,6 mL芦丁对照品储备液,分别置25 mL量瓶中,各加水至6 mL,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加10%硝酸铝溶液1 mL,摇匀,放置6 min,加4%氢氧化钠溶液10 mL,再加水至刻度,摇匀,放置15 min。以第1管为空白对照,在507 nm波长处测定吸光度,以吸光度(A)为纵坐标,质量浓度(C)为横坐标绘制标准曲线,得回归方程A=15.223C+0.000 2,r=0.999 1,芦丁在8~48 μg·mL-1呈良好线性关系。
2.1.2 样品测定 取裸花紫珠各样品溶液(粗提液或洗脱液),精密吸取适量溶液(1~6 mL),照“2.1.1”项下方法,自“分别置25 mL量瓶中,各加水至6 mL”开始操作,测定各样品溶液的A值,根据回归方程计算总黄酮浓度[4]。
2.2 裸花紫珠提取物的处理 裸花紫珠水提浸膏用10倍质量的65%乙醇浸泡,放置过夜,抽滤,用适量65%乙醇洗涤滤渣,合并滤液,减压蒸至无醇味,备用。测得裸花紫珠醇沉物的总黄酮含量为15.6%。醇沉浸膏临用前用适量热纯化水稀释。
2.3 树脂的预处理 分别取商品大孔吸附树脂AB-8、D-101、HP-20、HP2MG型大孔树脂适量,于烧杯中加适量纯化水浸泡24 h,2 mol·L-1盐酸浸泡12 h,再用纯化水洗至中性,2 mol·L-1氢氧化钠溶液浸泡12 h,纯化水洗至中性。最后用95%乙醇浸泡24 h,上柱,用95%乙醇洗脱,直至流出液和水混合无白色浑浊,再洗至无醇味[5],备用。
2.4 静态吸附实验 取处理好的湿树脂AB-8 、D-101、HP-20、HP2MG各10.0 mL(湿体积,下同),置于4 只250 mL 锥形瓶,加入总黄酮浓度为13.39 mg·mL-1(相当于生药材浓度为0.5 g·mL-1)的裸花紫珠醇沉物溶液100 mL,不停振摇24 h,滤过,用20 mL纯水洗涤树脂,洗液与滤液合并,测滤液中总黄酮含量,计算吸附量和吸附率。再加95%乙醇100 mL,振摇,放置24 h,使树脂解吸附,滤过,树脂用适量95%乙醇洗涤,合并滤液,测定溶液中总黄酮浓度,计算解析量和解析率。
吸附量=(吸附前样品溶液的总黄酮量-吸附后样品溶液中总黄酮量)/树脂体积;吸附率(%)=(上样液中总黄酮的量-吸附后样品溶液中总黄酮量)/上样液中总黄酮的量×100%;解吸量=(乙醇洗脱液中总黄酮的浓度×乙醇洗脱液的体积)/树脂体积;解吸率(%)=解吸量/解吸量×100%。结果见表1。
表1 4种树脂对裸花紫珠总黄酮的静态吸附
Tab.1 Static adsorption of total flavonoids fromCallicarpanudifloraHook.et Arn by four kinds of resins
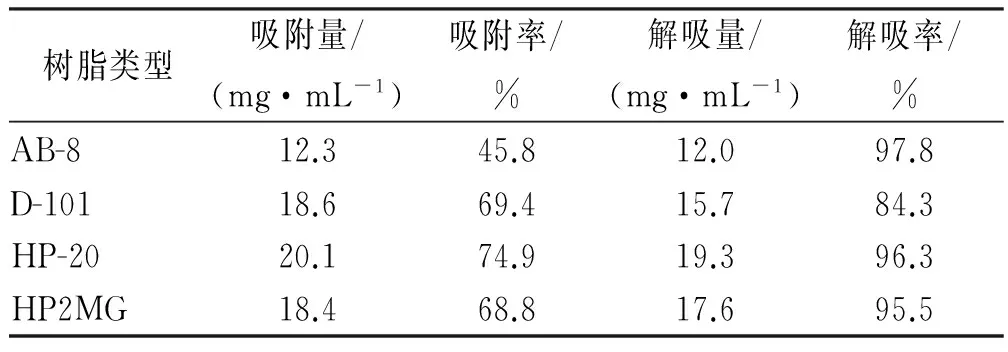
树脂类型吸附量/(mg·mL-1)吸附率/%解吸量/(mg·mL-1)解吸率/%AB-812.345.812.097.8D-10118.669.415.784.3HP-2020.174.919.396.3HP2MG18.468.817.695.5
2.5 动态吸附实验 取处理好的湿树脂AB-8 、D-101、HP-20、HP2MG各10.0 mL,分别置于4 只玻璃层析柱中,加入总黄酮浓度为13.39 mg·mL-1的裸花紫珠醇沉物溶液,以1 BV流速进行动态吸附,流出液每10 mL接收一份,每一份取适量,用盐酸-镁粉反应,并辅以TLC 薄层检测流出液的黄酮类化合物,待盐酸-镁粉反应呈阳性时,停止上样,记录上样量,用4 BV 水洗,收集水洗液,测定溶液中总黄酮的含量。再用95%乙醇洗脱,洗至洗液近无色,收集洗脱液于1 000 mL量瓶中,定容,测定溶液中总黄酮的含量。计算吸附量、吸附率、解析量和解析率。结果见表2。
表2 4种树脂对裸花紫珠总黄酮的动态吸附
Tab.2 Dynamic adsorption of total flavonoids fromCallicarpanudifloraHook.et Arn by four kinds of resins
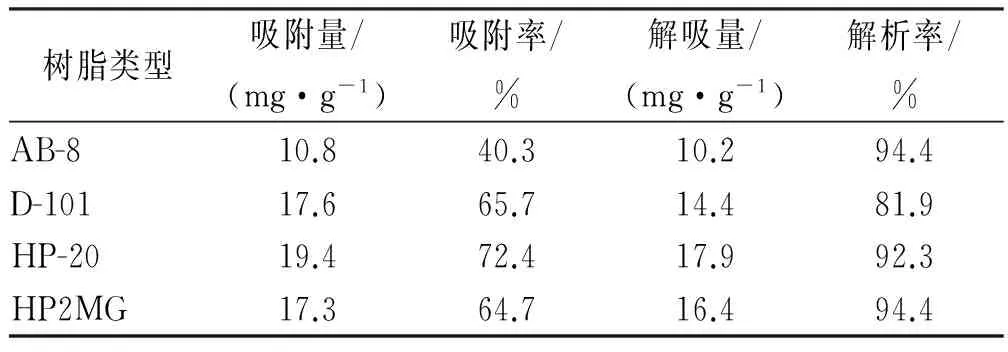
树脂类型吸附量/(mg·g-1)吸附率/%解吸量/(mg·g-1)解析率/%AB-810.840.310.294.4D-10117.665.714.481.9HP-2019.472.417.992.3HP2MG17.364.716.494.4
由表1,2可知,4种型号树脂中HP-20和HP2MG大孔吸附树脂的吸附率较大,而且其静态解吸率>95%,从动态吸附数据看出,HP-20的吸附率最高,结合树脂成本和工艺的可操作性,选择HP-20型大孔吸附树脂。
2.6 上样溶液pH的考察 黄酮类化合物为多羟基酚类,呈弱酸性,因此pH 对其吸附性能有一定影响。本实验考察pH对吸附及解吸附的影响。分别将总黄酮浓度为13.39 mg·mL-1的裸花紫珠醇沉物溶液用盐酸或氢氧化钠溶液调节溶液pH至1.0,3.0,5.0,7.0,9.0。按“2.4”项同法操作,测定HP-20树脂的吸附率和解吸率,结果见表3。可见,随着pH的升高,总黄酮吸附率下降,在pH为1.0~3.0时,吸附率达到最大,且pH1.0和pH3.0之间差异无统计学意义,其原因可能是在低pH阶段,黄酮呈分子型,有利于其吸附。考虑到酸性太强对设备的腐蚀和对环境的影响较大,故设计将裸花紫珠上柱液pH调至3.0。
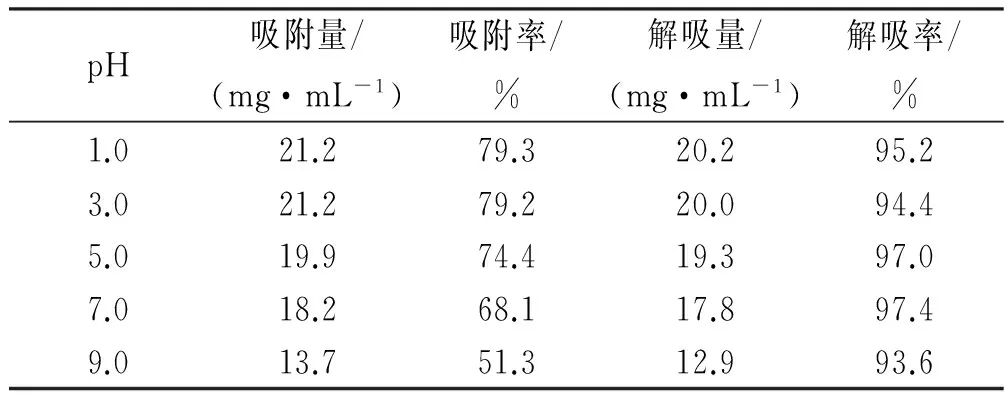
表3 pH对吸附的影响
2.7 动态吸附和动态洗脱实验 将裸花紫珠提取样品溶液调节pH至3.0,以一定流速通过装有HP-20树脂的层析柱,测定流出液中黄酮类化合物浓度,绘制树脂泄漏曲线。考察样品溶液上柱浓度、上样量等因素对树脂吸附性能的影响。
以不同浓度乙醇对已吸附样品的树脂进行动态洗脱,考察最佳乙醇浓度、最佳洗脱体积等因素对树脂解吸性能的影响,测定不同条件下解吸液中黄酮类化合物的浓度,确定最佳解吸条件。
2.7.1 样品溶液浓度考察 将13.39 mg·mL-1样品溶液100 mL 分别用纯化水稀释2 倍(6.70 mg·mL-1)、3 倍(4.46 mg·mL-1)、4 倍(3.35 mg·mL-1)、5 倍(2.68 mg·mL-1),调节pH为3.0,分别通过5 根装有HP-20大孔吸附树脂20.0 mL的层析柱,流速2 BV·h-1,收集流出液,测定溶液总黄酮含量,结果13.39,6.70,4.46,3.35,2.68 mg·mL-1样品溶液的吸附量分别为9.83,14.03,16.46,15.76,11.77 mg·mL-1,树脂吸附量与样品溶液浓度和体积有一定关系。在初始阶段,样品浓度降低,吸附量增大,随后随着样品浓度的下降,吸附率反而降低。用HP-20大孔树脂吸附裸花紫珠粗提液中的总黄酮,样品溶液浓度为4.46 mg·mL-1时树脂对黄酮吸附量最大,考虑到样品浓度过低上样时间也延长,故确定4.46 mg·mL-1为上样溶液浓度。
2.7.2 上样量的考察 将一定量4.46 mg·mL-1样品溶液,调节pH为3.0,以2 BV·h-1流速通过装有HP-20大孔吸附树脂20 mL的层析柱,流出液每20 mL收集一次,测定各份流出液中总黄酮浓度,绘制泄漏曲线,结果见图1。当上样量为380 mL时,流出液中总黄酮含量处在迅速增大的拐点,所以用HP-20大孔吸附树脂分离裸花紫珠提取液中的总黄酮时,最佳上样量为380 mL,约为树脂体积的19倍。
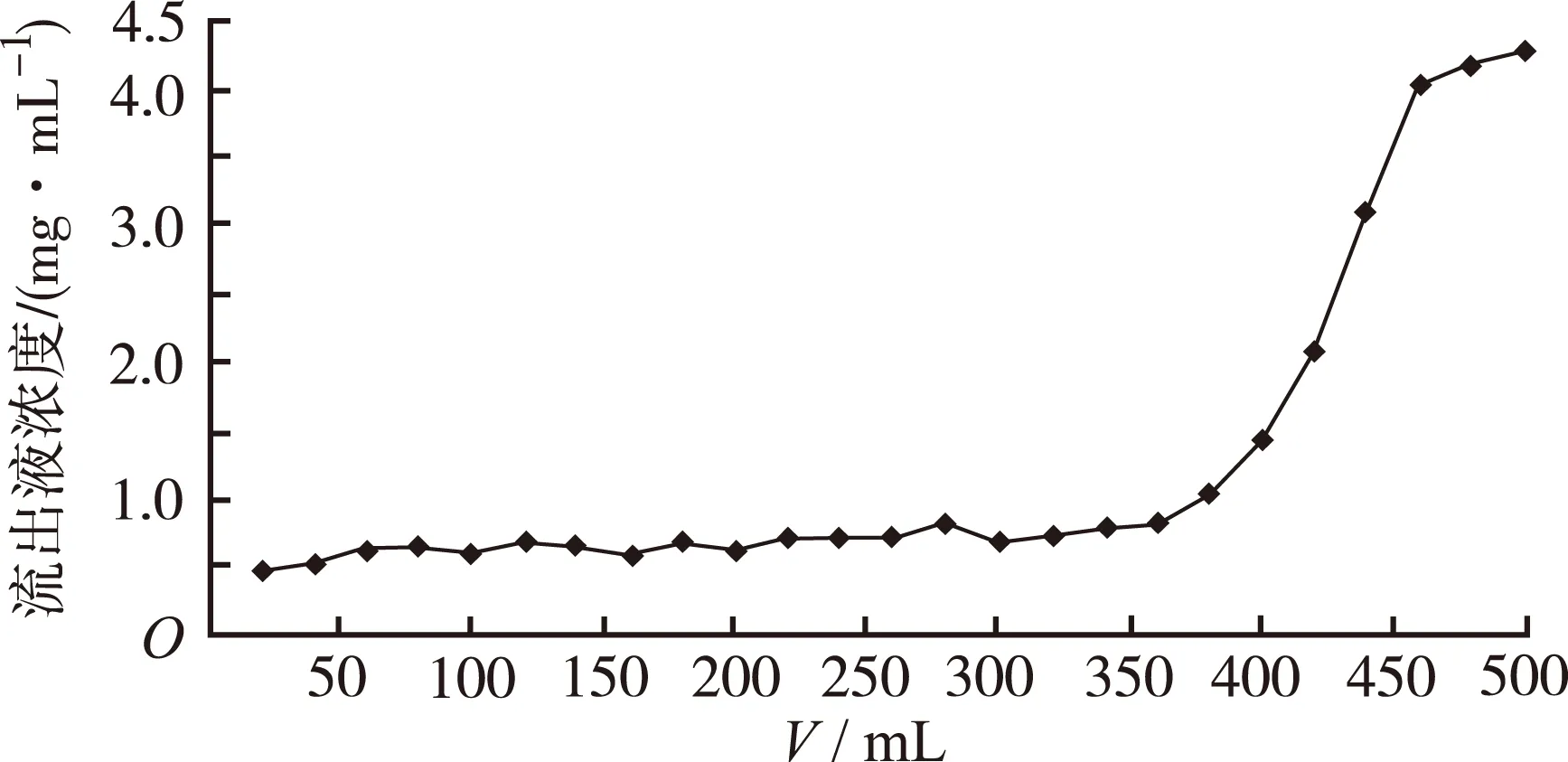
图1 泄漏曲线
2.7.3 上样流速考察 取pH为3.0的4.46 mg·mL-1的裸花紫珠提取液4份,每份380 mL,通过大孔树脂色谱柱(树脂体积20 mL,径高比1:8),分别以流速为2,3,4 BV·h-1上样,收集上样流出液,测定总黄酮含量。结果流速为2,3,4 BV·h-1上样时,对应的流出液中总黄酮含量分别为0.373,0.386,0.992 mg·mL-1。结果表明当上样流速达到4 BV·h-1时,流出液中总黄酮含量明显增高。为了保证吸附完全和节省时间,选择上样流速为3 BV·h-1。
2.7.4 水洗体积考察 取pH为3.0的4.46 mg·mL-1裸花紫珠提取液380 mL,通过大孔树脂色谱柱(树脂体积20 mL,径高比1:8),分别以3 BV·h-1的流速进行动态吸附,然后水洗除杂,每一0.5 BV收集一份水提液,用盐酸-镁粉反应,并辅以薄层色谱检测流出液的黄酮类化合物,结果显示水洗液中未检出总黄酮,至3 BV时,洗出液溶液颜色近无色,为防止总黄酮流失和节省时间,故确定水洗除杂体积为3 BV。
2.7.5 洗脱乙醇浓度考察 取已处理的HP-20型吸附树脂5 份,每份20 mL,分别加pH为3.0的4.46 mg·mL-1裸花紫珠提取液380 mL,以3 BV·h-1流速上样,用3 BV水以3 BV·h-1水洗,再分别用10%,30%,50%,75%,95%乙醇各40 mL,以1 BV·h-1流速进行洗脱,分别收集洗脱液,20 mL为一瓶,测定总黄酮含量。结果吸附率分别为78.2%,79.3%,77.7%,79.4%,79.5%;洗脱率依次为18.2%,67.5%,70.4%,92.3%,96.4%。结果说明随乙醇浓度的增大,洗脱率逐渐增大,到75%以后,洗脱率基本稳定在92%以上,从节约成本角度出发确定洗脱液浓度为75%。
2.7.6 洗脱速率考察 取已处理的HP-20型吸附树脂5 份,每份20 mL,分别加pH为3.0的4.46 mg·mL-1裸花紫珠提取液380 mL,以3 BV·h-1流速上样,以3 BV·h-1水洗,再用75%乙醇分别以1,2,3 BV·h-1流速洗脱,收集过柱液并记录体积,测定总黄酮含量。结果总黄酮吸附率分别为79.2%,76.8%,79.4%;洗脱率依次为93.3%,92.0%,87.8%。说明洗脱速率对树脂的洗脱率有一定影响,1 和2 BV·h-1之间并不很明显,故确定最佳洗脱速率为2 BV·h-1。
2.7.7 洗脱曲线的绘制 取已处理的HP-20型吸附树脂20 mL,分别加pH为3.0的4.46 mg·mL-1裸花紫珠提取液380 mL,以3 BV·h-1流速上样,用3 BV水以3 BV·h-1水洗,用浓度为75%乙醇溶液,以2 BV·h-1流速进行洗脱,每10 mL收集1份洗脱液,测定总黄酮含量,绘制洗脱曲线,见图2。4 BV终点已经检测不出总黄酮。
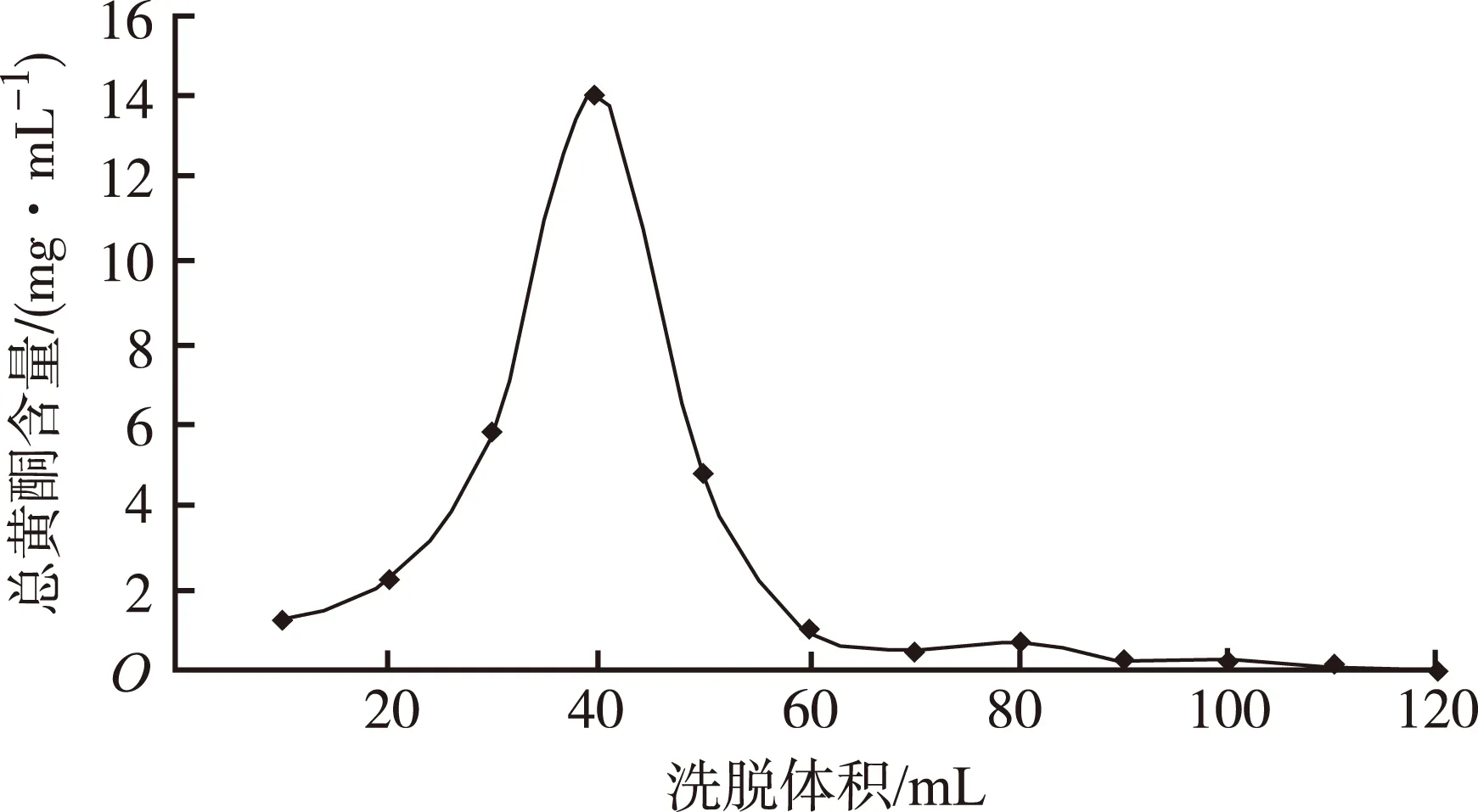
图2 总黄酮洗脱曲线
2.7.8 验证实验 取已处理的HP-20型吸附树脂40 mL,分别加pH为3.0的4.46 mg·mL-1裸花紫珠提取液720 mL,以3 BV·h-1流速上样,以3 BV·h-1水洗,用浓度为75%乙醇溶液,以2 BV·h-1流速进行洗脱,收集洗脱液,50 ℃减压回收乙醇,60 ℃减压干燥成干浸膏,测定浸膏中总黄酮含量,计算总黄酮回收率及含量,见表4。其中回收率(%)=浸膏中总黄酮的量/上样液中总黄酮的量×100%;含量(%)=浸膏中总黄酮的量/浸膏的质量×100%。
表4 验证实验

Tab.4 Verification test %
2.7.9 树脂重复使用实验 用新处理的同一根树脂柱,按以上确定的工艺上样、水洗、乙醇洗脱,用4 BV纯水冲洗树脂柱后,重复以上操作6次,测定总黄酮回收率和含量。见表5,可见树脂重复使用4次以后总黄酮回收率急剧降低,因此确定树脂重复使用4次就需要再生处理。
表5 树脂重复使用实验
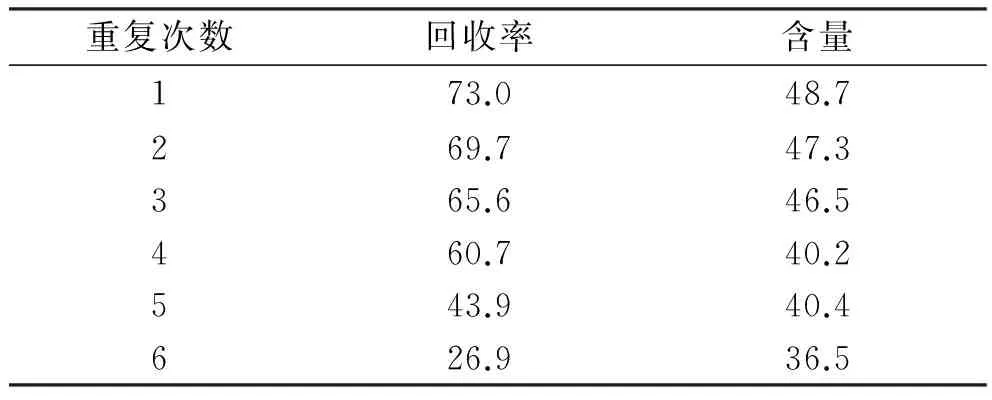
Tab.5 Test of resin reuse %
本实验选用HP-20大孔吸附树脂分离裸花紫珠总黄酮,纯化裸花紫珠的工艺为pH为3.0的4.46 mg·mL-1裸花紫珠提取液720 mL,以3 BV·h-1流速上样,以3 BV·h-1水洗,用浓度为75%乙醇溶液,以2 BV·h-1流速进行洗脱,洗脱率可达94%,总黄酮含量平均提高3.1倍,达到47.4%。
3 讨论
本实验方法分离裸花紫珠总黄酮的含量离《药品注册管理办法》附件规定的“有效部位含量应占提取物的50%以上”尚有一定的差距。从本实验的预实验来看,若想提高含量可提高水洗量,或用低浓度乙醇洗脱,然而这样会导致总黄酮损失过多,回收率降低,因此要想进一步提高裸花紫珠总黄酮含量需要进一步筛选对黄酮具有更好特异性的树脂,或者将总黄酮粗品用溶剂萃取(如石油醚脱脂)后再上柱分离[6]。
[1] 中国医学科学院药用植物资源开发研究所,中国医学科学院药物研究所,北京医科大学药学院,等.中药志[M].第5 册.北京:人民卫生出版社,1994:147.
[2] 高飞鹏,汪豪,叶文才,等.裸花紫珠叶的化学成分[J].中国药科大学学报,2010,41(2):120-122.
[3] 蔡金平,董琳,关薇薇.裸花紫珠的研究进展[J].现代药物与临床,2012,27(1):60-61.
[4] 谌乐刚,宋永强.分光光度法测定裸花紫珠药材水提物中总黄酮的含量[J].华西药学杂志,2005,20(5):449-450.
[5] 朱浩,毛声俊.大孔树脂吸附纯化不同中药有效部位特性研究[J].中国中药杂志,1998,2(10) :607-609.
[6] 桑林,王晓林,钟方丽.大孔吸附树脂纯化独活总黄酮的工艺优选[J].中国实验方剂学杂志,2013,19(6):57-60.
DOI 10.3870/yydb.2015.05.020
Optimization of Purification Technology for Total Flavonoids fromCallicarpanudifloraHook.et Arn.by Macroporous Adsorption Resin
LIU Yong1, ZHANG Pengwei2, SU Wenqin2, LIU Xiao3, GONG Keming4, XIANG Ni2
(1.DepartmentofPharmacy,theSecondHospitalAffiliatedtoWenzhouMedicalUniversity,Wenzhou325027,China;2.SchoolofPharmacy,HainanMedicalUniversity,Haikou571199,China; 3.WenzhouHospitalofTraditionalChineseMedicine,Wenzhou325000,China; 4.YanchengInstituteofHealthSciences,Yancheng224005,China)
Objective To optimize purification technology for total flavonoids inCallicarpanudifloraHook.et Arm.by macroporous adsorption resin. Methods Macroporous resin models including AB-8, D-101, HP-20, HP2MG, were optimized by static adsorption and desorption experiments regarding to adsorption rate and desorption rate of total flavonoids.Purification technology parameters of total flavonoids were optimized by single factor test. Results HP-20 macroporous resin presented the best purification efficiency,the optimum purification conditions were that taking 4.46 mg·mL-1of total flavonoidsat pH 3.0,loading at 3 BV·h-1, washed with 3BV of water at 3 BV·h-1,then eluted with 4 BV 75% ethanol at 2 BV·h-1, finally obtaining the total flavonoids from the dry extract ofCallicarpanudifloraHook.et Arn.with the purity of 47.4%. Conclusion HP-20 macroporous resin is suitable for preliminary purification of total flavonoids inCallicarpanudifloraHook.et Arn.
CallicarpanudifloraHook.et Arn.; Total flavonoids; Macroporous Adsorption Resin
2014-01-06
2014-03-24
*海南省重点科技计划项目(ZDXM20120095);浙江省公益技术研究社会发展项目(2012C23082);海南医学院科研培育基金(HY2010-011)
刘勇(1974-),男,浙江温州人,药师,硕士,主要从事中药制剂开发。电话:0577-88002568,E-mail:153334048@qq.com。
张鹏威(1975-),男,湖北罗田人,副教授,博士,主要从事药物制剂开发和药物质量标准研究。电话:0898-66894429,E-mail:zpw0803@163.com。
R282.71;TQ460.6
B
1004-0781(2015)05-0640-04
