叶片山海绵共附生细菌的防污活性研究
2015-06-23陈志颖冯丹青柯才焕
陈志颖,王 祥,苏 培,冯丹青,柯才焕
(厦门大学海洋与地球学院,福建厦门361102)
叶片山海绵共附生细菌的防污活性研究
陈志颖,王 祥,苏 培,冯丹青*,柯才焕
(厦门大学海洋与地球学院,福建厦门361102)
从叶片山海绵(Mycale phyllophila)中分离纯化得到7株共附生细菌,经16S r DNA序列比对,分别归属于芽抱杆菌属(Bacillus,5株)、假弧菌属(Pseudovibrio,1株)和短杆菌属(Brevibacterium,1株).菌株经发酵培养后对发酵液进行提取,以翡翠贻贝(Perna viridis)足丝分泌抑制实验检测提取物的防污活性.检测结果表明,菌株NAP1和NAP7的提取物显著抑制翡翠贻贝足丝分泌,其半抑制浓度(EC50)分别为55.26和14.85μg/m L,其余5株菌株的提取物均无防污活性.结合形态观察、生理生化特征和16S r DNA序列比对,将菌株NAP7初步鉴定为脱氮假弧菌(Pseudovibrio denitrificans).另外,进一步对菌株NAP7提取物进行活性部位追踪,以不同极性的溶剂进行萃取,依次获得石油醚相、二氯甲烷相、乙酸乙醋相、正丁醇相和水相部分,进行防污活性检测,发现除水相部分无防污活性外,其余4个部分均显著抑制翡翠贻贝足丝分泌,其中正丁醇相不仅防污活性高(EC50=4.06μg/m L),对翡翠贻贝的毒性也低(半致死浓度(LC50)=158.11μg/m L),表明其中含有高效低毒的活性成分.研究结果为从海洋微生物中筛选获得新型环保海洋防污剂奠定重要基础.
海绵共附生细菌;防污活性;海洋防污剂;叶片山海绵
在海洋环境中,船舶、海水养殖网具及其他人工设施的表面易被海洋生物大量附着,造成生物污损问题,会导致船舶航行速度下降、油耗增加、堵塞网具网孔、加速金属表面腐蚀等,对海洋运输、海洋工程、海水养殖及海军装备都具严重危害[1].有机锡曾被作为海洋防污剂广泛应用,但因其具剧毒而被禁用.目前主要使用氧化亚铜及异噻唑啉酮、三嗪类等防污剂,但研究表明,这些防污剂对非靶标的海洋生物具显著的毒性作用,污染海洋环境,破坏生态平衡[2].因此,环境友好型海洋防污剂成为研发热点.
海绵等海洋底栖生物的体表与海中非生物体的表面同样面临被生物污损的威胁.海洋底栖生物的体表若被污损,会妨碍其气体和营养交换、阻碍生长、增加质量、竞争食物、造成组织破损、甚至会致死[3].因此,许多海洋底栖生物在长期进化过程中形成防污机制.其中,海洋底栖生物产生防污活性物质被认为是一种重要的防污机制[4],是发现环境友好型海洋防污剂先导化合物的潜在来源,但天然防污产物在生物体中的含量通常很低.有研究发现,一些海洋底栖生物的共附生微生物也具防污活性,其作用可能是协助宿主保持体表洁净[5-6].微生物可通过大量培养发酵生产天然产物,有助于解决天然产物防污剂在产量上受到限制的难题,因此其研究受到学者重视.
翡翠贻贝(Perna viridis)是一种重要的海洋污损动物,它通过分泌足丝附着在海中人工设施的表面,造成生物污损.据报道[7],翡翠贻贝在海水养殖网箱上的密度可高达5.2 kg/m2,其在养殖网箱上生长不但增加网箱负荷,影响网箱的使用寿命,还会堵塞网眼,影响水流通畅,造成其他养殖种的产量和品质下降.
本文对采自广东南澳的叶片山海绵(Mycale phyllophila)中的共附生细菌进行分离纯化,以翡翠贻贝足丝产生抑制实验,检测共附生细菌发酵液提取物的防污活性,并进一步对所筛选出的高防污活性的发酵液提取物进行萃取分离,追踪其活性部位,为研发新型环保海洋防污剂提供基础资料.

1 材料与方法
1.1 菌株的分离纯化
海绵样品于2013年8月采自广东南澳,由厦门大学海洋与地球学院王德祥副教授鉴定为叶片山海绵.海绵采集后冷藏并迅速运回实验室进行菌株分离工作.在超净台中用无菌手术刀和镊子将样品切割成1 cm3大小组织块,用无菌海水冲洗3次,以除去表面杂质和黏附的环境微生物.然后将组织块在无菌研钵中充分研磨至匀浆状,转移至50 m L离心管,加入10 m L无菌海水,涡旋震荡混匀后,在4℃、2 500 r/min条件下离心1 min,取1 m L上清液加入含9 m L无菌海水的离心管中,进行梯度稀释,稀释梯度为10¯1、10¯2和10¯3.吸取上述包括原液的所有梯度稀释液100μL涂布于2216E培养基,置于28℃培养箱中培养2~3 d.挑取不同形态特征的单菌落,在平板上反复划线分离纯化,获得纯培养物.将各菌株以20%(体积分数)甘油为保护剂,于¯80℃下保种.
1.2 菌株16S r DNA PCR扩增和序列分析
采用菌落PCR手段,以通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGYTACCTTGTTACGACT-3′)[8]对所获得细菌的16S rDNA序列进行PCR扩增,PCR产物经0.8%(质量分数)琼脂糖凝胶电泳检测后,送至上海英俊生物技术有限公司进行测序.所测序列上传至NCBI进行BLAST同源性比对分析,初步鉴定海洋微生物的归属.
1.3 菌株的接种发酵
将菌株接种到2216E固体培养基,28℃下培养1 d.在超净台中挑取单克隆菌落,接种于500 m L的2216E液体培养基中,于28℃、180 r/min条件下过夜培养.所得发酵液于4℃以9 000 r/min离心20 min,获得上清发酵液.
1.4 发酵产物的提取
将收集到的上清发酵液用等体积的乙酸乙醋萃取3次,旋转蒸发至干,获得发酵液提取物.所有提取物4℃下保存于安培瓶中.
1.5 防污活性检测
以翡翠贻贝足丝分泌抑制实验检测菌株发酵产物提取物的防污活性.翡翠贻贝(壳长15~20 mm)采自漳州漳浦沿岸.采集后将翡翠贻贝在实验室内暂养1~2 d,使其适应实验室环境.实验前,轻柔剪去翡翠贻贝的足丝,备用.实验时,以24孔板为实验容器,将各提取物先分别溶于二甲亚矾(DMSO)中配置成0.1,1,10 mg/m L,然后取20μL各溶液加至含1.98 m L膜滤海水的各孔中,每孔中另加入1只翡翠贻贝.以含20μL DMSO的膜滤海水(1.98 m L)为对照组, (预实验结果表明仅含纯海水的空庄组与添加DMSO的对照组间,翡翠贻贝分泌的足丝数量没有显著差异,可见添加20μL DMSO对翡翠贻贝足丝分泌没有显著影响)各实验组均设10个平行组.24 h后观察翡翠贻贝足丝产生条数和存活情况.
1.6 防污活性菌株NAP7的形态观察和生理生化特征测定
活性检测实验表明在所检测的菌株中,以菌株NAP7提取物的防污活性最高,本文对此活性菌株进行进一步研究.将菌株NAP7接种于2216E固体培养基上,28℃培养3 d,观察菌落形态,并用扫描电镜LEO1530观察其菌体形态特征,同时参考《常见细菌系统鉴定手册》[9]中的有关方法对其进行生理生化特征检测.
1.7 防污活性组分的追踪
活性检测实验表明菌株NAP7发酵产物的提取物对翡翠贻贝的防污活性高,且无毒性作用,本文通过萃取分离对此提取物进行防污活性部位的追踪.将该菌株发酵产物的乙酸乙醋提取物以90%(体积分数,下同)甲醇溶解,用等体积的石油醚进行萃取,石油醚萃取液旋转蒸发得到石油醚相部分;余下的90%甲醇部分经旋转蒸发后,用10%甲醇再次溶解,先后用等体积的二氯甲烷、乙酸乙醋和正丁醇萃取,旋转蒸发后得到二氯甲烷相、乙酸乙醋相和正丁醇相部分.余下的10%甲醇部分旋转蒸发后得到水相部分.以上述翡翠贻贝足丝分泌抑制实验检测各部分的防污活性.
1.8 实验数据的处理
应用Origin Pro 9.0软件进行实验数据统计处理和作图,并采用SPSS 21.0统计软件中的单因素方差分析(one way ANOVA)比较实验数据的显著性差异.以史丕曼-卡伯法[10]计算所检测物质对翡翠贻贝足丝分泌的半抑制浓度(EC50)及半致死浓度(LC50).
2 结 果
2.1 菌株16S r DNA序列分析
从叶片山海绵中分离纯化获得7株共附生菌株,对这些菌株的16S r DNA序列进行PCR扩增和序列测定,并与NCBI的GenBank基因序列数据库进行BLAST同源性比对,结果如表1所示.这7株菌株的16S rDNA序列均与数据库中已知细菌的相关序列具有较高的相似性(≥99%),菌株分别属于3个不同的属,包括芽抱杆菌属(Bacillus,5株)、假弧菌属(Pseudovibrio,1株)、短杆菌属(Brevibacterium,1株).
2.2 发酵产物提取物的防污活性
菌株发酵产物提取物对翡翠贻贝的防污活性检测结果如图1和表2、3所示.在这7株菌株中,以菌株NAP7的提取物得率最高,为222.4 mg/L.其中,菌株NAP1和NAP7的提取物均显著抑制翡翠贻贝足丝分泌,其EC50分别为55.26和14.85μg/m L.所检测的其余5株菌株NAP2~NAP6的提取物在1~100 μg/m L的质量浓度范围内对翡翠贻贝足丝分泌均无显著的抑制活性.同时,本文还观察了在菌株发酵产物提取物作用下翡翠贻贝的死亡情况,检测这些提取物的毒性作用,其结果如表2所示.这7株菌株的提取物在1~100μg/m L的质量浓度范围内对翡翠贻贝均无强烈的致死活性,LC50均大于100μg/m L.其中,菌株NAP7的发酵产物提取物不仅得率高,防污活性高,且实验组中个体没有出现死亡,因此本文选取对此菌株的提取物进行进一步的防污活性部位追踪.
2.3 菌株NAP7的形态特征和生理生化特征
菌株NAP7在2216E固体培养基中培养3 d后,菌落呈乳庄色,边缘透明整齐,表面光滑.对菌株NAP7进行扫描电镜分析,如图2所示.该菌株呈杆状,长为1.2~2.0μm,宽为0.3~0.5μm.
菌株NAP7的生理生化特征检测结果如表4所示.参考《常见细菌系统鉴定手册》[9]和文献[11],结合该菌的形态特征、生理生化特征和16S r DNA序列同源性比对结果,初步鉴定该菌为脱氮假弧菌(Pseudovibrio denitrificans).
2.4 菌株NAP7发酵产物提取物防污活性组分的追踪
用不同极性的溶剂对菌株NAP7发酵产物提取物进行萃取,依次获得石油醚相、二氯甲烷相、乙酸乙醋相、正丁醇相和水相部分,各部分得率及防污活性和毒性检测结果如图3和表5、6所示.其中,水相部分对翡翠贻贝足丝分泌无显著的抑制作用,其余4个部分均显著抑制翡翠贻贝足丝分泌,具防污活性.相较而言,石油醚相部分的防污活性较低,其EC50为234.02μg/m L,而二氯甲烷相、乙酸乙醋相和正丁醇相部分均显示出较高的防污活性,EC50值均在5μg/ m L以下,小于原提取物的EC50值(14.85μg/m L),表明菌株NAP7发酵产物中的防污活性物质集中在这3个部分.此外,从表5和6可见,二氯甲烷相和乙酸乙醋相部分对翡翠贻贝具较高的毒性作用,其LC50值均小于5μg/m L;而正丁醇相部分对翡翠贻贝的毒性低,LC50高达158.11μg/m L.
3 讨 论
海绵是天然活性物质的丰富来源,近年研究表明,许多从海绵中分离获得的活性化合物其真正生产者不是海绵,而是海绵的共附生微生物[12].目前,从海绵的共附生微生物中发现生物活性物质是一个研究热点.另一方面,海绵具固着滤食的生活习性,其体表须保持洁净,一些共附生微生物所产生的活性物质可能会为海绵起到防御体表污损的生态作用.Dash等[13-14]检测了7株海绵共附生菌株的防污活性,发现有4株菌株的发酵产物提取物具较好的防污活性,并进一步对其中一株活性高的菌株Winogradskyellaporiferorum的提取物进行分离纯化,获得了聚醚类天然防污产物.总体上,当前对海绵共附生微生物防污活性的研究报道还不多,但对包括海绵在内的海洋底栖生物的共附生微生物防污活性研究已引起了相关学者的重视,近年来陆续有文献报道[5].本文以一种重要的海洋污损动物翡翠贻贝的足丝分泌实验为检测模型,对叶片山海绵共附生细菌的防污活性进行了研究,筛选出2株菌株NAP1和NAP7的发酵产物提取物具显著的防污活性,表明这2株菌株有可能为叶片山海绵起到防污作用,另外也是发现环保型海洋防污剂先导化合物的潜在来源.

表1 分离菌株16S r DNA序列同源性比对结果Tab.1 Homology comparison of 16S r DNA sequences of the isolated strains

图1 分离菌株发酵液提取物对翡翠贻贝足丝分泌的影响Fig.1 Effects of extracts from fermentation broth of the isolated bacteria on byssus thread production of P.viridis
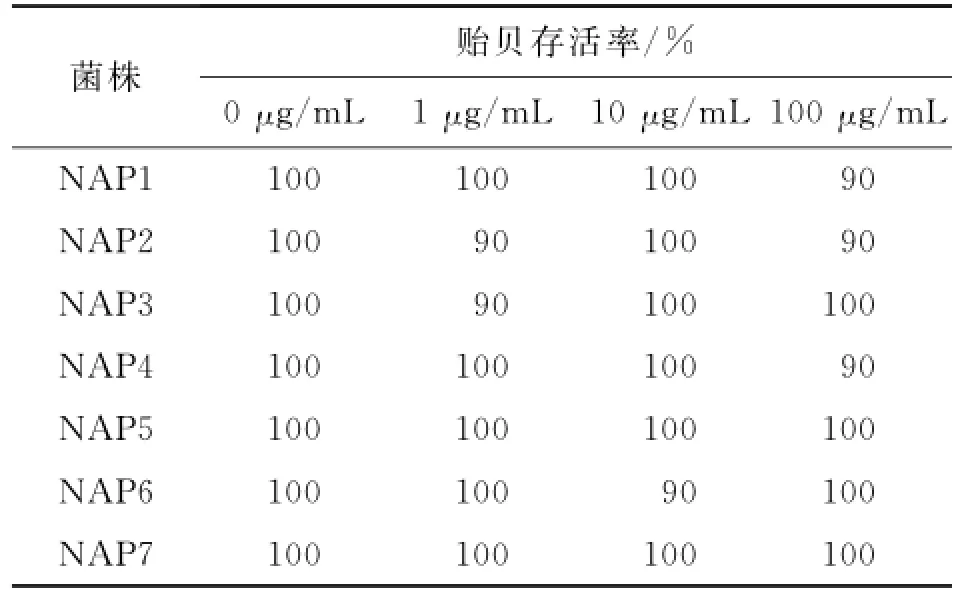
表2 分离菌株发酵液提取物对翡翠贻贝存活的影响Tab.2 Effects of extracts from fermentation broth of the isolated bacteria on survival of P.viridis
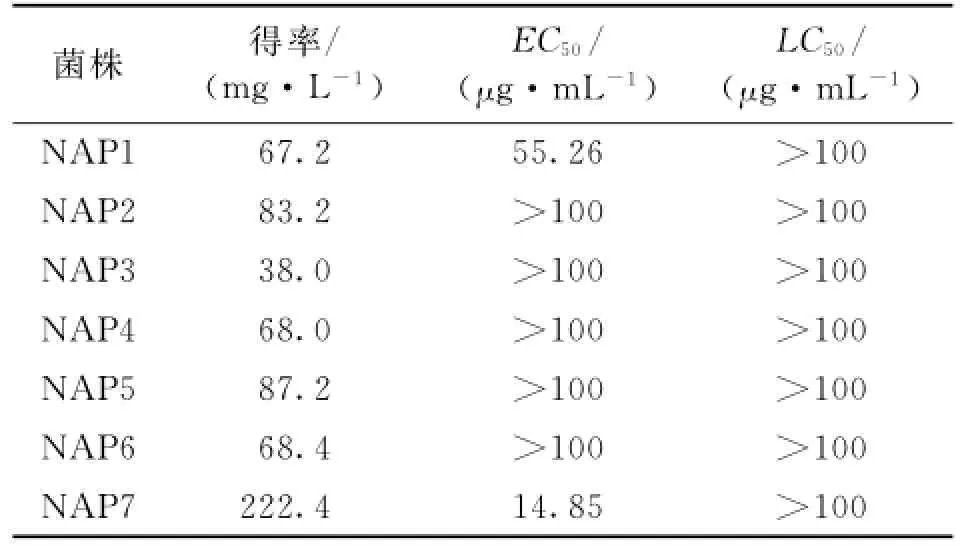
表3 分离菌株发酵液提取物的得率及其对翡翠贻贝的防污活性和毒性Tab.3 Yield,antifouling activity and toxicity of extracts from fermentation broth of the isolated bacteria against P.viridis

图2 菌株NAP7扫描电镜图Fig.2 The SEM picture of the strain NAP7
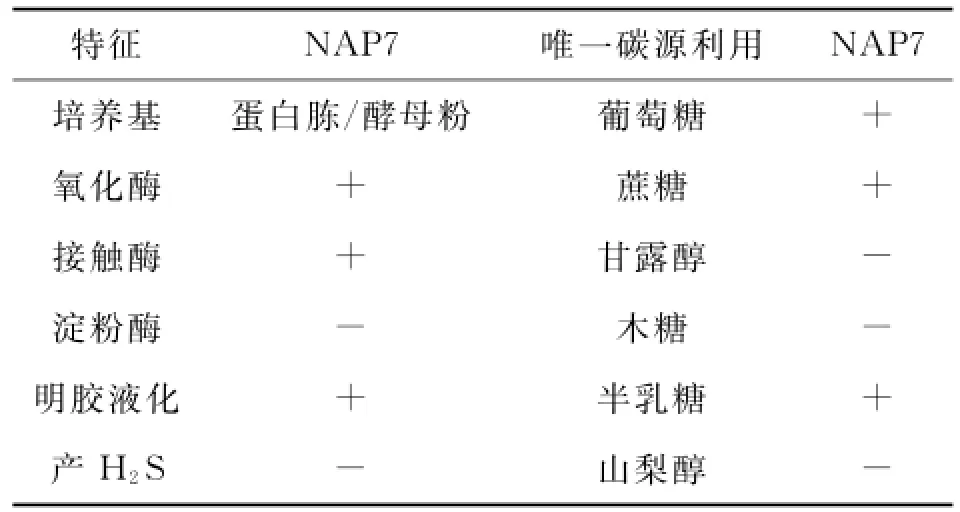
表4 菌株NAP7的生理生化特征Tab.4 Physiological and biochemical characteristics of the strain NAP7
本文还对防污活性较高的菌株NAP7的提取物进行了活性部位追踪,发现除了水相无防污效果外,石油醚相、二氯甲烷相、乙酸乙醋相和正丁醇相均具防污活性,表明菌株NAP7中可能含有不止一种天然防污活性物质,且活性物质为中低极性物质.此外,本文还发现该菌株提取物的二氯甲烷相、乙酸乙醋相和正丁醇相具高防污活性,EC50值小于5μg/m L,有进一步开发应用潜力.尤其是正丁醇相不仅防污活性高,毒性也低,表明其中含有高效低毒的活性成分.作者尝试以GC-MS方法对菌株NAP7的提取物进行初步分析,发现可能含有硅氧烷类、呋喃醇、生物碱类和甾醇类化合物.下一步将应用色谱分离纯化方法从菌株NAP7中筛选防污活性化合物.
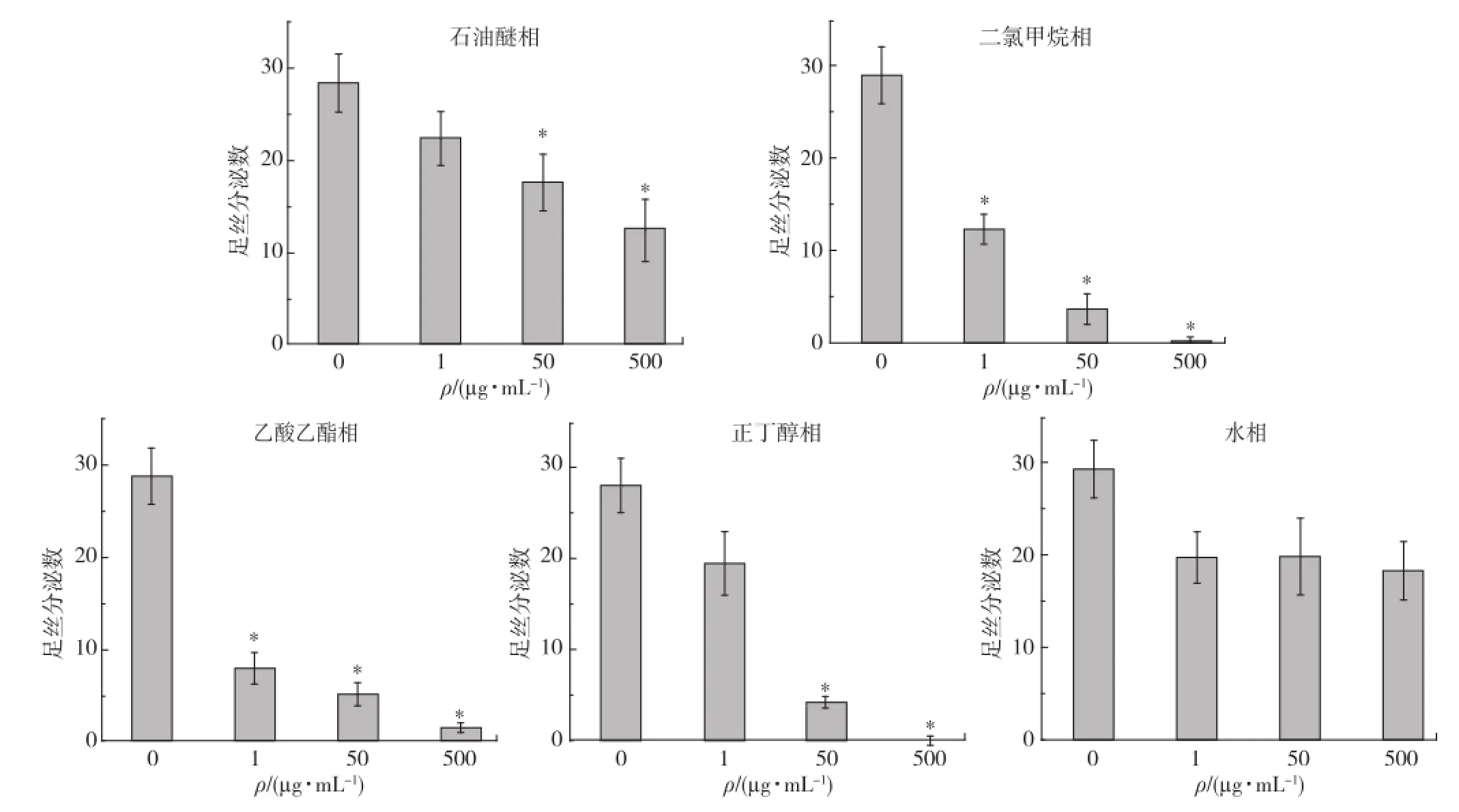
图3 菌株NAP7提取物不同极性部分对翡翠贻贝足丝分泌的影响Fig.3 Effects of fractions with different polarity from the extract of the strain NAP7 on byssus thread production of P.viridis
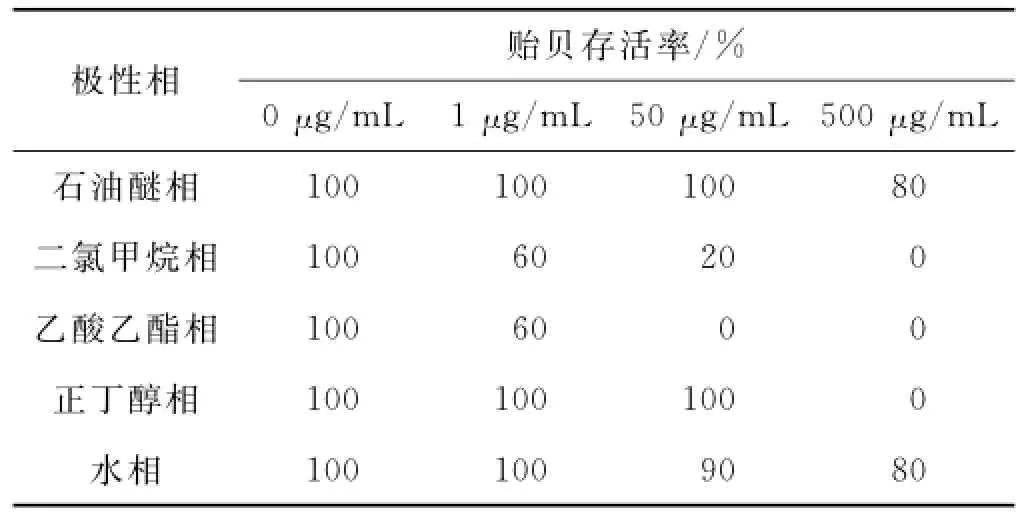
表5 菌株NAP7提取物不同极性部分对翡翠贻贝存活的影响Tab.5 Effects of fractions with different polarity from the extract of the strain NAP7 on survival of P.viridis
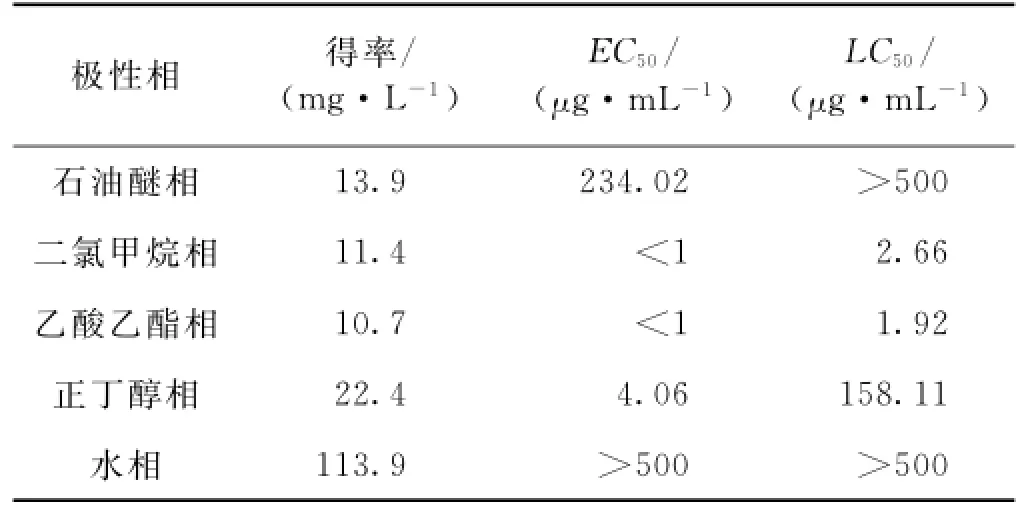
表6 菌株NAP7提取物不同极性部分的得率及其对翡翠贻贝的防污活性和毒性Tab.6 Yield,antifouling activity and toxicity of fractions with different polarity from the extract ofthe strain NAP7 against P.viridis
结合形态观察、生理生化特征和16S r DNA序列比对,将菌株NAP7初步鉴定为脱氮假弧菌.有学者在其他海绵种类中也曾分离出与脱氮假弧菌有较高同源性的菌株,且发现其具抗菌活性[15-16].另外,在软珊瑚Sarcophyton sp.共附生微生物中也发现了与脱氮假弧菌有较高同源性的菌株,具抑制海洋污损细菌生长的活性[17].本文则检测出菌株NAP7对翡翠贻贝足丝分泌具显著的抑制活性.在接下来的工作中可检测该菌株对其他污损生物的附着是否也具抑制作用,观察其是否具广谱防污活性.
传统的有机锡和氧化亚铜等重金属防污剂不仅对生物有毒性作用,且在环境中难降解,而天然防污活性物质具生物可降解性,有利于保持生态平衡,可望替代对环境有害的防污剂,是获得新型环保防污剂的重要来源.目前,天然防污活性物质的主要筛选生物源包括海洋底栖无脊椎动物[18-19]、海洋藻类[20]和海洋微生物[21].与前两者相比,微生物可通过发酵工程技术规模化生产活性物质,因此防污活性功能菌株在海洋环保防污技术领域具较大的开发利用潜力,值得深入研究.
[1] Yebra D M,Kill S,Dam-Johansen K.Antifouling technology-past,present and future steps towards efficient and environmentally friendly antifouling coatings[J].Progress in Organic Coatings,2004,50:75-104.
[2] Dafforn K A,Lewis J A,Johnston E L.Antifouling strategies:history and regulation,ecological impacts and mitigation[J].Marine Pollution Bulletin,2011,62:453-465.
[3] Krug P J.Defense of benthic invertebrates against surface colonization by larvae:a chemical arms race[M]∥Fusetani N,Clare A S.Antifouling compounds.Berlin:Springer,2006:1-53.
[4] Harder T.Marine epibiosis:concepts,ecological consequences and host defence[M]∥Flemming H C,Sriyutha Murthy P,Venkatesan R,et al.Marine and industrial biofouling.Berlin:Springer,2009:219-232.
[5] Dobretsov S,Abed R M M,Teplitski M.Inhibition of biofouling by marine microorganisms[J].Biofouling,2013, 29(4):423-441.
[6] Nasrolahi A,Stratil S B,Jacob K J,et al.Protective coat of microorganisms on macroalgae:inhibitory effects of bacterial biofilms and epibiotic microbial assemblages on barnacle attachment[J].FEMS Microbiology Ecology, 2012,81:583-595.
[7] 王建军,黄宗国.厦门港网箱养殖场污损生物的研究[J].海洋学报,1996,18(5):93-102.
[8] Lane D J.16S/23S r RNA sequencing[M]∥Stackebrandt E,Goodfellow M.Nucleic acid techniques in bacterial systematics.New York:John Wiley and Sons,1991:115-175.
[9] 东秀株,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10] Hamilton M A,Russo R C,Thurston R V.Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays[J].Environmental Science&Technology,1977,11:714-719.
[11] Shieh W Y,Lin Y T,Jean W D.Pseudovibrio denitrificans gen.nov.,sp.nov.,a marine,facultatively anaerobic,fermentative bacterium capable of denitrification[J]. International Journal of Systematic and Evolutionary Microbiology,2004,54(6):2307-2312.
[12] Faulkner D J.Marine natural products[J].Natural Product Reports,2002,19:1-48.
[13] Dash S,Jin C,Lee O O,et al.Antibacterial and antilarval-settlement potential and metabolite profiles of novel sponge-associated marine bacteria[J].Journal of Industrial Microbiology&Biotechnology,2009,36: 1047-1056.
[14] Dash S,Nogata Y,Zhou X J,et al.Poly-ethers from Winogradskyella poriferorum:antifouling potential, time-course study of production and natural abundance [J].Bioresource Technology,2011,102:7532-7537.
[15] Muscholl-Silberhorn A,Thiel V,Imhoff J F.Abundance and bioactivity of cultured sponge-associated bacteria from the Mediterranean sea[J].Microbial Ecology, 2008,55:94-106.
[16] Santos O C S,Pontes P V M L,Santos J F M,et al.Isolation,characterization and phylogeny of sponge-associated bacteria with antimicrobial activities from Brazil [J].Research in Microbiology,2010,161:604-612.
[17] Sabdono A,Radjasa O K.Antifouling activity of bacteria associated with soft coral Sarcophyton sp.against marine biofilm-forming bacteria[J].Journal of Coastal Development,2006,10:55-62.
[18] Okino T,Yoshimura E,Hirota H,et al.Antifouling kalihinenes from the marine sponge Acanthella cavernosa [J].Tetrahedron Letters,1995,36(47):8637-8640.
[19] Qi S H,Zhang S,Qian P Y,et al.Ten new antifouling briarane diterpenoids from the South China Sea gorgonian Junceella juncea[J].Tetrahedron,2006,62(39): 9123-9130.
[20] Pénez N,Culioli G,Pérez T,et al.Antifouling properties of simple indole and purine alkaloids from the Mediterranean gorgonian Paramuricea clavata[J].Journal of Natural Products,2011,74(10):2304-2308.
[21] de Nys R,Steinberg P D,Willemsen P,et al.Broad spectrum effects of secondary metabolites from the red alga Delisea pulchra in antifouling assays[J].Biofouling, 1995,8(4):259-271.
Study on Antifouling Activity of Bacteria Associated with Marine Sponge Mycale phyllophila
CHEN Zhi-ying,WANG Xiang,SU Pei,FENG Dan-qing*,KE Cai-huan
(College of Ocean&Earth Sciences,Xiamen University,Xiamen 361102,China)
:Seven bacterial strains were isolated from marine sponge Mycale phyllophila.Based on comparative analysis of their 16S r DNA sequences,five strains were affiliated to the genus Bacillus,one to the genus Pseudovibrio,and one to the genus Brevibacterium.And then,they were subjected to fermentation and the extracts of culture broth were tested for antifouling activity using the bioassay of byssus thread production with the green mussel Perna viridis.The results showed that the extracts of the bacterial strains NAP1 and NAP7 significantly inhibited byssus thread production of P.viridis,with EC50of 55.26 and 14.85μg/m L,respectively. The extracts of the other five strains had no antifouling activity.Additionally,the extract of the strain NAP7 were further investigated for its active fraction.It was separated with solvents of different polarities.Petroleum ether fraction,methylene dichloride fraction,ethyl acetate fraction,n-butanol fraction and water fraction were obtained successively and then tested for antifouling activity. Although there was no antifouling activity in the water extract,the other four fractions significantly inhibited byssus thread production of P.viridis.Especially,the n-butanol fraction was highly antifouling active(EC50=4.06μg/m L)and not very toxic(LC50= 158.11μg/m L),indicating that this fraction contained substance(s)with high antifouling activity and low toxicity.The findings of this study are important for screening environmentally friendly marine antifoulants from marine microorganisms.
sponge-associated bacteria;antifouling activity;marine antifoulants;Mycale phyllophila
P 745
A
0438-0479(2015)03-0340-07
10.6043/j.issn.0438-0479.2015.03.008
2014-10-22 录用日期:2015-01-20
国家自然科学基金(41106121);海洋公益性行业科研专项(201305016);厦门市海洋经济创新发展区域示范重点项目(12PZB001SF09);厦门大学海洋科学基地科研训练及科研能力提高项目(J1210050)
*通信作者:dqfeng@xmu.edu.cn
陈志颖,王祥,苏培,等.叶片山海绵共附生细菌的防污活性研究[J].厦门大学学报:自然科学版,2015,54(3): 340-346.
:Chen Zhiying,Wang Xiang,Su Pei,et al.Study on antifouling activity of bacteria associated with marine sponge Mycale phyllophila[J].Journal of Xiamen University:Natural Science,2015,54(3):340-346.(in Chinese)
