葡萄糖转运蛋白9及其编码基因在痛风发病中的作用研究进展
2015-06-21青玉凤周京国
刘 璐,青玉凤,周京国
(川北医学院附属医院风湿科,四川 南充 637000)
葡萄糖转运蛋白9及其编码基因在痛风发病中的作用研究进展
刘 璐,青玉凤,周京国
(川北医学院附属医院风湿科,四川 南充 637000)
痛风的发病率和患病率在世界范围内呈逐年上升趋势,严重威胁人民健康,给社会带来巨大经济负担。在健康人体内血尿酸处于动态平衡,该平衡打破所致的高尿酸血症,是痛风发生的生化基础;而葡萄糖转运蛋白9(glucose transporter 9,GLUT9)作为一种尿酸盐转运体,对体内尿酸盐稳态的维持有着重要作用。本文就GLUT9的结构、组织分布、生理功能及其编码基因单核苷酸多态性与血尿酸水平及痛风发病的相关性作一综述。
痛风;葡萄糖转运蛋白9
痛风是由于嘌呤代谢紊乱,尿酸盐生成增多和(或)排泄减少导致高尿酸血症,尿酸盐晶体析出并沉积于组织,从而致组织损伤的一组临床症候群。血尿酸由嘌呤核苷酸代谢而来,并主要通过肾脏排泄以维持动态平衡(图1),尿酸生成增多或/和尿酸排泄障碍均可能导致高尿酸血症,后者是痛风发生的生化基础。高尿酸血症中不足10%为尿酸生成增多所致,原因多为黄嘌呤氧化酶(XOD)缺陷;90%以上为尿酸排泄减少所致。而尿酸的排泄有30%通过消化道、皮肤及呼吸道等肾外途径,70%通过肾脏途径,其中肾脏尿酸排泄障碍是原发性高尿酸血症的主要原因。
肾脏对尿酸的排泄经过了肾小球的滤过、分泌前的重吸收、肾小管的主动分泌、分泌后重吸收四个过程[1],其中任何一个环节出现问题均可能影响尿酸的排泄。而尿酸盐转运蛋白在肾脏对尿酸的重吸收、分泌过程中发挥重要作用。以往大多数学者认为尿酸盐转运蛋白1(URATl)在尿酸盐的重吸收中起重要作用,而Dinour等在爪蟾卵母细胞实验中发现葡萄糖转运体9(glucose transporter 9,GLUT9)在尿酸重吸收上发挥着比URATl更为重要的作用[2]。本文就GLUT9在痛风发病中作用的研究进展作一综述。
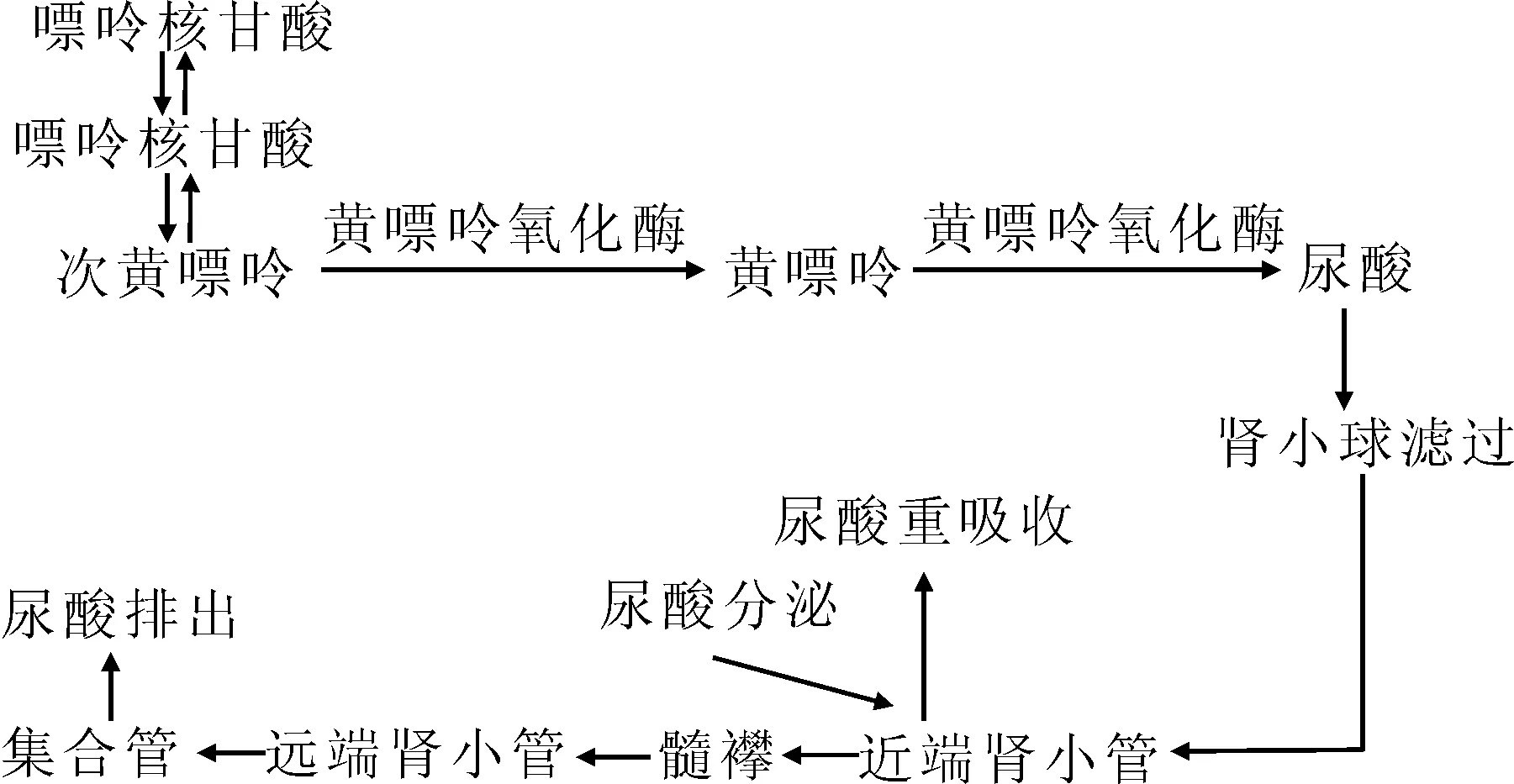
图1 人体血尿酸的代谢示意图
1 GLUT9的结构及组织分布
GLUT9由定位于人类染色体4p15.3~16的SLC2A9基因编码,受电压驱动,故又名电势驱动尿酸转运蛋白1(tagedriven urate transporterl,URATv1)[3]。GLUT9为葡萄糖转运家族(GLUT家族)的一员,与该家族其他转运体具有高度同源性(尤其是GLUT1~4),该家族所有成员共享一个相同的结构特征:都有12个跨膜螺旋结构,且该结构都存在一个N-连接糖基化位点和位于胞浆内的碳端及氮端[4]。GLUT9由GLUT9-L(含540个氨基酸)及GLUT9-S(含512个氨基酸)2种异构体组成,2种异构体仅仅是在N端第29个残基存在差异,这种差异不影响功能,仅与其在组织中的锚定位点相关。每种异构体的独特N端氨基酸对该蛋白的稳定性及转运功能起着重要作用[4,5]。
GLUT9的2种异构体的组织分布不同,在人体组织中,GLUT9-S仅仅在肾脏和胎盘[4]上表达,而GLUT9-L则在更多的组织上表达,如:肝脏[6]、肾脏、胎盘[7]、肠道、白细胞[7]、软骨细胞[8]、胰腺、肺及脑组织;GLUT9的2种异构体在肾脏上的分布不同,GLUT9-L主要位于近端肾小管基侧膜,GLUT9-S则位于集合管的管腔膜[4]。综上,可推测在不同的组织器官或在肾脏不同部位,GLUT9对尿酸转运的调控具有差异。
2 GLUT9的生理学功能
GLUT9具有7个糖转运信号通路,主要与糖代谢有关,同时转运葡萄糖和果糖,但对果糖的亲和力是对葡萄糖的3倍[9]。有研究发现:肝细胞葡萄糖和果糖转运体(GLUT2)失活时可完全阻碍细胞对葡萄糖的摄取,而此时GLUT9仍呈高表达,表明GLUT9转运葡萄糖和果糖的效率非常低,其主要作用并非是葡萄糖及果糖的转运[8],该转运蛋白与尿酸代谢也密切相关[2,10],是一种高容量/高亲和力的尿酸转运蛋白,同时也是GLUT家族中唯一转运尿酸的成员[11,12],其对尿酸盐的转运速度比对葡萄糖/果糖快45~60倍[2]。GLUT家族的其他14个成员主要转运葡萄糖或其他单糖,而GLUT9则为葡萄糖及尿酸的共同转运体。
由于尿酸处理的种族特异性使选择动物模型来研究GLUT9的具体生理功能成为一种挑战,故目前大部分研究集中于GLUT9结构特点的研究。随着基因敲除技术的发展,Preitner F等人[6]通过基因敲除的方法,发现在全身性GLUT9基因敲除的小鼠模型中,尿酸盐排泄分数增高;而在全身性和肝脏特异性GLUT9基因同时敲除的小鼠模型中,则出现血尿酸、尿尿酸的同时升高(尿酸排泄分数增高20~30倍)。提示在肾脏缺乏GLUT9表达时,仅肾脏对尿酸盐的重吸收被阻断,随尿液排出的尿酸盐增多,其排泄分数增高;而在肝脏及肾脏同时缺乏GLUT9基因表达的情况下,肾脏对尿酸盐的重吸收被阻断的同时,位于肝细胞基底膜上的GLUT9也丧失对尿酸盐的重吸收功能,血浆中的尿酸盐不能进入肝细胞,不能被肝细胞内尿酸酶降解为尿素囊,从而导致血尿酸及尿尿酸同时升高。据此推测该转运体在肝脏和肾脏的尿酸盐跨膜转运中都起着重要作用,GLUT9除了通过肾脏途径重吸收尿酸盐,还可通过分布在肝细胞基底膜上的该转运蛋白,介导血液中的尿酸盐进入到肝细胞,然后由肝细胞内的尿酸酶将其降解为尿素囊,经肠腔随粪便排泄至体外。
3 SLC2A9基因多态性与血尿酸水平及痛风发病的相关性
Kolz等[13]对28141个欧洲人的全基因组关联研究进行荟萃分析发现:7个胞膜尿酸盐转运体(包括SLC17A1、 SLC17A3、SLC22A11、SLC22A12、 SLC16A9、ABCG2、SLC2A9)的基因变异体占了影响尿酸浓度变异因素的5%,而SLC2A9基因位点的变异在其中作用突出,占了几个尿酸盐转运体变异因素的2/3,起着决定性的影响。随着研究的深入,发现SLC2A9对男性血尿酸有1%~2%的变量贡献,而对女性则有5%~6%的变量贡献[14~16]该基因的次要等位基因rs734553对女性血尿酸水平的降低影响较男性更大。以上研究提示SLC2A9对血尿酸浓度的影响有重要意义,且该具有性别差异,对女性影响更大,推测雌激素在GLUT9对尿酸盐的转运中起刺激作用。
编码GLUT9的SLC2A9基因包含了13个外显子,近年来一系列研究报告显示SLC2A9为体外尿酸盐转运所需[2,17~19],自2013年以来,许多全基因组关联研究也表明:人类SLC2A9基因多态性对血尿酸水平有很大的影响[20~23]。在对高加索人的病例对照研究中发现SLC2A9的变异对高尿酸的危险相关系数(OR)为1.7~1.9,对痛风的OR为1.3~2.1[24];SLC2A9在新西兰毛利人和太平洋沿岸人的变异体对痛风的OR更高[25]。研究发现SLC2A9的两个位点单核苷酸多态性(rs13124007、rs6850166)与痛风易感性相关[26]:前者的C等位基因、后者的A等位基因是痛风易感性的危险因素,OR值分别为1.709 、1.645。我们课题组研究发现SLC2A9基因rs3733591单核苷酸多态性与我国汉族人群原发性痛风发病相关,等位基因C是发生痛风的风险因子,携带TC基因型的痛风患者外周血单个核细胞SLC2A9 mRNA显著高于TT基因型痛风患者[27]。以上研究提示SLC2A9的单核苷酸多态性与痛风易感性相关,且在不同种族人群中SLC2A9的SNP基因位点不尽不同,更多的新的SNP基因位点有待进一步探究。
SLC2A9的SNP不仅仅只跟痛风的发病相关,与糖负荷的增加后对血尿酸的影响、痛风石的形成、血甘油三酯、舒张压、收缩压、体重指数(BMI)都有相关性[26]。研究发现SLC2A9的rs11942223的单核苷酸多态性可影响高加索人群在糖负荷的增加、血尿酸及尿酸肾小球滤过率的变化[28]。一项在中国汉族痛风男性的研究,首次将痛风、多态性及单元型在启动子区域结合进行研究:发现位于SLC2A9的外显子1上游的 rs13124007、rs6850166的多态性与痛风易感性相关;其基因表型分析表明rs13124007的GG单体型是痛风的保护因素,而CA单体型则增加了痛风风险[26]。以上研究提示:SLC2A9的SNP不仅仅限于在外显子和内含子,在启动子的序列里也存在和血尿酸/痛风相关的SNP,需要在不同种族人群中进行研究,并联合功能试验加以验证。
4 小结
GLUT9在尿酸重吸收中发挥的重要作用逐渐被认识,其在痛风发病中作用的研究越来越受到关注,有关该转运体的研究正在展开。GWAS发现SLC2A9的单核苷酸多态性与痛风发病密切相关。功能实验表明GLUT9为高容量、高亲和性的尿酸盐转运体,在肾脏重吸收尿酸的过程中发挥重要的作用,并与其他尿酸盐转运体组成尿酸盐转运复合体共同维持血尿酸水平。加强GLUT9在痛风发病中的研究将有助于进一步阐明痛风的发病机制,并有助于为痛风的防治开辟新的方向。
[1] Rafey MA,Lipkowitz MS,Leal-Pinto E,et al.Uric acid transport.Current Opinion in Nephrology[J].Hypertension,2003, 12(5):511-516.
[2] Caulfield MJ,Munroe PB,O'Neill D,et al.SLC2A9 is a high-capacity urate transporter in humans[J].PLoS med,2008,5(10):e197.
[3] Nakanishi T,Ohya K,Shimada S,et al.Functional cooperation of URAT1(SLC22A12)and URAT1(SLC2A9)in renal reabsorption of urate[J].Nephrol Dial Transplant,2013,28(3):603-611.
[4] Augustin R,Carayannopoulos MO,Dowd LO,et al.Identification and characterization of human glucose transporter-like protein-9(GLUT9):alternative splicing alters trafficking [J].J Biol Chem,2004,279(16):16229-16236.
[5] Kimura T,Takahashi M,Yan K,et al.Expression of SLC2A9 Isoforms in the kidney and their localization in polarized epithelial cells[J].PloS one,2014,9(1):e84996.
[6] Preitner F,Laverriere-Loss A,Metref S,et al.Urate-induced acute renal failure and chronic inflammation in liver-specific Glut9 knockout mice[J].Am J Physiol Renal Physiol,2013,305(5):F786-F795.
[7] Doege H,Bocianski A,Joost H,et al.Activity and genomic organization of human glucose transporter 9(GLUT9),a novel member of the family of sugar-transport facilitators predominantly expressed in brain and leucocytes[J].Biochem J,2001,358:791-792.
[8] Mobasheri A1,Dobson H,Mason SL,et al.Expression of the GLUT1 and GLUT9 facilitative glucose transporters in embryonic chondroblasts and maturechondrocytes in ovine articular cartilage[J].Cell Biol Int,2005,29(4):249-260.
[9] Manolescu AR,Augustin R,Moley K,et al.A highly conserved hydrophobic motif in the exofacial vestibule of fructose transporting SLC2A proteins acts as a critical determinant of their substrate selectivity[J].Mol Membr Biol,2007,24(5-6):455-463.
[10]Kimura T,Amonpatumrat S,Tsukada A,et al.Increased expression of SLC2A9 decreases urate excretion from the kidney[J].Nucleosides Nucleotides Nucleic Acids,2011,30(12):1295-1301.
[11]Mueckler M,Thorens B.The SLC2(GLUT)family of membrane transporters[J].Mol Aspects Med,2013,34(2-3):121-138.
[12]Clémencon B,Lüscher,Fine M,et al.Expression,purification,and structural insights for the human uric acid transporter,GLUT9,Using the xenopus laevis oocytes system[J].PLoS One,2014,9(10):e108852.
[13]Kolz M,Johnson T,Sanna S,et al.Meta-analysis of 28,141 individuals identifies common variants within five new loci that influence uric acid concentrations[J].PLoS Genet,2009,5(6):e1000504.
[14]Wright AF,Rudan I,Hastie ND,et al.A ‘complexity’ of urate transporters[J].Kidney Int,2010,78(5):446-452.
[15]Doblado M,Moley KH.Facilitative glucose transporter 9,a unique hexose and urate transporter[J].Am J Physiol Endocrinol Metab,2009,297(4):E831-835.
[16]Stark K,Reinhard W,Neureuther K,et al.Association of common polymorphisms in GLUT9 gene with gout but not with coronary artery disease in a large case-control study[J].PLoS One,2008,3(4):e1948.
[17]Vitart V,Rudan I,Hayward C,et al.SLC2A9 is a newly identified urate transporter influencing serum urate concentration,urate excretion and gout[J].Nat genet,2008,40(4):437-442.
[18]Anzai N,Ichida K,Jutabha P,et al.Plasma urate level is directly regulated by a voltage-driven urate efflux transporter URATv1(SLC2A9)in humans[J].J Biol Chem,2008,283(40):26834-26838.
[19]Matsuo H,Chiba T,Nagamori S,et al.Mutations in glucose transporter 9 gene SLC2A9 cause renal hypouricemia[J].Am J Hum Genet,2008,83(6):744-751.
[20]Sun X,Jiang F,Zhang R,et al.Serum uric acid levels are associated with polymorphisms in the SLCA9,SF1,and GCKR genes in a Chinese population[J].Acta Pharmacol Sin,2014,35(11):1421-1427.
[21]Kottgen A,Albrecht E,Teumer A,et al.Genome-wide association analyses identify 18 new loci associated with serum urate concentrations[J].Nat Genet,2013,45(2):145-154.
[22]Voruganti VS,Franceschini N,Haack K,et al.Replication of the effect of SLC2A9 genetic variation on serum uric acid levels in American Indians[J].Eur J Hum Genet,2014,22(7):938-943.
[23]Voruganti VS,Kent JW Jr,Debnath S,et al.Genome-wide association analysis confirms and extends the association of SLC2A9 with serum uric acid levels to Mexican Americans[J].Front Genet,2013,4:279.
[24]Merriman TR,Dalbeth N.The genetic basis of hyperuricaemia and gout.Joint Bone Spine,2011,78:35-40.
[25]Hollis-Moffatt JE,Xu X,Dalbeth N,et al.Role of the urate transporter SLC2A9 gene in susceptibility to gout in New Zealand Maori,Pacific Island,and Caucasian case-control sample sets[J].Arthritis Rheum,2009,60:3485-3492.
[26]Li C,Chu N,Wang B,et al.Polymorphisms in the presumptive promoter region of the SLC2A9 gene are associated with gout in a Chinese male population[J].PloS one,2012,7(2):e24561.
[27]李敏,杨静,周京国,等.葡萄糖转运体9基因 rs3733591(C>T)的单核苷酸多态性与我国汉族人群原发性痛风发病的相关性研究[J].中华风湿病学杂志,2014,10:655-660.
[28]Dalbeth N,House M E,Gamble G D,et al.Population-specific influence of SLC2A9 genotype on the acute hyperuricaemic response to a fructose load[J].Annals of the rheumatic diseases,2013,72(11):1868-1873.
The role of glucose transporter 9 in the development of Gout
LIU Lu,QIN Yu-feng,ZHOU Jing-guo
(Departement of Rheumatology,the Affiliated Hospital of North Sichuan Medical College,Nanchong 637000,China)
ZHOUJing-guo
In the worldwide,the incidence and prevalence of gout have showed an increasing trend year by year,it threaten to people’s health seriously and has brought huge economic burden.In vivo of the healthy human,urate are in dynamic equilibrium,while the urate balance is broken,hyperuricemia is going to be formed and as the biochemical basis for the onset of gout.As a urate transporter,GLUT9 plays an important role in urate homeostasis in vivo.Here is to make a review on GLUT9’s structure,distribution,physiological function and the relevance between SNP of its coding gene and the incidence of gout or blood uric acid levels.
Gout; Glucose transporter 9
国家自然科学基金资助项目(编号:81272047),四川省教育厅科研基金资助项目(编号:12ZA046)
周京国,男,主任医师,教授,硕士及博士研究生导师。四川省医学会副会长,中华医学会风湿病分会委员,四川省医师协会风湿免疫科医师专科委员会副主任委员,四川省医学会风湿专委会副主任委员,海峡两岸医师交流协会风湿免疫学分会常委。主要研究方向:风湿免疫,痛风发病机制的研究。
R573
A
1672-6170(2015)05-0042-04
2015-03-29)
