miRNA在特发性炎性肌病中的作用
2015-06-21陈学斌王国春
陈学斌,王国春
(中日友好医院 a.医学工程处,b.风湿免疫科,北京 100029)
miRNA在特发性炎性肌病中的作用
陈学斌a,王国春b
(中日友好医院 a.医学工程处,b.风湿免疫科,北京 100029)
皮肌炎、多发性肌炎和散发型包涵体肌炎是临床较为常见的炎性肌病,其发病过程涉及不同的免疫过程。目前的研究认为皮肌炎的发病与补体介导的免疫过程相关,多发性肌炎和包涵体肌炎的是T细胞介导的细胞毒免疫过程,除此之外由于MHCI高表达所造成的内质网应激也与多发性肌炎和包涵体肌炎的发病密切相关。miRNA是在基因转录后水平起调控作用的长度约为21~25 nt的非编码小RNA,miRNA能够调节机体的多种生理过程,其与疾病发生过程有密切相关。本文总结了皮肌炎、多发性肌炎和散发型包涵体肌炎中miRNA的特异性表达情况,并分析了不同miRNA对三种特发性炎性肌病发病过程中重要蛋白的调控作用,为临床进一步探讨miRNA在炎性肌病中的诊断和治疗提供帮助。
特发性炎性肌病; miRNA;发病机制
1 前言
特发性炎性肌病(idiopathic inflamamatory myopathies,IIMs)临床上主要包括皮肌炎(dermatomyositis,DM)、多发性肌炎(polymyositis,PM)和散发型包涵体肌炎(sporadic inclusion body myositis,sIBM)等亚型。DM是一类亚急性发作的IIMs,其临床表现为近端肌无力且常常伴有皮肤的病理性改变,该疾病的发病人群包括成人和儿童。目前认为DM是一种补体系统调控的微血管疾病,患者的肌肉组织的毛细血管表现为内皮性增生,毛细血管形成网状结构,空泡化并发生坏死,导致肌肉局部缺血和肌纤维的损伤。参与DM炎症反应的细胞主要位于肌纤维血管周围的区域,或者位于丛生隔膜的束间区域,而不是位于肌纤维束当中。PM也是一种亚急性发作为主的疾病,主要在成人中发病,在儿童中鲜有发病,表现为近端肌肉无力。sIBM发病缓慢,是年龄超过50岁的患者中最常出现的一类肌炎,sIBM能影响患者近端和远端的肌肉,因为与PM的发病机制相似,因此它的诊断常常与PM相混。PM和sIBM都是T细胞介导的细胞毒免疫过程。两种疾病的肌肉纤维细胞都表达MHCI类分子和共同刺激因子,这些分子与侵润在肌细胞周围的CD8+T细胞的表面受体TCR结合,促进细胞毒性CD8+T细胞的增殖及激活。激活的细胞毒T细胞向肌纤维中释放穿孔素颗粒,通过穿孔素信号通路促使肌纤维细胞的凋亡。除了T细胞介导的细胞毒作用外,内质网应激在PM和sIBM发病过程中也发挥着作用。在患者的肌肉纤维中有空泡的形成,空泡内的包含物含有15~21nm的微管纤维丝的聚集物,以及细胞质中淀粉样蛋白与其抗体发生免疫反应的沉积物。出现空泡化的肌肉细胞虽然有MHCI抗原表达,但是几乎不出现T细胞的侵润,这暗示MHCI分子诱发内质网应激介导的非炎症过程可能与T细胞介导的细胞毒作用是影响PM和sIBM的两个相对独立的过程[1,2]。
微小RNA(miRNA)是一类具有转录后调控作用的内源性小分子RNA,它可以与靶基因的3’UTR区域相结合,通过降解靶基因mRNA或抑制mRNA转录等方式调控靶基因的表达。miRNA的成熟需要经历两个过程,首先在细胞核内RNaseIII Droasha和RNA结合蛋白DGCR8将miRNA的初始转录产物primiRNA剪切成60~70 nt的premiRNA。当premiRNA被转运到细胞质以后被另一种RNase Dicer剪切成21~25 nt的成熟的miRNA,成熟的miRNA与Argonaute2(Ago2)等蛋白构成能与靶基因miRNA结合的RNA沉默复合体,进而从转录后水平对靶基因进行调节。研究表明miRNA在生物体的很多生理过程中发挥着作用,特异性表达的miRNA可以控制细胞的增殖、分化、凋亡。一些miRNA的表达与疾病的发生和发展也有着密切的关系,例如癌症的发生以及免疫系统失调等等[3]。目前虽然关于miRNA与IIMs的报道较少,但已有的研究显示miRNA与IIMs的发生发展有着密切的关系。
2 miRNA在IIMs中的表达
特异性表达的miRNA与疾病的发病过程中有密切的联系,IIMs中特异性表达的miRNA可能对IIMs的发病起重要的调控作用。根据文献报道我们总结了目前在几种IIMs中表达较为特异性表达的miRNA(表1)。在Eisenberg等的研究中研究者分析了428种miRNA在十种肌肉疾病(包括DM、PM和sIBM)中的表达情况。与正常组织相比,DM中有35个miRNA发生变化,PM中有37个发生变化,sIBM中有20个发生变化。在这些发生变化的miRNA中,有七个miRNA在DM、PM和IBM当中的表达均增多,分别是hsa-miR-146b、hsa-miR-221、hsa-miR-155、hsa-miR-214、 hsa-miR-222、hsa-miR-34a 和hsa-miR-21[4]。Zhu等用芯片技术比较了淋巴细胞侵润的IIMs患者的肌肉组织与正常的肌肉组织miRNA的表达谱,结果显示有69个miRNA出现表达差异,其中5个miRNA表达增多,分别是miR-146a/b、 miR-155、 miR-21和miR-432,剩余的64个miRNA的表达下降,其中下降比较明显的miRNA是miR-133a/b、miR-1、miR-29c[5]。已有报道显示miR-146a和miR-155在淋巴细胞有较高的表达,在免疫应答中有重要的调节作用[6~8]。在另一篇报道中,Robert等也比较了DM、PM和sIBM患者肌肉活检组织与正常对照组的miRNA表达情况。结果发现了25个差异表达的miRNA,其中有8个表达增高的miRNA,17个表达下降的miRNA,作者发现控制肌肉分化的几个miRNA,如miR-146、miR-221、miR-378是几种组织与对照组表达差异最明显的几个miRNA;与肌肉分化和维持相关的几个miRNA如miR-133a/b、miR-1的表达在几种疾病的组织样本中都明显下降。同时研究者还发现在DM患者的肌肉中miR-206的表达也明显下降[9]。作者发现肿瘤坏死因子(TNF)的表达与几种表达下降的miRNA如miR-133a/b、miR-1及miR-206的表达呈负相关性。TNF能够通过NF-κB依赖途径抑制C2C12细胞向肌肉细胞的分化,而在C2C12细胞中过表达miR-133a/b、miR-1及miR-206这几种miRNA,能够逆转TNF的这种作用。

表1 IIMs中常见的miRNA表达情况及功能
除此之外,有研究比较了DM患者皮肤组织与正常组皮肤组织中miRNA的表达差异,发现在DM患者中有5种过表达的miRNA和27种表达降低的miRNA。作者重点观察了下降很明显的miR-7的表达情况,发现在DM组织和血清的检测中miR-7的表达都明显下降,作者认为miR-7可能成为检测DM的一种血清学的标志物[10]。Kim等分析了青少年DM患者肌肉活检组织中841个miRNA的表达情况,共检测到195个有变化的miRNA,其中miR-126是下降最明显的miRNA。作者发现在青少年DM患者发病早期,miR-126的表达明显下降,而血管粘附因子I(VACM-I)的表达增高,在长病程的患者中miR-126的表达回升,而VACM-I的表达也下降。这提示miR-126的表达负向调控了VACM-I的表达[11]。Tang等研究发现miR-206在DM患者发病过程中的表达下降,同时患者肌肉中会有TH17细胞的侵润。KLF4是TH17细胞的正向调控因子,同时KLF4是miR-206的一个多位点靶基因,作者认为miR-206通过影响KLF4的表达而对TH17起负向调控作用,进而对DM的发病起作用[12]。Shimada等分析了30位DM患者血清中miR-21的表达情况,结果显示miR-21在DM患者血清中的表达增加,因此作者认为miR-21可能成为DM的诊断分子[13]。
3 miRNA在IIMs中的调控功能
目前关于miRNA在IIMs中的功能的报道还相对较少,本文将分别从目前公认的IIMs的免疫过程中来探索miRNA在DM、PM和sIBM中的功能。
3.1 DM的免疫病理学发病的过程 当前研究认为DM的发病机理是由C3补体系统介导的。在该过程中C3被针对内皮细胞的抗体通过经典补体系统或补体旁路系统激活,导致C3b的形成,C3b新抗原和补体膜溶攻击复合物围绕在毛细血管的内皮细胞层的周围,补体膜溶攻击物的沉积导致毛细血管的解体和减少,导致肌纤维束周围局部缺血或形成微小血栓。最终肌纤维束周围毛细血管数量减少,管径增大,引发肌纤维束的萎缩。在此过程中内皮细胞受外围细胞因子调控而使得VCAM-1和ICAM-1表达增多,这些表达增多的分子能与淋巴细胞的表面分子intergrin结合激活LFA-4和LFA-1,促进B细胞、CD4+T细胞以及吞噬细胞等淋巴细胞从体循环向肌纤维束部位迁移。激活的T细胞和B细胞分泌的细胞因子又进一步促进了这个过程。在此过程中有多种蛋白分子参与,目前已有研究证实miRNA对该过程的一些重要蛋白有调控作用,如miRNA能调控该免疫过程的C3,LFA-1和ICAM-1等蛋白分子(图1)。

图1 DM发病过程参与调控免疫过程的miRNA[1]
DM是受C3调控的一种免疫性疾病,C3的激活对该疾病的发生起重要的作用。Yang等的研究显示miR-92d[14]能通过靶向抑制C3的表达而对免疫过程其调控作用。同时miR-3021也能够调控C3的表达[15],miR-221和 miR-222的表达与血清中C3的含量有相关性[16]。LFA-1的表达水平与CD4+T细胞向内皮细胞迁移过程相关,研究证实miR-21、miR-148a的高表达能够通过调控甲基化酶的活性来调控LFA-1的表达[17]。研究表明miR-221[18]、miR-222[19]、miR-21[20]、miR-146a[21]、miR-29b[22]、miR-320b[23]等miRNA能够靶向调控ICAM-1的表达,ICAM-1在DM发病过程中与CD4+T细胞的激活相关,这提示这些miRNA可能通过调控ICAM-1的表达参与到疾病的发病过程。
3.2 PM和sIBM的免疫病理学发病过程 目前认为PM和sIBM的免疫学发病机理相似。在此过程中肌肉纤维的坏死是由激活的自身侵蚀T细胞释放的穿孔素介导的,同时T细胞分泌的interferon-γ、interleukin-1和TNF-α的释放也能促进这种作用。CD8+T细胞表达的LFA-1与ICAM-1的结合促进了肌肉纤维与抗原接受的T细胞之间免疫突触的形成,激活CD8+T细胞。CD80、ICOS和CD40等共刺激因子与其相应的配体CD28,CTLA4(细胞毒T细胞相关蛋白4)、ICOSL和CD40L等结合能够促进和增强T细胞的激活效应。金属蛋白酶能够促进了T细胞的迁移以及其与肌肉细胞表面受体的结合。在PM和sIBM中CD8+T细胞介导的细胞毒过程中的多种蛋白的表达受到了miRNA水平的调控(图2)。

图2 PM和IBM发病过程中参与调控免疫过程的miRNA[1]
CD8+T细胞的LFA-1和VLA-4分子能分别与肌肉纤维细胞表达的ICAM-1和VCAM-1结合促进免疫突出的形成,进而促进细胞毒性CD8+T细胞的激活。miRNA对LFA-1和ICAM-1的调控在DM发病过程中已阐述,研究证实VLA-4分子与miR-17-92家族miRNA有密切关系[24],而VCAM-1蛋白的表达受到了miR-126的负向调控[25]。在激活细胞毒CD8+T细胞的过程中,CTLA4、CD40、ICOS等的信号分子与其配体结合能增强这种激活作用。研究显示CTLA4、ICOS以及CD40的配体CD40L都受到了miRNA水平的调控。MiR-15b、miR-16[26]、miR-145[27]及miR-155[28]都能够负向调控CTLA-4的表达。Yu等的研究发现miR-101能与ICOS蛋白mRNA的3’UTR靶向结合,ICOS表达受到了miR-101的靶向调控[29]。同时有研究也证实CD40L的表达受到miR-155[30]和miR-146a[31]的靶向调控。激活的CD8+T细胞能分泌一些细胞因子,如TNF-α、IL-1、IFN-γ等,这些细胞因子也受到了相关miRNA的调控。目前文献报道miR-149[32]能够靶向调控TNF-α和IL-1的表达,miR-146a[33]、miR-223[34]等能抑制IL-1的表达,而miR-155[35]能促进IL-1的表达。MiR-524-5P的高表达能够促进IFN-γ的表达[36],而miR-24、miR-181[37]、miR-29家族[38]、miR-155[39]等都可以抑制IFN-γ的表达。在T细胞的迁移并与肌纤维细胞结合的过程中,金属蛋白酶发挥着重要的作用。目前已知有较多的miRNA能够靶向调节金属蛋白酶的表达,如miR-520[40]、miR-29[41]、miR-21[42]等,这些miRNA可能通过对金属蛋白酶的抑制,进而调控了免疫过程中T细胞的迁移。miR-155对该过程的很多蛋白有调控作用,这也提示miR-155可能在PM和IBM的发病过程中发挥着重要的作用。
3.3 内质网应激对多发性肌炎和包涵体肌炎的影响 除了CD8+T细胞介导的细胞毒作用外,内质网应激导致的细胞凋亡也被认为是多发性肌炎和包涵体肌炎的一个重要的非免疫学发病过程。在包涵体肌炎患者的肌肉纤维中会有空泡的结构,空泡中含有15~21 nm的微管纤维丝的聚集物以及细胞质中淀粉样蛋白与其抗体发生免疫反应的沉积物,这些沉积的蛋白能引发内质网应激。在肌肉纤维细胞内质网中MHCI分子的重链相关的分子calnexin和β2 microglobulin能和5种分子伴侣蛋白(ERp57,glucose-regulated proteins GRP78 and GRP94,calreticulin,transporterassociated protein and tapasin),形成MHCI载肽复合物。细胞质中降解的蛋白,以及由免疫蛋白酶体合成的MHCI编码的亚单位、LMP2及LMP7通过转运自相关蛋白被转运到内质网中并与MHCI肽递呈复合物结合。高亲和性抗原肽诱发了MHCI分子构象的改变,促进了它们从递呈复合物上的释放。组装的MHCI分子被转运到肌肉纤维细胞的表面,使得及纤维细胞成为CD8+T细胞能够识别的抗原递呈细胞。如果当MHCI合成过多而缺少合适的抗原肽或者抗原肽的构象无法结合到MHCI复合物上时,MHCI抗原递呈复合物就变得不稳定,MHCI分子的重链会发生错误折叠,并且会从ER中转运到细胞质中被分解。当过多的沉积物发生时就会引起内质网应激,促使细胞的凋亡。
影响PM和IBM发病的内质网应激中的多种蛋白也受到miRNA的调控(图3)。MHCI的组成分子calnexin和β2 microglobulin都受到了miRNA的调控。研究表明miR-455的过表达能够导致calnexin的表达下降,而抑制miR-455的表达能够增加calnexin的表达[43]。β2 microglobulin的表达受到miR-320a/b[44]、miR-204/miR-211[45]、miR-21[46]的负向调控。内质网的分子伴侣GRP78能够促进miR-335和miR-363[47]的表达,而miR-30能够通过靶向抑制GRP78的表达降低ER效应[48]。
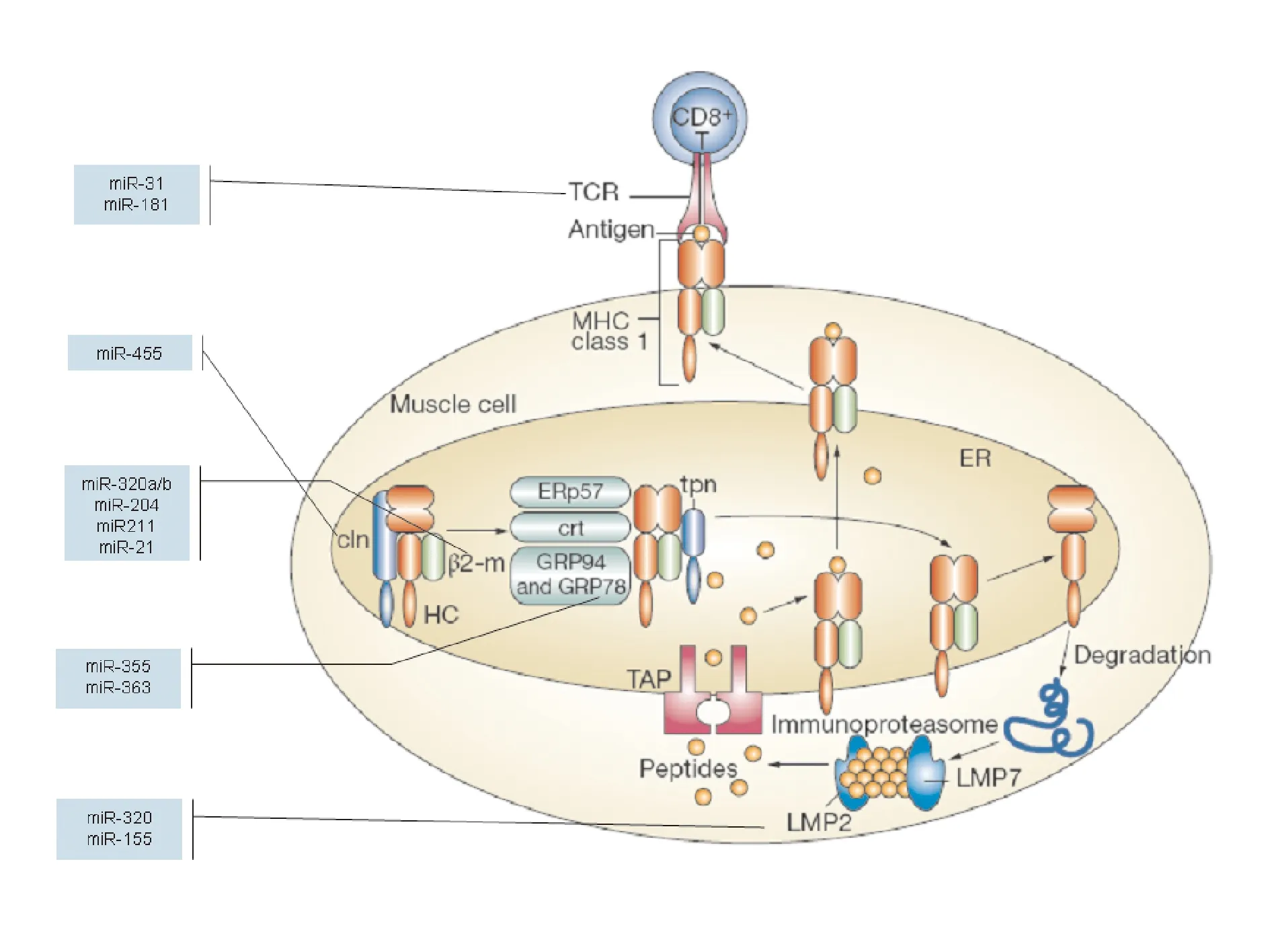
图3 PM和IBM发病过程中参与调控内质网应激过程的miRNA[1]
4 小结
虽然目前关于miRNA在IIMs方面的研究较少,但是越来越多的证据显示miRNA通过调控其靶基因的表达参与了对DM、PM和IBM免疫病理过程的调控。但miRNA能否作为一种分子标记物或干预措施对疾病进行诊断和治疗,需要进一步深入的研究。
[1] Dalakas MC.Mechanisms of disease:signaling pathways and immunobiology of inflammatory myopathies[J].Nat Clin Pract Rheumatol,2006,2(4):219-227.
[2] Dalakas MC.Inflammatory,immune and viral aaspects of inclusion body myositis[J].Neurology,2005,66(Suppl):S33-S38.
[3] Kim DH,Behlke MA,Rose SD,et al.Synthetic dsRNA dicer substrates enhance RNAi potency and efficacy[J].Nat Biotechnol,2005,23(2):222-226.
[4] Eisenberg I,Eran A,Nishino I,et al.Distinctive patterns of microRNA expression in primary muscular disorders[J].Proc Natl Acad Sci USA,2007,104(43):17016-17021.
[5] Zhu W,Streicher K,Shen N,et al.Genomic signatures characterize leukocyte infiltration in myositis muscles[J].BMC Med Genomics,2012,5:53.
[6] Pauley KM,Cha S,Chan EK.MicroRNA in autoimmunity and autoimmune diseases[J].J Autoimmun,2009,32:189-194.
[7] Dai R,Ahmed SA.MicroRNA,a new paradigm for understanding immunoregulation,inflammation,and autoimmune diseases[J].Transl Res,2011,157:163-179.
[8] Furer V,Greenberg JD,Attur M,et al.The role of microRNA in rheumatoid arthritis and other autoimmune diseases[J].Clin Immunol,2010,136:1-15.
[9] Georgantas RW1,Streicher K,Greenberg SA.et al.Inhibition of myogenic microRNAs 1,133,and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies[J].Arthritis Rheumatol,2014,66(4):1022-1033.
[10]Oshikawa Y1,Jinnin M,Makino T,et al.Decreased miR-7 expression in the skin and sera of patients with dermatomyositis[J].Acta Derm Venereol,2013,93(3):273-276.
[11]Kim E,Cook-Mills J,Morgan G,et al.Increased expression of vascular cell adhesion molecule 1 in muscle biopsy samples from juvenile dermatomyositis patients with short duration of untreated disease is regulated by miR-126[J].Arthritis Rheum,2012,64(11):3809-3817.
[12]Tang X,Tian X,Zhang Y,et al.Correlation between the frequency of Th17 cell and the expression of microRNA-206 in patients with dermatomyositis[J].Clin Dev Immunol,2013,2013:345-347.
[13]Shimada S,Jinnin M,Ogata A,et al.Serum miR-21 levels in patients with dermatomyositis[J].Clin Exp Rheumatol,2013,31(1):161-162.
[14]Yang R,Zheng T,Cai X,et al.Genome-wide analyses of amphioxus microRNAs reveal an immune regulation via miR-92d targeting C3[J].J Immunol,2013,190(4):1491-1500.
[15]Cui G,Li Z,Li R,et al.A functional variant in APOA5/A4/C3/A1 gene cluster contributes to elevated triglycerides and severity of CAD by interfering with microRNA 3201 binding efficiency[J].J Am Coll Cardiol,2014,64(3):267-277.
[16]Guan J1,Wang G,Tam LS,et al.Urinary sediment ICAM-1 level in lupus nephritis[J].Lupus,2012,21(11):1190-1195.
[17]Pan W,Zhu S,Yuan M,et al.MicroRNA-21 and microRNA-148a contribute to DNA hypomethylation in lupus CD4+ T cells by directly and indirectly targeting dna methyltransferase 1[J].J Immunol,2010,184(12):6773-6781.
[18]Hu G,Gong AY,Liu J,et al.miR-221 suppresses ICAM-1 translation and regulates interferon-gamma-induced ICAM-1 expression in human cholangiocytes[J].Am J physiol Gastrointest Liver Physiol,2010,298(4):542-550.
[19]Duan M,Yao H,Hu G,et al.HIV Tat Induces Expression of ICAM-1 in HUVECs:implications for miR-221/-222 in HIV-associated cardiomyopathy[J].PLoS One,2013,8(3):60170.
[20]Terao M,Fratelli M,Kurosaki M,et al.Induction of miR-21 by retinoic acid in estrogen receptor-positive breast carcinoma cells:biological correlates and molecular targets[J].J Biol Chem,2011,286(5):4027-4042.
[21]Wang Q,Bozack SN,Yan Y,et al.Regulation of retinal inflammation by rhythmic expression of MiR-146a in diabetic retina[J].Invest Ophthalmol Vis Sci,2014,55(6):3986-3994.
[22]Zhu HQ,li Q,Dong LY,et al.MicroRNA-29b promotes high-fat diet-stimulated endothelial permeability and apoptosis in ApoE knock-out mice by down-regulating MT1 expression[J].Int J Cardiol,2014,176(3):764-770.
[23]Gidlöf O,van der Brug M,Ohman J,et al.Platelets activated during myocardial infarction release functional miRNA,which can be taken up by endothelial cells and regulate ICAM1 expression[J].Blood,2013,121(19):3908-3917.
[24]Sasaki K,Kohanbash G,Hoji A,et al.miR-17-92 expression in differentiated T cells-implications for cancer immunotherapy[J].J Transl Med,2010,8:17.
[25]Angel-Morales G,Noratto G,Mertens-Talcott SU.Standardized curcuminoid extract(curcuma longa l.)decreases gene expression related to inflammation and interacts with associated microRNAs in human umbilical vein endothelial cells(HUVEC)[J].Food Funct,2012,3(12):1286-1293.
[26]Liu X,Robinson SN,Setoyama T,et al.FOXP3 is a direct target of miR15a/16 in umbilical cord blood regulatory T cells[J].Bone Marrow Transplant,2014,49(6):793-799.
[27]Fayyad-Kazan H,Rouas R,Fayyad-Kazan M,et al.MicroRNA profile of circulating CD4-positive regulatory T cells in human adults and impact of differentially expressed microRNAs on expression of two genes essential to their function[J].J Biol Chem,2012,287(13):9910-9922.
[28]Sonkoly E,Janson P,Majuri ML,et al.MiR-155 is overexpressed in patients with atopic dermatitis and modulates T-cell proliferative responses by targeting cytotoxic T lymphocyte-associated antigen 4[J].J Allergy Clin Immunol,2010,126(3):581-589.
[29]Yu D,Tan AH,Hu X,et al.Roquin represses autoimmunity by limiting inducible T-cell co-stimulator messenger RNA[J].Nature,2007,450(7167):299-303.
[30]Cui B,Chen L,Zhang S,et al.MicroRNA-155 influences B-cell receptor signaling and associates with aggressive disease in chronic lymphocytic leukemia[J].Blood,2014,124(4):546-554.
[31]Chen T,Li Z,Jing T,Zhu W,et al.MicroRNA-146a regulates the maturation process and pro-inflammatory Cytokine secretion by targeting CD40L in oxLDL-stimulated dendritic cells[J].FEBS Lett,2011,585(3):567-573.
[32]Santini P1,Politi L,Vedova PD,et al.The inflammatory circuitry of miR-149 as a pathological mechanism in osteoarthritis[J].Rheumatol Int,2014,34(5):711-716.
[33]Comer BS,Camoretti-Mercado B,Kogut PC,et al.MicroRNA-146a and microRNA-146b expression and anti-inflammatory function in human airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2014,307(9):L727-734.
[34]Haneklaus M1,Gerlic M,Kurowska-Stolarska M,et al.Cutting edge:miR-223 and EBV miR-BART15 regulate the NLRP3 inflammasome and IL-1β production[J].J Immunol,2012,189(8):3795-3799.
[35]Li X,Tian F,Wang F.Rheumatoid arthritis-associated microRNA-155 targets SOCS1 and upregulates TNF-α and IL-1β in PBMCs[J].Int J Mol Sci,2013,14(12):23910-23921.
[36]Lu MC,Yu CL,Chen HC,et al.Aberrant T cell expression of Ca2+influx-regulated miRNAs in patients with systemic lupus erythematosus promotes lupus pathogenesis[J].Rheumatology(Oxford),2014,pii:keu322.
[37]Fayyad-Kazan H,Hamade E,Rouas R,et al.Downregulation of microRNA-24 and-181 parallels the upregulation of IFN-γ secreted by activated human CD4 lymphocytes[J].Hum Immunol,2014,75(7):677-685.
[38]Yi ZJ1,Fu YR,Li JH,Zhang B.Expression and bioinformatic analysis of miR-29 Family,target gene IFN-γ in CD4(+)T cells from subjects with latent tuberculosis infection[J].Zhonghua Yu Fang Yi Xue Za Zhi,2013,47(7):632-636.
[39]Sullivan RP,Fogel LA,Leong JW,et al.MicroRNA-155 tunes both the threshold and extent of NK Cell activation via targeting of multiple signaling pathways[J].J Immunol,2013,191(12):5904-5913.
[40]Lu S,Zhu Q,Zhang Y,et al.Dual-functions of miR-373 and miR-520c by differently regulating the activities of MMP2 and MMP9.J Cell Physiol.2014 Dec 24.doi:10.1002/jcp.24914.[Epub ahead of print]
[41]Cai J,Yin G,Lin B,Wang X,et al.Roles of NFκB-miR-29s-MMP-2 circuitry in experimental choroidal neovascularization[J].J Neuroinflammation,2014,11:88.
[42]Fan X1,Wang E2,Wang X,et al.MicroRNA-21 is a unique signature associated with coronary plaque instability in humans by regulating matrix metalloproteinase-9 via reversion-inducing cysteine-rich protein with kazal motifs[J].Exp Mol Pathol,2014,96(2):242-249.
[43]Belmont PJ,Chen WJ,Thuerauf DJ,et al.Regulation of microRNA expression in the heart by the ATF6 branch of the ER stress response[J].J Mol Cell Cardiol,2012,52(5):1176-1182.
[44]Kubiczkova-Besse L1,Sedlarikova L,Kryukov F,et al.Combination of serum microRNA-320a and microRNA-320b as a marker for waldenstr?m macroglobulinemia[J].Am J Hematol,2014,26.doi:10.1002/ajh.23910.[Epub ahead of print]
[45]Li XY,Zhang K,Jiang ZY,et al.MiR-204/miR-211 downregulation contributes to candidemia-induced kidney injuries via derepression of Hmx1 expression[J].Life Sci,2014,102(2):139-144.
[46]Zhang TL1,Sun L,Wang SM,et al.Expression of miR-21 in multiple myeloma and its clinical significance[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2012,20(3):616-619.
[47]Qiao J,Lee S,Paul P,Theiss L,et al.miR-335 and miR-363 regulation of neuroblastoma tumorigenesis and metastasis[J].Surgery,2013,154(2):226-233.
[48]Chen M,Ma G,Yue Y,et al.Downregulation of the miR-30 family microRNAs contributes to endoplasmic reticulum stress in cardiac muscle and vascular smooth muscle cells[J].Int J Cardiol,2014,173(1):65-73.
The role of miRNA in inflamamatory myopathies
CHEN Xue-bin,WANG Guo-chun
(a.Department of Clinical Engineering,b.Department of Rheumatology & Immunology,China-Japan Friendship Hospital,Beijing 100029,China)
WANGGuo-chun
Dermatomyositis,polymyositis and sporadic inclusion body myositis are the most common subtypes of idiopathic inflamamatory myopathies(IIMs),which are underlying different inflammatory processes.Although the pathogenesis of IIM,the occurrence and development of dematomyositis is associated with complement-mediated immunologicprocess,Polymyositis and inclusion-body myositis are T-cell-mediated cytotoxic processes,and ER stress due to upregulation of MHC class I antigen expression is also involved in the progresses.MiRNAs,a class of 21~25 nt noncoding small RNAs,can regulate gene expression at post-transcriptional level.Dyregulated miRNAs may play important roles in the development of many diseases.In this review we summerized the specific expressed miRNAs in different subtypes of inflamamatory myopathies and analyzed the relationships between miRNAs and key proteins in the processes of these muscular disorders,which may be useful in clinical diagnosis and therapeutic strategies for inflamamatory myopathies.
Inflamamatory myopathies; miRNA; Pathogenesis
王国春,男,主任医师,教授,博士研究生导师。中华医学会风湿病分会委员。主要研究方向:特发性炎性肌病的临床及基础研究。
R593.2
A
1672-6170(2015)05-0017-06
2015-07-08)
