人工栽培猕猴桃酿酒酵母筛选研究
2015-06-20王燕,刘娟
王 燕,刘 娟
(乐山师范学院 生命科学学院,四川 乐山 614004)
猕猴桃被誉为维生素C之王,鲜果及其深加工产品都深受国内外消费者青睐[1]。随着人工猕猴桃栽培技术的成熟与发展,栽培猕猴桃产量剧增,但猕猴桃不耐贮藏,尤其在生产旺季,给产地猕猴桃销售造成困境,加大果实加工产品的开发,对于猕猴桃资源的利用有很大的意义和前景[2-5]。
如今猕猴桃酒的生产工艺大多是自然发酵或采用葡萄酒酵母、酿酒活性干酵母作为酿酒菌株,但自然发酵生产过程不易控制,难以实现规范化及大规模生产;而采用葡萄酒酵母、酿酒活性干酵母作为酿酒菌株,由于这些菌种并不是针对猕猴桃酒的生产工艺的特点开发出来的,酿酒产品效果并不好[6-7]。本研究从峨眉山地区生产的成熟野生猕猴桃中分离筛选出优良的猕猴桃酿酒酵母菌株MY-20[6],然后以人工栽培猕猴桃为原料,分别以筛选菌株和MY-20为发酵菌株进行果酒发酵对比。期望筛选出产酸、产酒、口感及其他一些发酵特征均较优的、适合人工栽培猕猴桃为原料的酿酒酵母菌株。使之经后期驯化能成为适合猕猴桃工业酿酒的专用菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 发酵原料
人工栽培猕猴桃:乐山地区市售。
1.1.2 实验菌种
酿酒酵母菌株MY-20:乐山师范学院生命科学学院资源微生物实验室。
1.1.3 培养基[3,6]
酵母菌种培养及筛选培养基:1%酵母膏,2%蛋白胨,2%葡萄糖,2%琼脂粉。
酵母菌发酵液体培养基:含40%猕猴桃果汁,蔗糖2%。
1.2 仪器设备
CX41生物显微镜:日本奥林巴斯株式会社;WS-300恒温摇床:德国WIGGENS公司;GHP-9080恒温培养箱、SW-CJ-2FD超净工作台:扬州慧科电子有限公司;YH110酒精计:青县燕河仪器仪表有限公司。
1.3 实验方法
1.3.1 猕猴桃果汁液体培养基制备
先将猕猴桃进行分选,去杂物和霉烂果,再用流动水冲洗,去皮,在冰柜中预冷至10℃,迅速打浆,将匀浆转入大烧杯中,加入果胶酶100 mg/L,密封烧杯口,室温条件下酶解12 h。酶解结束后的浆液用4层纱布过滤,滤液置于烧杯中4℃静置冷却0.5 h。取上清液作为发酵培养基。将上述猕猴桃汁上清液分装入已灭菌的发酵瓶,每瓶150 mL,然后加3 g蔗糖摇匀[8],紫外灯照射1 h灭菌。
1.3.2 人工栽培猕猴桃酵母菌种的分离纯化[3,6]
将成熟软化的栽培猕猴桃切一小块果皮放入猕猴桃果汁液体培养基中,室温条件下(25~28℃)培养。每隔12 h观察一次,选取感官判断带有明显酒味的发酵试管,摇匀管内液体后梯度稀释(10-1,10-2,……),然后把原发酵液与稀释液分别涂布于无菌酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)平板,每个浓度各涂布10个平板,标记,28℃恒温培养3 d,观察菌落。挑选长势较好,形态不相同,与MY-20也明显不同的酵母菌落分别接种至无菌YEPD斜面,28℃恒温培养。然后同样条件平板培养,观察记录菌落菌苔形态,镜检确定并记录细胞形态[2]。
1.3.3 不同酵母发酵对比
将从猕猴桃中筛选出的菌株与MY-20同时进行发酵培养。每种菌株分别接种3环到无菌猕猴桃果汁液体培养基中,恒温摇床60 r/min,28℃培养。再分别测其产酒、产酸性能,并对其发酵液感官特性作出评价。
1.3.4 分析检测
酵母菌株产酒力测定、发酵液的酸度测定[9]:按国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法;发酵液感官特性评价:感官评价[10-15]。
2 结果与分析
2.1 栽培猕猴桃酵母菌种的分离纯化结果
据菌落的生长特征及显微镜下酵母细胞的观察,筛选出3株产酒酵母菌,分别编号为ZMJ-1、ZMJ-2、ZMJ-1。各菌株生长及细胞形态记录见表1。

表1 实验室筛选菌株特征Table 1 Features of selected strains
2.2 菌株发酵过程中酸度变化测定结果
酸度是评判猕猴桃酒酵母菌发酵效果的一项重要指标。酸度过高会使猕猴桃酒口感不愉悦,酸度过低则使口味趋于平淡。所以,好的菌株应该是在发酵过程中使发酵液既具备一定的酸度,保证好的口感,又能在发酵过程中使发酵液的pH值不继续降低[2]。
从刚刚接入菌种开始计时,测定发酵初(第0天)的发酵液pH,之后每间隔1 d测定一次。测得发酵液的pH值如图1所示。
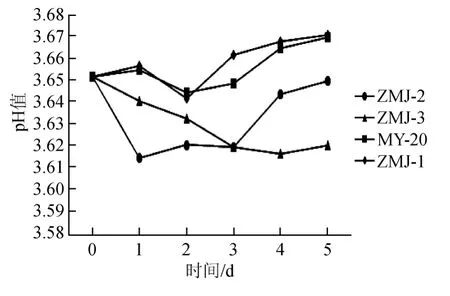
图1 发酵时间对发酵液pH值的影响Fig.1 Effect of fermentation time on fermentation broth pH
由图1可见,接种ZMJ-3的发酵液于第1天pH值出现下降,且之后一直维持低pH状态。规模化生产中为保证生产效率,发酵果汁一旦浓缩,会造成发酵液酸性过强,会对生产过程在很大程度上造成不利影响。接种ZMJ-1培养基在发酵前2dpH呈下降趋势,第3天开始上升,并趋于平稳,最终pH维持在3.67左右;接种MY20菌株的培养基pH值同样在前2 d下降,在第3天开始上升,但上升速度较ZMJ-1慢,且最终pH也相对略低;接种ZMJ-2的发酵液在前3 d pH下降,最低pH达3.62,与ZMJ-3相同,虽于第4天pH出现上升,但pH值明显低于ZMJ-1和MY-20。综上所述,从发酵液的pH值变化方面考虑,ZMJ-1和MY-20较优。第2天接种ZMJ-1的发酵液pH值为3.64,MY-20的发酵液为pH 3.65,虽然前者略低,但差距并不明显。第3天ZMJ-1的发酵液pH值为3.66,上升明显,而MY-20发酵液为pH 3.65,明显低于ZMJ-1。因此,从发酵pH值的变化角度考虑,ZMJ-1更快达到高值并趋于稳定,较为适宜。
2.3 菌株产酒精能力测定结果[2]
优良的酿酒菌株应该是产酒力达到某个所需酒精度(一般果酒酒精度在7%vol左右)的时间越短越好。按照酒精计法,分别于发酵第3天与发酵第5天测定发酵液酒精度,酒精度测量结果见表2。
从表2可见,ZMJ-1产酒能力最优,5 d后酒精度达到7.3%vol。MY-20于5 d后发酵液酒精度为6.8%vol,低于ZMJ-1,且与之前以野生猕猴桃为发酵液时(5 d后MY-20发酵液酒精度达7.8%vol)比较,相对较低[2]。这可能与栽培猕猴桃原料糖含量较野生猕猴桃低以及ZMJ-1来源于栽培猕猴桃内生菌株筛选分离,更能适应原料、生长较好有关。由此可见,若以栽培猕猴桃为酿酒原料,ZMJ-1在产酒力方面更有优势。

表2 各菌株发酵结果Table 2 The fermentation results of strains
2.4 发酵过程中猕猴桃酒的感官评价[2]

表3 发酵第3天及第5天发酵液感官评价Table 3 Sensory evaluation of fermentation broth after fermentation for 3 d and 5 d
由表3可知,4株菌株在发酵过程中均出现了不同程度的泡沫。ZMJ-1在发酵第3天出现少量泡沫,发酵第5天泡沫量减少,表面只有极少量泡沫。其次是MY-20,发酵第3天出现少量泡沫,发酵第5天表面泡沫量较其第3天少,比ZMJ-1多。ZMJ-2虽然在第5天表面泡沫量与MY-20相当,但是第3天出现了较多泡沫,这在工业上是不利因素。ZMJ-3第3天出现少量泡沫,第5天泡沫量大。因此,在产生泡沫量方面,ZMJ-1表现最优。从发酵液感官特性来看,ZMJ-2和ZMJ-3二者较差,在第5天均出现了不同程度的败酸味。第5天二者发酵液均具有澄清、有光泽的优良品质,且具有一定的果味和酒味适宜。因此,从感官评价考虑,ZMJ-1较为适宜。
3 结论
试验从栽培猕猴桃原料本身分离筛选出了3株酿酒酵母ZMJ-1、ZMJ-2、ZMJ-3。3株酵母均具有一定的产酒能力。
从与实验室已有从野生猕猴桃原料中分离的优良菌株MY-20一同进行了栽培猕猴桃为原料的发酵实验后发现:
ZMJ-1和MY-20在发酵过程中发酵液pH值变化均为先小幅下降,然后上升至pH 3.67左右,超过原液pH值。但ZMJ-1发酵液pH值上升更迅速,更快趋于稳定,所以从发酵pH值的变化角度考虑,ZMJ-1优于MY-20。
发酵5 d后ZMJ-1发酵液酒精度达到7.3%vol。MY-20达到6.8%vol,皆接近果酒适宜酒精度。但MY-20产酒能力低于ZMY-1,也低于之前以野生猕猴桃为发酵原料产酒(5 d后MY-20发酵液酒精度达7.8%vol)[2]。这可能与栽培猕猴桃原料糖含量较野生猕猴桃低,以及MY-20较ZMJ-1不能更好的适应原料,生长受到不良影响有关。由此可见若以栽培猕猴桃为酿酒原料,ZMJ-1更优。
ZMJ-1和MY-20发酵液在感官性状方面表现优良,第5天二者发酵液均具有澄清、有光泽的优良品质,且具有一定的果味和酒味适宜。从感官品质考虑,ZMJ-1略优于MY-20。
综上,若以栽培猕猴桃为原料规模化酿造猕猴桃酒,ZMJ-1和MY-20均为较优良酿酒菌株,但ZMJ-1在发酵性能上优于MY-20,因此,ZMJ-1经过后期驯化改良,有望成为工业化生产猕猴桃酒的酿酒菌株。
[1]孙洪浩,朱正军,邓元海,等.野生猕猴桃干酒酿造工艺研究[J].中国酿造,2014,33(3):62-66.
[2]李加兴,陈双平,梁先长,等.猕猴桃干型果酒发酵工艺优化[J].食品科学,2010,31(22):504-507.
[3]周 元,张 强,傅虹飞,等.猕猴桃果酒酵母的筛选及发酵工艺优化[J].西北农林科技大学学报:自然科学版,2014(12):151-160.
[4]张 超,徐 洲,游 玲,等.野生猕猴桃果酒带渣发酵的研究[J].食品研究与开发,2012(8):23-27.
[5]李潇卓,刘长江.软枣猕猴桃果酒酿造工艺的研究[J].食品工业科技,2014(3):207-215.
[6]王 燕,金 利.峨眉山野生猕猴桃酿酒酵母筛选研究[J].食品工业科技,2012(3):178-180.
[7]徐清萍,朱广存.野生猕猴桃果酒酵母的筛选鉴定及耐受性的研究[J].中国酿造,2011,30(7):120-123.
[8]刘树文,常亚维,胡 廷,等.不同树龄葡萄自然发酵过程中酵母菌的研究[J].西北农林科技大学学报:自然科学版,2008(7):51-56.
[9]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[10]冯尚坤.营养型猕猴桃酒发酵工艺优化[J].中国酿造,2015,34(2):172-175.
[11]蒋立文,李 娟,呙亚波,等.桑椹果酒发酵工艺条件的研究[J].食品科技,2008(2):24-28.
[12]戴桂芝,王兆玉,李 燕.影响果酒发酵质量因素及其控制措施[J].保鲜与加工,2003(4):8-10.
[13]潘晓飚,冯春梅,莫云彬,等.杨梅果酒果浆发酵技术研究[J].浙江农业学报,2006,18(2):103-105.
[14]张江波,岳田利,高振鹏,等.猕猴桃酒优质酵母的筛选及原生质体电融合条件初探[J].中国酿造,2008,27(15):12-16.
[15]周一琴,徐怀同,罗安伟,等.猕猴桃酒用酵母的选育研究[J].中国酿造,2008,27(1):57-60.
