碳酸盐共沉淀法制备LiNi0.5Mn0.5O2
2015-06-19刘元刚徐强李红张联齐
刘元刚,徐强,李红,张联齐
(1.天津市科技工作者创新创业服务中心,天津300041;2.天津大学化工学院,天津300072;3.天津理工大学材料科学与工程学院,天津300384)
碳酸盐共沉淀法制备LiNi0.5Mn0.5O2
刘元刚1,徐强2,李红2,张联齐3
(1.天津市科技工作者创新创业服务中心,天津300041;2.天津大学化工学院,天津300072;3.天津理工大学材料科学与工程学院,天津300384)
采用碳酸盐共沉淀法制备了LiNi0.5Mn0.5O2正极材料。研究了原料中不同锂含量对电极性能的影响。材料分析结果表明,碳酸盐共沉淀法合成的LiNi0.5Mn0.5O2材料中Ni和Mn分布均匀,离子混排小,结构有序。充放电测试结果表明,原料中过量锂的存在极大地改善了LiNi0.5Mn0.5O2材料的循环性能和倍率性能。在2.5~4.5 V的电压范围内,原料中锂未过量的LiNi0.5Mn0.5O2电极首次和80次循环后的放电比容量分别为190.3和153 mAh/g。当原料中锂过量10%时,LiNi0.5Mn0.5O2电极首次和80次循环后的放电比容量分别为180.2和174.6 mAh/g,两种电极的容量保持率分别为80.4%和96.9%。当以4放电时,未过量和过量10%锂的LiNi0.5Mn0.5O2电极的放电比容量分别为91和100 mAh/g。关键词:LiNi0.5Mn0.5O2;碳酸盐共沉淀法;锂离子电池;正极材料
2001年,Ohzuku等[1]首次报道了锂离子电池正极材料LiNi0.5Mn0.5O2,这种电极材料由于具有充放电容量高、热稳定性好、价格低廉等优点,展现出了巨大的应用潜力。虽然Li-Ni0.5Mn0.5O2材料具有强大的竞争力,但仍然存在反应产物中含有杂相掺杂及Li、Ni离子混排等问题[2]。目前LiNi0.5Mn0.5O2材料的合成方法主要有固相法、溶胶-凝胶法、离子交换法、氢氧化物共沉淀法等。虽然上述每一种合成方法均有独特的优势,但也都有各自的不足之处,如:采用固相法和溶胶-凝胶法不容易得到纯相产物;离子交换法消耗锂盐过多,制备成本较高;而氢氧化物共沉淀法合成材料时必须通入惰性气体以防止Mn2+被氧化,对设备防腐蚀性能的要求较高。而碳酸盐共沉淀法由于具有成本低、组分均匀、条件温和、成球性好等优点[3-4],已经得到了广泛的应用。
本文利用碳酸盐共沉淀法制备了碳酸盐前驱体,把得到的前驱体与碳酸锂混合并焙烧后制备出LiNi0.5Mn0.5O2电极材料。分析了LiNi0.5Mn0.5O2材料的组成、结构及表面形貌,研究了原料中锂过量对LiNi0.5Mn0.5O2材料电化学性能的影响。
1 实验
1.1 LiNi0.5Mn0.5O2材料的制备方法
称取按照化学计量比配制的NiSO4·6 H2O和MnSO4·H2O的2 mol/L混合液2 L,Na2CO3与124 mL氨水(以上物质均为AR)的2 mol/L混合液4 L。将上述混合液通过蠕动泵分别打入反应釜中,控制反应釜内的pH值为8.15,反应温度为50℃,搅拌12 h,反应完成后陈化1天。将所得的反应沉淀物过滤后,用去离子水充分洗涤,并用BaCl2溶液来检测沉淀物的洗涤情况。待过滤液中不含SO42-时,将沉淀产物抽滤后烘干,即可得到前驱体材料Ni0.5Mn0.5CO3。将Ni0.5Mn0.5CO3与化学计量比的Li2CO3相混合,在空气气氛中分2步进行烧结。首先在600℃下保温处理5 h,然后升到900℃继续保温处理16 h,即可得到LiNi0.5Mn0.5O2电极材料。
本文制备了两种不同原料组分的LiNi0.5Mn0.5O2材料烧结样品L1.0[(Li)∶(Mn+Ni)=1∶1]和L1.1[(Li)∶(Mn+Ni)=1∶1.1],这两种样品在烧结前的碳酸锂含量均过量4%,以补充高温烧结处理过程中造成的锂损失。
1.2 LiNi0.5Mn0.5O2材料的性能分析
用Rigaku D/MAX-2500型X射线衍射(XRD)仪对产物进行物相分析,阴极Cu靶Kα辐射,管压40 kV、管流150 mA,扫描速度为8(°)/min,步长为0.02°;利用JMS-6700F型扫描电子显微镜(SEM)对产物进行形貌分析。利用SPS-7800型等离子体电感耦合分析仪(ICP)对前驱体材料的组成元素进行分析。利用YY-HQH6欧美克激光粒度分析仪来分析前驱体颗粒的粒径分布。
1.3 LiNi0.5Mn0.5O2材料的电化学测试
将0.4 g聚偏氟乙烯(PVDF)溶解到12 mL的N-甲基吡咯烷酮(NMP)溶液中,分别加入3.2 g LiNi0.5Mn0.5O2材料和0.4 g炭黑进行混合。经电动搅拌后,将得到的浆料均匀涂覆在铝箔集流体上,在120℃下抽真空(真空度为-0.1 MPa,下同),烘干12 h,然后经过辊压、裁片及称重处理,得到正极片。以金属锂片为负极,1 mol/L LiPF6/(EC+DMC)(体积比为1∶1)为电解液,Celgard 2400膜为电池隔膜,在充满氩气的手套箱中组装成CR2032型扣式电池。在CT2001A型电池测试系统上进行电池的充放电测试。以0.1(1=200 mA/g)恒流充电至4.5 V,转恒压充电至0.01,然后以0.1恒流放电至2.5 V。
2 结果与讨论
2.1 LiNi0.5Mn0.5O2的结构分析和表面形貌
图1为前驱体Ni0.5Mn0.5CO3材料和烧结后得到的LiNi0.5-Mn0.5O2材料的XRD图谱。从图1(a)中可以发现,采用碳酸盐共沉淀法制备的前驱体材料为典型的碳酸盐结构(JCPDS No. 44-1472),对应的空间群为R-3c。结合电感耦合等离子体光谱分析法(ICP)的分析结果可知,前驱体材料的化学组成为Ni0.491Mn0.509CO3,这基本与反应方程式的理论组成相符。图1(b)为前驱体材料与碳酸锂混合焙烧后得到的LiNi0.5Mn0.5O2材料的XRD图谱。可以发现,LiNi0.5Mn0.5O2材料具有类似于α-NaFeO2材料的层状结构,空间群为R3m。LiNi0.5Mn0.5O2材料(003)/(104)峰强度的比为1.2,(006)、(102)和(108)、(110)两个峰之间均出现明显的分裂,表明采用碳酸盐共沉淀法制备的Li-Ni0.5Mn0.5O2材料中Ni和Mn分布均匀,离子混排小,结构有序[4]。
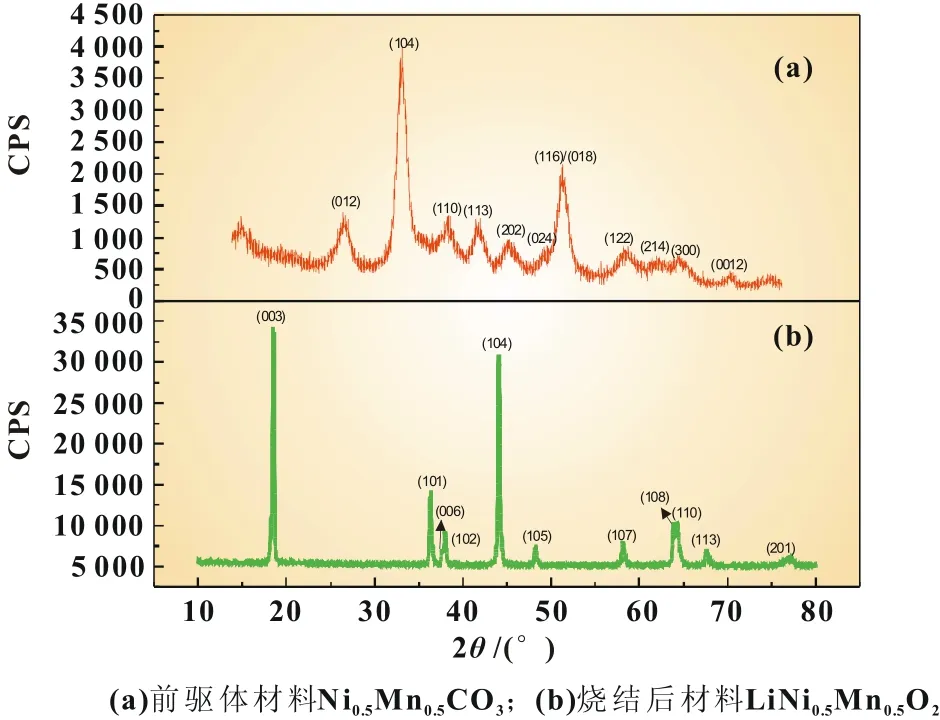
图1两种材料的XRD谱图
图2 为前驱体Ni0.5Mn0.5CO3和烧结后得到的LiNi0.5Mn0.5O2材料的扫描电镜图。从图2中可以明显地看到合成的前驱体是由许多平均粒径约13μm的球形颗粒所组成的,每个颗粒的表面光滑平整。而经与碳酸锂烧结后得到的LiNi0.5Mn0.5O2材料的表面形貌与前驱体Ni0.5Mn0.5CO3材料基本相同,也是呈球形颗粒分布。图3为前驱体Ni0.5Mn0.5CO3材料的粒度分布曲线,可以发现,前驱体材料的50约为13.12μm,这与上述扫描电镜的测试结果基本上相符。

图2 两种材料在不同倍率下的SEM照片

图3 前驱体材料Ni0.5Mn0.5CO3的粒度分布曲线
2.2 LiNi0.5Mn0.5O2的电化学性能
图4为L1.0和L1.1材料在2.5~4.5 V电压区间的首次充放电曲线和循环性能曲线(电流密度为20 mA/g)。由图4(a)可知,L1.0和L1.1材料的首次充(放)电比容量分别为206.4(190.3)和227.3(180.2)mAh/g。可以发现,L1.1材料的首次放电比容量要低于L1.0材料,这是由于过量的锂不能进入LiNi0.5Mn0.5O2材料已占满的晶格3 a位,只能聚集在LiNi0.5Mn0.5O2材料的晶界或粒界处,进而形成一部分不可逆死锂的缘故[5]。由图4(b)可知,当电池循环充放电80次后,L1.0和L1.1材料的放电比容量分别为153和174.6 mAh/g,即循环80次后L1.0和L1.1两种材料的容量保持率分别为80.4%和96.9%,这表明原料中锂过量明显有助于提高LiNi0.5Mn0.5O2材料的循环性能。

图4L1.0和L1.1材料在2.5~4.5 V范围的充放电曲线
图5 为L1.0和L1.1两种材料在2.5~4.5 V的电压区间内于不同电流密度下的倍率放电曲线。由图5可以发现,在小电流放电条件下,L1.1材料的放电比容量略低于L1.0材料;然而,随着放电电流的逐步升高,L1.1材料的倍率放电比容量则明显地大于L1.0材料。在4的大电流放电条件下,L1.1材料的比容量可达100 mAh/g,这表明原料中锂过量还可以提高LiNi0.5-Mn0.5O2材料的倍率放电性能。

图5 L1.0和L1.1材料在2.5~4.5 V电压范围内的倍率放电性能曲线
3 结论
利用碳酸盐共沉淀法成功地制备出LiNi0.5Mn0.5O2正极材料。分析了LiNi0.5Mn0.5O2材料的组成、结构及表面形貌,研究了原料中不同锂含量对LiNi0.5Mn0.5O2材料电化学性能的影响。充放电测试结果表明,原料中锂过量可以明显提高Li-Ni0.5Mn0.5O2材料的循环性能和倍率放电性能。在2.5~4.5 V的电压范围内,L1.0[(Li)∶(Mn+Ni)=1∶1]和L1.1[(Li)∶(Mn+ Ni)=1∶1.1]材料的放电比容量分别为153和174.6 mAh/g,即循环80次后两种电极材料的容量保持率分别为80.4%和96.9%。以4电流放电时,L1.0的放电比容量为91 mAh/g,而L1.1为100 mAh/g。
[1]OHZUKU T,MAKIMURA Y.Layered lithium insertion material of LiNi1/2Mn1/2O2:a possible alternative to LiCoO2for advanced lithiumion batteries[J].Chemistry Letters,2001:744-745.
[2]MENG X,DOU S,WANG W.High power and high capacity cathode material LiNi0.5Mn0.5O2for advanced lithium-ion batteries[J].Journal of Power Sources,2008,184(2):489-493.
[3]WANG D,BELHAROUAK I,KOENIG G M,et al.Growth mechanism of Ni0.3Mn0.7CO3precursor for high capacity Li-ion battery cathodes[J].Journal of Materials Chemistry,2011,21:9290-9295.
[4]SHIN H,PARK S,BAE Y,et al.Synthesis of LiNi0.475Co0.05Mn0.475O2cathode materials via a carbonate process[J].Solid State Ionics,2005, 176:2577-2581.
[5]李相良,刘亚飞.燃烧法制备层状正极材料LiNi0.5Mn0.5O2[J].电池,2010,40(2):71-73.
Synthesizing of layered cathode material of LiNi0.5Mn0.5O2by carbonate co-precipitation method
LIU Yuan-gang1,XU Qiang2,LI Hong2,ZHANG Lian-qi3
The cathode material of LiNi0.5Mn0.5O2was prepared by the carbonate coprecipitation.The effect of different feed ratio of lithium on the electrochemical performance of LiNi0.5Mn0.5O2was also studied.The analitical results show that the LiNi0.5Mn0.5O2has an ordered structure with a little confusion of ion position in the lattice and the distribution of Ni and Mn is uniform.The results of charge-discharge tests show that the lithium excess in the feed ratio has greatly improved both the cyclic performance and the rate capability of LiNi0.5Mn0.5O2.The discharge specific capacities of the LiNi0.5Mn0.5O2for the first time and after 80 cycles were 190.3 and 153 mAh/g in the range of 2.5-4.5 V, respectively.The discharge specific capacities of the LiNi0.5Mn0.5O2(lithium excess 10%)for the first time and after 80 cycles were 180.2 and 174.6 mAh/g in the range of 2.5-4.5 V,respectively.The capacity retention ratios of LiNi0.5Mn0.5O2and LiNi0.5Mn0.5O2(lithium excess 10%)were 80.4%and 96.9%,respectively.The discharge specific capacities of LiNi0.5Mn0.5O2and LiNi0.5Mn0.5O2(lithium excess 10%)at a current of 4were 91 and 100 mAh/g, respectively.
LiNi0.5Mn0.5O2;carbonate co-precipitation method;lithium-ion battery;cathode material
TM 912
A
1002-087 X(2015)03-0464-02

2014-08-06
刘元刚(1978—),男,山东省人,博士,工程师,主要研究方向为能源电化学。
徐强,E-mail:xuqiang@tju.edu.cn
