Fe2+/H2O2体系内各种自由基在氧化NO中的作用
2015-06-19赵海谦高继慧周伟王忠华吴少华
赵海谦,高继慧,周伟,王忠华,吴少华
(1哈尔滨工业大学能源科学与工程学院,黑龙江 哈尔滨150001;2东北石油大学土木建筑工程学院,黑龙江 大庆 163318)
引 言
目前已成功商业化的脱氮技术有低NOx燃烧技术(LNB)、选择性催化还原技术(SCR)和选择性非催化还原技术(SNCR)。SCR脱氮技术比较成熟,NOx脱除效率较高,但其初投资和运行费用过高,系统阻力大,氨泄漏及废弃催化剂二次污染等问题也不容忽视。LNB技术从源头减排,经济可靠,是NOx减排的基础技术。目前先进的LNB技术,已可将燃用烟煤锅炉烟气的 NOx排放水平控制在 300 mg·m−3以下[1]。目前,我国燃煤电站已普遍安装了成熟的尾部脱硫装置。在 LNB技术基础上,挖掘现有脱硫装置的 SO2、NOx协同控制潜力,对于推动我国燃煤污染物控制技术进步、实现深度减排具有重要意义。
燃煤烟气NOx中约95%是难以被吸收的NO,发展经济高效且无杂质引入的NO氧化技术是实现烟气SO2和NOx高效协同控制的关键。H2O2具有氧化性强、无二次污染等优点而被广泛关注[2-4]。近年,国内外学者开始了H2O2氧化烟气中NO的研究[5-12]。Cooper等[6]研究了紫外光照射条件下 H2O2对 NO的氧化,研究认为·OH及 HO2·均具有氧化 NO的作用。Kim 等[7]进行了电催化 TiO2/H2O2体系氧化NO的实验研究,研究认为TiO2在高压电能作用下产生电子与空穴,进一步与H2O2及H2O反应生成·OH,实现对 NO的氧化。Collins等[8]进行了500℃温度条件下,向烟气内喷入H2O2溶液对NO的氧化试验。Limvoranusorn等[9]认为此温度条件下H2O2快速热分解产生·OH(H2O2=2·OH),实现了 NO 的快速氧化,生成 HONO、HONO2、NO2等产物。但在500℃温度条件下,NO的氧化产物很容易再次分解。因此,要实现硫氮协同控制,必须实现NO在较低温度条件下的高效快速氧化。
Fe2+/H2O2体系一直是液相污染物控制领域的研究热点。在Fe2+催化作用下,H2O2在较低温度条件下即可分解,体系内主要存在·OH、HO2·及·3种自由基[13],自由基(尤其是·OH)的存在实现了液相体系内有机污染物的降解。目前,Fe2+/H2O2体系氧化NO气体的研究尚未见报道,体系内各种自由基在氧化NO气体过程中的作用还有待于探究。本文实验研究了Fe2+/H2O2体系对NO气体的氧化,重点确定体系内·OH、HO2·及3种自由基在氧化 NO过程中的行为。研究结果可为认识Fe2+/H2O2体系氧化NO气体机理,实现较低温度条件下H2O2对NO的高效快速氧化提供理论依据。
1 实验部分
1.1 试剂
过氧化氢(30%)、盐酸(37%)、氢氧化钠、草酸钛钾、七水硫酸亚铁、二甲基亚砜(DMSO)、联苯三酚、三羟甲基氨基甲烷(Tris)、氯化硝基四氮唑蓝(NBT)均为国产分析纯。
1.2 分析测试仪器
紫外可见分光光度计,T6型,北京普析通用;纯水机,Master-s型,上海和泰;滴定仪,ZDJ-5型,上海雷磁;增强型烟气分析仪,VARIO PLUS型,德国MRU;磁力搅拌器,C-MAG HS7,德国IKA。
1.3 实验装置
本次研究的NO气体氧化实验在气液反应分析实验系统中进行,实验装置如图1所示。系统由双层玻璃反应器、恒温水浴、气体成分分析仪、分光光度计及气体管路组成。
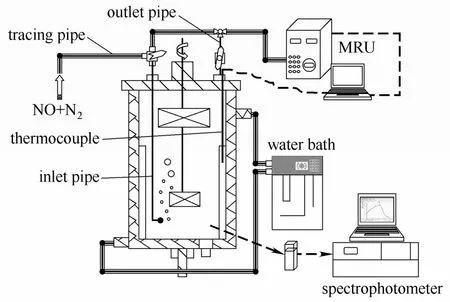
图1 气液反应分析实验系统Fig.1 Gas-liquid reaction analysis system
1.4 实验方法
检测Fe2+/H2O2体系中·浓度时,首先采用去离子水配置 30 mmol·L−1的 H2O2溶液 50 ml,并加入 0.0695 g FeSO4·7H2O充分搅拌,构成Fe2+/H2O2体系。从体系内量取 5 ml试样,加入0.1226 g·捕获剂NBT。试样被强光照射15 min后,稀释一定倍数后进行分光光度测试。NBT会与·反应生成蓝色产物甲臜,在600 nm附近产生较宽的吸收峰[14]。
研究·OH及HO2·对NO的氧化作用时,采用Fe2+/H2O2体系分解同时产生·OH及HO2·。取34 g H2O2(30%)置于1000 ml量筒中,加去离子水稀释至980 ml,充分搅拌后倒入双层玻璃反应器。取1.39~2.78 g七水硫酸亚铁溶解于20 ml去离子水中。NO+N2模拟气体以鼓泡方式进入反应器底部,末端采用MRU气体成分分析仪检测NO浓度。待NO浓度稳定后,用注射器将配置好的FeSO4溶液注入反应器内,溶液中FeSO4初始浓度为5~10 mmol·L−1,H2O2溶 液 初 始 浓 度 为 300 mmol·L−1。·OH及HO2·对NO的氧化实验过程中,通过恒温水浴维持溶液温度恒定。在确定·OH及 HO2·各自的作用时,向相同工况 Fe2+/H2O2体系内添加·OH 捕获剂 DMSO[15],[DMSO]0/[H2O2]0=4,将体系内·OH全部捕获。对比添加DMSO前后Fe2+/H2O2体系对NO氧化作用的变化,即可分析出·OH及 HO2·两种自由基分别对 NO的氧化能力。
为避免水中残留O2、CO2等对测试结果的影响,实验用去离子水均充分加热一段时间,再进行配液。溶液加入反应器后,先经过高纯氮气(99.999%)充分吹扫,直至系统中检测不到残留 O2及CO2等气体。
1.5 分析方法
H2O2浓度采用钛盐光度法进行测试[16-17]。含量检测时采用 NBT作为捕获剂,采用分光光度计测试,反应产物甲臜在600 nm附近具有较宽的吸收峰[18-19]。检测 NO 及 O2浓度时,先将NO+N2模拟气体直接通入MRU中,记录初始浓度;然后将模拟气体通入装有一定浓度 H2O2溶液的双层玻璃反应器内,待NO浓度稳定后,通过注射器向H2O2溶液中注入预先配置好的FeSO4溶液, NO的氧化反应开始进行,采用MRU在线检测反应过程中NO及O2的浓度变化。
2 结果与讨论
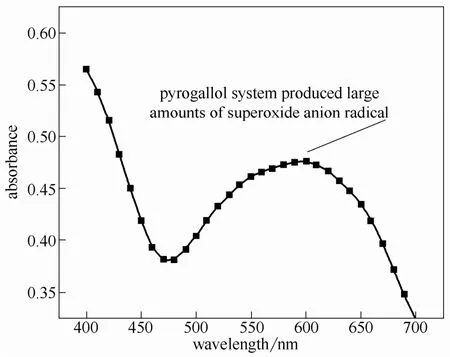
图2 联苯三酚溶液中·检测Fig.2 Detection of · in pyrogallol solution
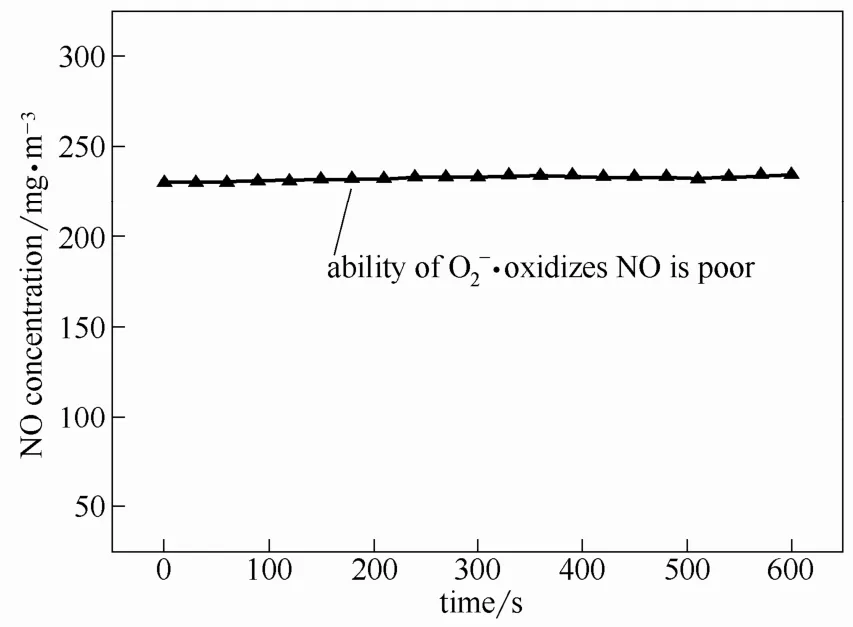
图3 ·对NO的氧化作用Fig.3 oxidize NO gas experimental result
2.2 Fe2+/H2O2体系 ·浓度检测
为进一步佐证Fe2+/H2O2体系中·在NO气体氧化过程中的作用,对Fe2+/H2O2体系反应15 min过程中的·累计浓度进行了分光光度检测。反应条件:[H2O2]0=30 mmol·L−1,[Fe2+]0=5 mmol·L−1,[NBT]0:[H2O2]0=1:1,反应温度40℃。分光光度测试结果如图4所示。可见,在不同稀释倍数条件下,Fe2+/H2O2体系反应15 min内均未检测到明显的甲臜吸收峰,同时试管内也没有明显蓝色沉淀物出现,可以确定,Fe2+/H2O2体系分解过程中·的生成速率极慢,·的浓度很低。
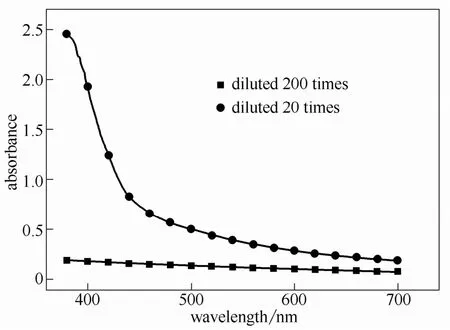
图4 Fe2+/H2O2体系 O−2·浓度检测Fig.4 Detection of O−2· in Fe2+/H2O2 system
2.3 ·OH及HO2·在氧化NO中的作用
Fe2+/H2O2体系同时存在·OH和HO2·两种自由基[22],如反应式(1)、式(2)所示,已有文献证明了·OH和HO2·对NO气体具有氧化作用。然而两种自由基在NO气体氧化过程中谁的作用更大尚不明确。

图5显示的是Fe2+/H2O2体系对NO的氧化作用,H2O2溶液初始浓度为300 mmol·L−1。前面已经证明·对 NO 气体的氧化作用很弱,因此,NO的氧化效果主要来自于·OH、HO2·两种自由基。随着溶液温度升高以及Fe2+初始浓度的增大,体系对NO的氧化能力增强,这是因为体系的分解速率随温度升高及催化剂浓度增大而加快,自由基生成速率的加快促进了体系对NO气体氧化能力的提升。

图5 Fe2+/H2O2体系对NO的氧化作用Fig.5 Fe2+/H2O2 system oxidize NO gas experimental result

图6 DMSO对体系氧化NO作用的影响Fig.6 Influence of DMSO on NO oxidation
为进一步确定此过程中·OH与 HO2·各自发挥怎样的作用,向相同溶液体系内添加过量·OH捕获剂DMSO,将·OH全部捕获,通过考察DMSO对体系氧化NO的影响来反映·OH及HO2·的作用。H2O2溶液初始浓度为 300 mmol·L−1,Fe2+初始浓度为5 mmol·L−1,溶液温度为60℃。DMSO对体系氧化NO作用的影响如图6所示,添加DMSO后,NO气体浓度变化量减小,体系对NO气体的氧化能力变弱。这说明·OH对NO具有较强氧化能力,当·OH被捕获后,体系对NO的氧化能力下降。但·OH被捕获后,体系仍表现出一定的NO氧化能力,说明HO2·对NO气体同样具有氧化能力。
为分别表征·OH及HO2·对NO氧化作用的大小,在此引入NO氧化脱除量与H2O2消耗量的比值n(NO)/n(H2O2)来反映体系氧化能力。结果表明,未添加DMSO时,10 min内Fe2+/H2O2体系氧化NO 1.5×10−2mmol, H2O2消 耗 量 为 196.5 mmol,n(NO)/n(H2O2)=7.63×10−5;相同工况添加DMSO后,10 min 内 Fe2+/H2O2体系氧化 NO 7.6×10−3mmol,H2O2消耗量为 300 mmol,n(NO)/n(H2O2)=2.53×10−5。可见当·OH 被捕获后n(NO)/n(H2O2)下降 66.8%。故可确定,虽·OH及 HO2·均具有氧化NO的能力,但·OH在此过程中的作用更大。
2.4 ·OH及HO2·在O2生成中的作用
由2.3节可知,NO气体的氧化量远低于H2O2实际消耗量,H2O2主要通过生成 O2的方式而无效消耗,H2O2消耗量与O2生成量的摩尔比为2/1(图7)。为确定·OH及HO2·在O2生成中的作用,本次实验对Fe2+/H2O2体系氧化NO过程中的O2生成情况进行了在线检测。
图8显示的是Fe2+/H2O2体系分解过程中O2生成速率测试结果。可知,随着溶液温度升高,自由基生成速率加快,体系内O2生成速率同时加快,而O2的生成代表了 H2O2的无效分解。结合前面分析结果,自由基生成速率越快,体系的氧化能力越强,但体系的无效分解越严重。添加 DMSO后,H2O2分解过程中未检测到O2的生成,可以断定O2的生成过程一定有·OH参与。由于在Fe2+/H2O2体系内可能产生O2的反应中,·OH与HO2·之间的反应速率常数最大[23],因此反应式(3)是O2生成的主要路径。但 Fe2+/H2O2体系无效分解路径还有待于进一步研究。
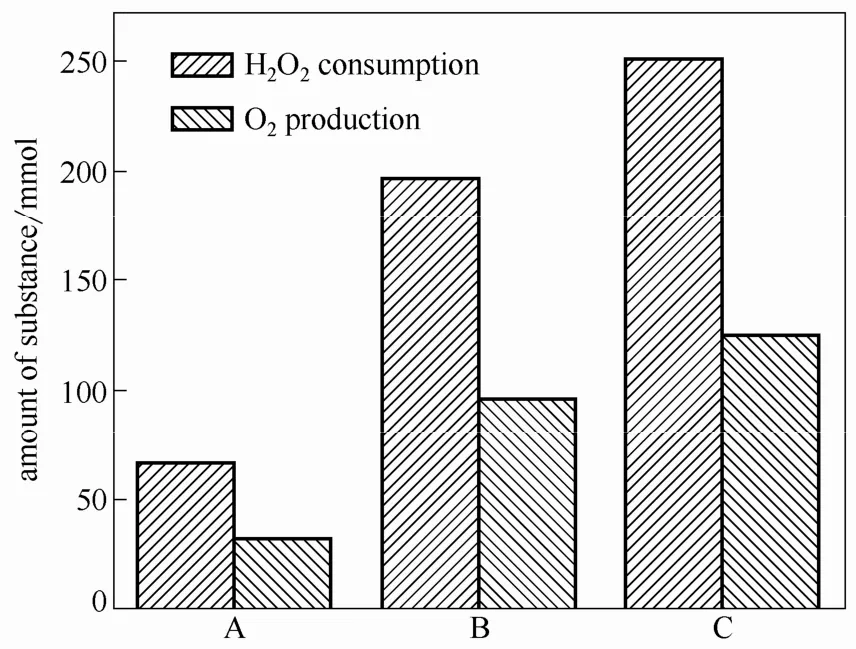
图7 O2生成量与H2O2消耗量的关系Fig.7 Relationship between amount of O2 production andH2O2 consumption

图8 H2O2分解过程中O2生成速率Fig.8 O2 generation rate in H2O2 decomposition process

综合以上分析,Fe2+/H2O2体系分解过程中会同时产生大量·OH与HO2·,仅有极少部分自由基用于NO氧化,两种自由基主要通过快速反应式(3)而消耗,导致H2O2无效分解。要提高Fe2+/H2O2体系对NO的氧化能力及H2O2利用率,必须避免体系同时生成·OH与 HO2·。通过特定调控手段,使Fe3+快速还原为Fe2+,减弱或避免反应式(2)的发生,从而使Fe2+/H2O2体系定向生成·OH,极有可能成为保证体系高效氧化NO的手段。
3 结 论
本文采用实验方法,确定了 Fe2+/H2O2体系中O−2·、·OH和HO2·在氧化NO气体过程中的作用。得到如下结论:
(1)O−2·不是 Fe2+/H2O2体系氧化 NO 气体的主要活性物质;
(2)·OH与HO2·均对NO气体氧化起作用,但·OH发挥的作用更大;

[1]Zhang Xiaohui, Sun Shaozeng, Sun Rui, Li Xiaoli, Zeng Guang.Effects of bias combustion on volatile nitrogen transformation [J].Asia-pacific Journal of Chemical Engineering, 2010, 5(3): 473-478
[2]Barbut F, Yezli S, Otter J A. Activity in vitro of hydrogen peroxide vapour against clostridium difficile spores [J].Journal of Hospital Infection, 2012, 80: 85-87
[3]Christopherk Duesterberg, Stevene Mylon, David Waite T. pH effects on iron-catalyzed oxidation using Fenton’s reagent [J].Environ. Sci.Technol., 2008, 42: 8522-8527
[4]Huang Guang, Wang Junhua, Dong Fengchun, Jia Yongtang.Application of activators for hydrogen peroxide bleaching at low temperature//2nd International Conference on Electronic &Mechanical Engineering and Information Technology[C]. Atlantis Press, 2012
[5]Liu Yangxian(刘杨先), Pan Jianfeng(潘剑锋), Liu Yong(刘勇).Mass transfer-reaction kinetics for NO removal by process of UV/H2O2oxidation and CaO absorption [J].CIESC Journal(化工学报), 2013,64(3): 1062-1068
[6]Cooper C D, Clausen Ⅲ C A, Pettey L, Collins M, Pozo de Fernandez M. Investigation of ultraviolet light-enhanced H2O2oxidation of NOxemissions [J].Journal of Environmental Engineering, 2002, 128(1): 68-72
[7]Hyun Ha Kim, Kazuhiko Tsunoda, Shinji Katsura. A novel plasma reactor for NO control using photocatalyst and hydrogen peroxide injection [J].Industry Application, 1999, 35(6): 1306-1310
[8]Collins M M, Cooper C D, Dietz J D, Clausen Ⅲ C A, Tazi L M.Pilot-scale evaluation of H2O2injection to control NOxemissions [J].Journal of Environmental Engineering, 2001, 127(4): 329-336
[9]Piyavadee Limvoranusorn, David Cooper C, John D Dietz, Christian A Clausen, Lucas Pettey. Kinetic modeling of the gas-phase oxidation of nitric oxide using hydrogen peroxide [J].Journal of Environmental Engineering, 2005, 131:518-525
[10]Zhu Xian(朱贤), Zhou Yuegui(周月桂), Liu Yaobin(柳瑶斌), Peng Jun(彭军), Zhang Mingchuan(章明川).Experimental investigation on the flue gas desulfurization and denitrification of Ca(OH)2humidified by hydrogen peroxide solution [J].Boiler Technology(锅炉技术),2010, 41(6): 75-78
[11]Yang Liu(杨柳), Wang Hongsheng(王洪升), Liao Weiping(廖伟平).Simultaneous desulfurization and denitrification from flue gas of power plant by H2O2[J].Power Engineering(动力工程学报), 2011,31(9): 689-692
[12]Liu Yangxian(刘杨先), Zhang Jun(张军), Wang Zhuliang(王助良).Simultaneous desulfurization and denitrification by using combination of UV/H2O2oxidation with Ca(OH)2absorption [J].CIESC Journal(化工学报), 2012, 63(10): 3277-3283
[13]Walling C. Fenton’s reagent revisited [J].Accounts of Chemical Research, 1975, 8(4): 125-131
[14]Mark Merchant, Ross Hardy, Stetson Williams. Quantitative detection of superoxide ions in whole blood of the American alligator [J].Spectroscopy Letters,2008, 41: 199-203
[15]Babbs C F, Griffin D W. Scatchard analysis of methane sulfinic acid production from dimethyl sulfoxide: A method to quantify hydroxyl radical formation in physiologic systems [J].Free Radical Biology and Medicine, 1989, 6(5): 493-503
[16]Jiang Chengchun(姜成春), Pang Sunyan(庞素艳), Ma Jun(马军), Xie Weiping(谢炜平), Zou Yuan(邹原). Spectrophotometric determination of hydrogen peroxide in Fenton reaction with titanium oxalate [J].China Water &Wastewater(中国给水排水),2006, 22(4):88-91
[17]Sun Chu(孙楚), Li Shaofeng(李绍峰), Craig Williams, Tao Huchun(陶虎春). Spectrophotometric determination of hydrogen peroxide in O3/H2O2advanced oxidation system with titanium oxalate[J].Chemical Engineer(化学工程师), 2011, 189(6): 27-37
[18]Liu Ruiheng(刘瑞恒), Fu Shiyu(付时雨), Zhan Huaiyu(詹怀宇).Spectrophotometric determination of superoxide anion radical with nitroblue tetrazolium [J].Journal of Instrumental Analysis(分析测试学报), 2008, 27(4): 355-359
[19]Mark Merchant, Ross Hardy, Stetson Williams. Quantitative detection of superoxide ions in whole blood of the American alligator (alligator mississippiensis)[J].Spectroscopy Letters, 2008, 41: 199-203
[20]Huie R E, Padmaja S. The reaction of NO with superoxide [J].Free Radical Research, 1993, 18(4): 195-199
[21]Yusuf G Adewuyi, Md A Khan, Nana Y Sakyi. Kinetics and modeling of the removal of nitric oxide by aqueous sodium persulfate simultaneously activated by temperature and Fe2+[J].Industrial &Engineering Chemistry Research, 2014, 53: 828-839
[22]Pignatello J J. Dark and photoassisted iron(3+)-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide [J].Environmental Science & Technology, 1992, 26(5): 944-951
[23]De Laat J, Gallard H. Catalytic decomposition of hydrogen peroxide by Fe(Ⅲ)in homogeneous aqueous solution: Mechanism and kinetic modeling [J].Environmental Science & Technology, 1999, 33(16):2726-2732
