热活化过硫酸盐降解水中卡马西平
2015-06-19邓靖冯善方马晓雁邵益生高乃云李军
邓靖,冯善方,马晓雁,邵益生,高乃云,李军
(1浙江工业大学建筑工程学院,浙江 杭州 310014;2同济大学环境科学与工程学院,上海 200092;3中国城市规划设计研究院,北京 100037)
引 言
作为一种新兴污染物,药物活性化合物(pharmaceutically active compounds,PhACs)对水环境的污染受到人们广泛的关注。在众多 PhACs中,卡马西平(carbamazepine,CBZ)是一种二苯并氮卓衍生物,用于治疗癫痫、抑郁症、舌咽神经痛、三叉神经痛、中枢性部分尿崩症。由于其药效显著,常作为治疗癫痫病和神经痛的首选药物被大量使用。据报道,全球CBZ的年均消耗量高达1014 t[1]。由于传统的生物处理工艺对CBZ的去除效果有限(低于10%)[2],因此,CBZ在被部分去除的同时,也在源源不断地进入水体,对生态系统和人体健康构成长期潜在的危害。目前,除了在世界各地的地表水和地下水中检测到CBZ的存在[3],在饮用水中也能检测到高浓度的CBZ(最高浓度达到6.30 μg·L−1)[4]。CBZ被认为是不同水体中检测频率最高的药物残留[2],也是目前众多学者最为关注的PhACs之一。
高级氧化工艺(advanced oxidation processes,AOPs)被认为是一种去除废水中许多有毒和难生物降解有机污染物的有效替代技术。传统的高级氧化技术,如Fenton法、UV/H2O2和UV/TiO2等均是以产生强氧化性的羟基自由基(·OH)为主要活性基团来降解污染物的。近些年来,基于硫酸自由基(·)的高级氧化技术受到了广泛的关注。与·OH相比,·不仅在中性条件下具有更高的标准还原电位(E⊖=2.5~3.1 V)[5],而且在酸性条件下对目标污染物具有更强的选择性[6]。此外,·具有更长的半衰期(4 s,·OH的半衰期为1 μs),延长了与目标污染物的持续接触时间,从而能够更高程度地矿化水中的有机污染物[7]。·可以通过多种方式活化过硫酸盐(persulfate,PS)产生,如紫外光解[8]、热分解[9]和过渡金属催化分解[10]等。
Rao等[11]发现 Fe2+/PS工艺能够以二阶段动力学的形式有效地降解水中的CBZ。但是,与Fenton法相同,Fe2+/PS工艺受反应液pH的影响较大。在酸性条件下(pH=3),CBZ的降解效果最好,而在中性和碱性条件下,降解效率大为降低。Deng等[12]则研究发现,UV/PS工艺对CBZ的去除效果远强于UV/H2O2工艺,且 UV/PS工艺在接近中性条件下(pH=5)能够得到最佳的去除效果。与紫外活化方法相似,热活化过硫酸盐(thermally activated persulfate,TAP)技术同样具有氧化性强、反应条件温和、受pH影响小等优点,已经被广泛地应用于土壤及地下水中有机污染物的去除[13]。
综上所述,本文以CBZ为目标污染物,建立了TAP技术降解 CBZ的动力学模型,并通过确定可能的降解产物研究了 CBZ的降解规律和机理。此外,本文还考察了 PS初始浓度、温度和零价铁投加量对TAP降解CBZ的影响,以期对TAP技术应用于工程实际提供一定的理论依据和技术支持。
1 材料与方法
1.1 实验材料及方法
CBZ(纯度>99%)购自百灵威科技有限公司,乙腈(HPLC级)购自Sigma-Aldrich公司。实验中所用的其他药品(包括过硫酸钠、乙醇、碘化钾和零价铁等)均购自上海国药集团化学试剂有限公司。实验中所用的溶液均采用 Milli-Q超纯水配制。恒温水浴装置(DHJF-2005)购自郑州长城科工贸易有限公司。
热活化反应在40 ml棕色硼硅酸盐玻璃瓶中进行,以避免 PS光照分解的影响。玻璃管中依次加入浓度为 0.04 mmol·L−1(9.45 mg·L−1)的 CBZ和浓度为1 mmol·L−1的PS,待溶液混合均匀后放入恒温水浴装置,同时开始计时,分别在反应进行至 10、20、30、40、50、60、80、100 和 120 min时取样1 ml,并加入100 μl乙醇淬灭反应。
1.2 分析方法
CBZ浓度采用超高效液相色谱仪(UPLC,Waters 2010)测定。使用 Symmetry C18 柱(4.6 mm×250 mm,5 μm,Waters)。流动相采用乙腈:水=60:40,检测波长286 nm,流速1 ml·min−1,柱温35℃。PS浓度的测定采用Liang等[14]提出的快速分光光度法。TOC采用TOC-L(岛津公司,日本)进行测定。溶液pH采用雷磁PHS-3G型pH计进行测定。
采用高效液相色谱(Waters 2010)串联质谱(Thermo Scientific TSQ Quantum Access MAX)(LC-MS/MS)对CBZ的降解产物进行定性分析。HPLC的分析条件:色谱柱为C18毛细管柱(100×2.1 mm i.d., 5 μm, Thermo),流动相为A(乙腈)和B(含 0.1%甲酸溶液),采用梯度洗脱模式,流动相梯度条件为:初始条件为90%A:10%B,从5~30 min内B增加到70%,保持10 min后,在10 min内返回到初始条件。流动相流速为 0.24 ml·min−1,柱温35℃,检测时间50 min,进样体积10 μl。质谱的分析条件:采用全扫模式(Scan mode)对卡马西平的降解产物进行监测分析,质谱电离源为加热电喷雾电离正源(ESI+)。采用二级碰撞解离模式(CID),载气为高纯氮气(> 99%),碰撞气为氩气(99.999%),电喷雾电压:4000 V,鞘气压力:40.0 Arb,毛细管温度:270℃,碰撞温度:300℃,缺省Tube Lens值。
2 结果与讨论
2.1 反应动力学

这些中间活性基团能够不同程度地与 CBZ发生反应,使反应动力学变得较为复杂,但是可用拟一级反应动力学常数kapp来描述反应的表观速率,它代表了与 CBZ反应的多种活性基团的综合作用结果,kapp可以通过各种活性基团的二级动力学关系得到

式中,k"表示CBZ与活性基团的二级反应动力学常数,其中k"other为其他活性基团的二级反应动力学常数。根据上述反应速率常数可知,其他活性基团占有的比例较小,可以忽略。而在室温下 PS并不能氧化CBZ,说明PS的氧化速率也可以忽略。在 TAP系统中,和·OH的比例会随着系统的反应条件如温度和pH等而变化,其具体数值不能确定,因此,可以将式(11)简化为
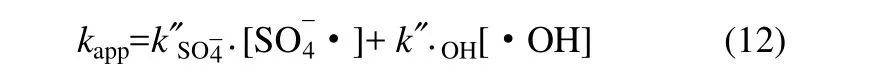
根据上述反应动力学模型,实验考察了在不同温度(50、60和70℃)下,向体积为200 ml的反应液中分别投加不同浓度的 PS,降解初始浓度为40 μmol·L−1的CBZ,控制反应液pH在5.10±0.08,得到的拟一级反应动力学常数kapp随PS浓度的变化情况如图1所示。
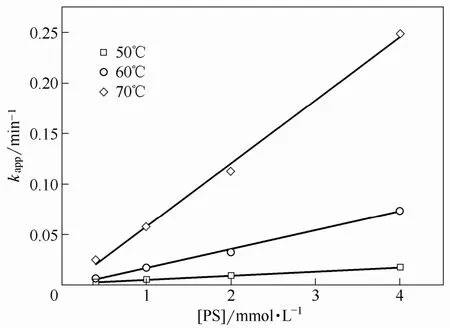
图1 不同温度下PS浓度与拟一级动力学常数kapp的线性关系Fig.1 Linear relation of PS concentrations and pseudo-first-order kinetic constant kapp under different temperatures
如图所示,随着PS初始浓度的升高,CBZ的降解速率提高,并呈现较好的线性相关性,且反应速率随着系统温度的升高而增大,表明反应速率受系统温度及 PS初始浓度的共同影响,即在该反应体系中,PS的直接氧化并不显著,存在少量的·,随着 PS 初始浓度的升高,生成的·浓度增加,从而加快了CBZ的降解。这与Liang等[22]在使用 TAP降解三氯乙烯和三氯乙烷时得到的结论是一致的。在一定温度下,在TAP系统中产生活性基团(·或者·OH)与其浓度具有固定的比例关系,即拟二级动力学常数k",使得式(12)可以转化为式(13)。不同PS初始浓度与拟一级反应动力学常数在不同温度下的拟合线性相关参数如表1所示。

表1 不同温度下拟一级动力学常数kapp与PS初始浓度的线性相关关系Table 1 Linear correlation of pseudo-first-order kinetic constant kapp and PS concentrations under differenttemperatures
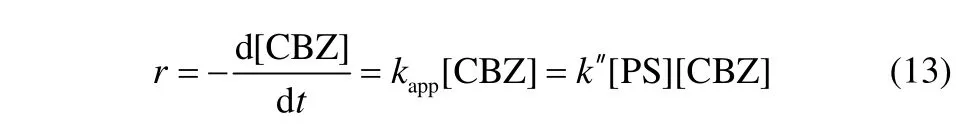
如表1所示,CBZ的降解速率常数受到PS初始浓度和系统温度的双重影响,在较低的温度下,PS初始浓度与拟一级动力学常数kapp的线性拟合系数R2值较低,表明 TAP技术生成的 SO−4·浓度较不稳定,在反应体系中并没有占主导地位,随着温度的升高,R2值逐渐升高,即在较高的温度下,单位浓度 PS产生的自由基浓度逐渐增多,且生成速率较为稳定。因此,温度对TAP降解CBZ具有显著影响。
2.2 TAP降解CBZ
如前所述,在TAP系统中,温度是一个重要的参数,它决定了 PS活化的程度。为了深入考察温度对TAP降解CBZ的影响,选择在40~70℃的温度范围内进行实验,结果见图 2。如图所示,TAP技术能够有效地去除水中的CBZ,不同温度下CBZ的降解符合准一级反应动力学。随着温度的升高,CBZ的降解速率显著提高。当温度从 40℃升高至70℃时,CBZ的降解速率常数由0.001 min−1提高至0.0566 min−1,升高了近60倍。当温度较低时,系统中产生的较少,CBZ的降解效果并不明显;随着温度升高,系统中将产生更多的·,从而导致CBZ更快地降解。Liang等[22]在采用TAP去除1,1,1-三氯乙烯时也观察到相同的现象。另一方面,反应系统温度升高对活性基团与 CBZ之间的二级反应速率常数也会产生一定的影响[22]。不同温度下CBZ降解的准一级反应动力学模型的拟合参数如表2所示。

图2 温度对TAP降解CBZ的影响Fig. 2 Effect of temperature on CBZ degradation by TAP oxidation([CBZ]0=40 μmol·L−1;[PS]0=1 mmol·L−1;T=40—70℃;without pH adjustment)

表2 不同温度下CBZ降解的拟一级动力学模型的拟合参数Table 2 CBZ degradation parameters of pseudo-first-order kinetic model under different temperatures
由表2可以看出,虽然随着反应温度的升高,CBZ的降解速率显著提高,但是TOC去除率增加并不明显。在40℃时,反应4 h后溶液TOC值基本不发生变化;而当温度升高至 70℃时,虽然 CBZ在80 min内就能够被基本完全去除,但是在该温度下反应4 h后溶液TOC仅仅减少了15%左右。实验结果表明,TAP技术对 CBZ的矿化效果较差,仅能够将CBZ氧化为不同分子结构的中间产物,氧化并不彻底。如果需要提高系统对CBZ的矿化效果,还需要采取其他的工艺加以强化。
此外,由图2中的插图可知,lnkapp与1/T表现出良好的线性关系且符合 Arrhenius方程(R2=0.9978)。Arrhenius方程可表示为

其中,kapp是速率常数,min−1;A是Arrhenius常数,kJ·mol−1;Ea是活化能,kJ·mol−1;R是气体常数,8.314 J·mol·K−1;T是反应的热力学温度,K。
其线性关系式可以表示为

通过计算,Arrhenius常数A为(39.4±0.9)kJ·mol−1,反应活化能Ea为(120.4±2.6)kJ·mol−1。表3给出了TAP降解不同有机污染物的反应活化能及其相应的实验条件。从表中可以看出,采用TAP降解药物IBU和BIS,计算得到的反应活化能分别为(168±9.5)kJ·mol−1和(119.8±10.8)kJ·mol−1。这说明TAP技术对CBZ和BIS具有相近的降解能力,而相比于前两种药物,IBU则更加难以被氧化。
图3表示在不同温度下,TAP氧化CBZ的过程中PS浓度的变化情况。如图所示,在TAP氧化CBZ的过程中,PS的消耗随着温度的升高而增加。在每个反应温度,PS的浓度随着CBZ氧化的进行而逐渐降低。在40、50、60和70℃下,经过120 min反应后 PS的消耗量分别为 28.94%±3.97%、39.29%±1.94% 、 62.68%±4.95% 和 85.94%±2.50%。这说明CBZ的降解与反应系统中活性基团的数量存在正相关的关系,随着 PS的不断消耗,反应系统中活性基团的数量不断增加,从而导致CBZ降解速率的提高。

表3 TAP降解有机污染物的反应活化能及其相应的实验条件Table 3 Activation energy of some organic pollutants and corresponding experimental conditions
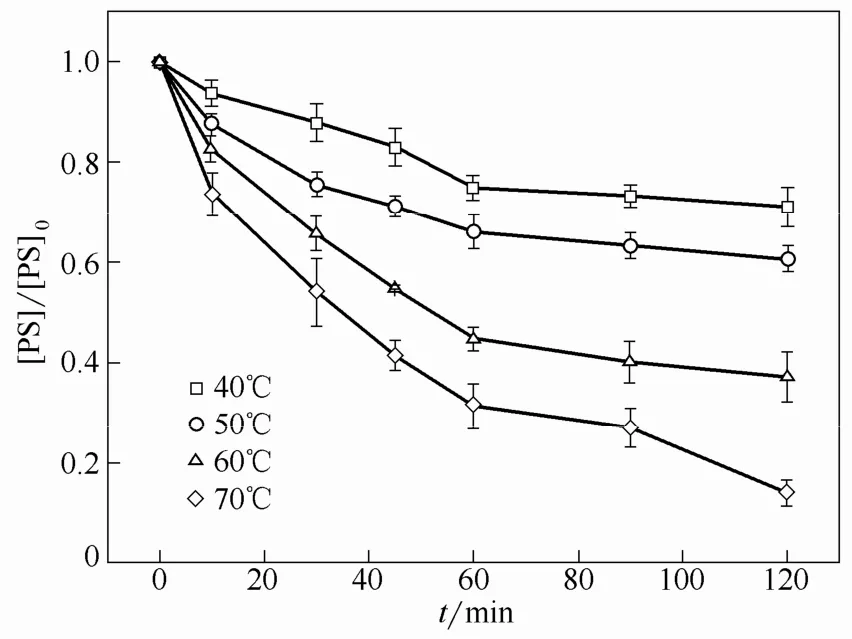
图3 不同温度下TAP氧化CBZ的过程中PS浓度的变化趋势Fig 3 Variation trends of PS concentrations during CBZ oxidation by TAP under different temperatures
2.3 零价铁投加量的影响
虽然Fe2+能够有效地活化PS产生·,但是投加过多的Fe2+会与系统中的·反应,从而降低系统的氧化效率[28]。而Fe0可以作为水体中Fe2+的缓慢释放源,有效地提高系统的氧化效率。本实验通过向初始浓度40 μmol·L−1的CBZ溶液中投加一定质量的Fe0,使其质量浓度分别为0.02、0.05、0.1和0.2 g·L−1,实验温度保持在60℃,观察CBZ降解速率的变化,并且与空白实验进行对照,实验结果见图4。
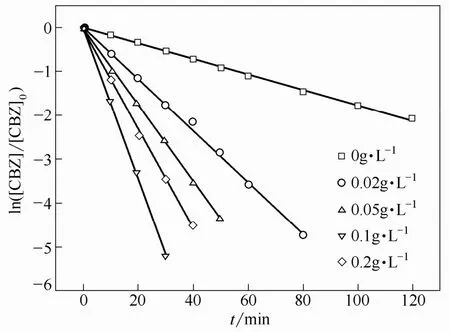
图4 Fe0投加量对TAP降解CBZ的影响Fig.4 Effect of Fe0 dosage on CBZ degradation by TAP oxidation
如图所示,Fe0能够显著地提高 TAP系统对CBZ的降解速率。当Fe0投加量为0.1 g·L−1时,CBZ的降解速率为0.1739 min−1,相比空白系统,CBZ的降解速率提高了近10倍。当Fe0投入到水中,它能够缓慢地释放出Fe2+,而Fe2+能够活化PS产生·,增加系统中·的数量,从而提高 CBZ的降解速率。反应系统中的Fe2+可能源于以下几个方面:由于反应液呈弱酸性,Fe0在酸性条件下被腐蚀而产生;通过相似于类芬顿系统中的哈伯-韦斯反应,电子直接从Fe0转移到PS而产生[29];水中Fe0在有氧或者无氧条件下发生腐蚀而产生,Fe0(标准还原电位为−0.44 V)可以充当还原剂,从而诱发PS(标准还原电位为+2.01 V)的分解[30]。而反应系统中生成的 Fe3+又能够与 Fe0继续反应产生Fe2+,形成反应循环,直至系统中 Fe0耗尽。高温条件无疑会加速上述反应的进行。此外,当 Fe0的投加量从0.02 g·L−1增加至0.1 g·L−1时,CBZ的反应速率逐渐提高;而当Fe0的投加量继续增加至0.2 g·L−1时,CBZ的反应速率却出现降低。这是因为当Fe0的投加量过大时,系统中产生的过量Fe2+能够淬灭·,从而降低CBZ的降解速率[31]。

图5 不同PS投加量下TAP系统对CBZ的矿化度Fig. 5 Mineralization of CBZ using TAP oxidation under different PS dosages([CBZ]0=40 μmol·L−1;[PS]0=1—20 mmol·L−1;T=60℃;[Fe0]=0.1 g·L−1;without pH adjustment)
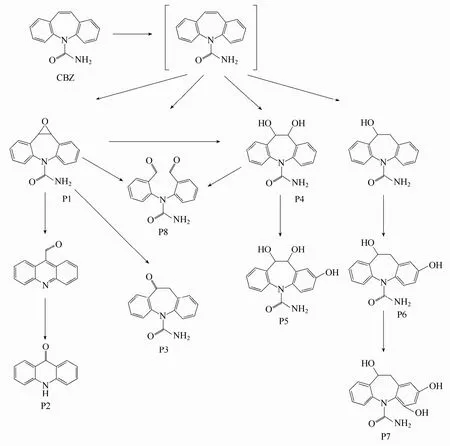
图6 TAP氧化CBZ可能的转化路径Fig. 6 Proposed CBZ transformation pathways in TAP oxidation system
如前所述,虽然 TAP系统能够有效地去除CBZ,但是 CBZ的矿化度很低,60℃时仅为5.74%±1.33%。实验通过增大PS的投加量和投加Fe0的方法来提高系统对CBZ矿化度。图5显示了不同PS投加量下TAP系统对CBZ的矿化情况。
如图所示,随着PS投加量的增加,CBZ的矿化度相应提高。当 PS的初始浓度为 1 mmol·L−1时,反应4 h CBZ的矿化度仅为5.83%;而当PS的初始浓度提高至20 mmol·L−1时,反应4 h CBZ的矿化度提高至95.34%。除此之外,当PS初始浓度较低(2 mmol·L−1)时,加入少量的Fe0同样可以获得较好的矿化度,反应4 h CBZ的矿化度可以达到88.00%。
2.4 降解产物及路径
根据 LC-MS/MS分析结果和相关文献报道给出了CBZ降解中间产物的结构和可能的降解路径,在 TAP系统中,CBZ的可能转化路径和降解产物的相关信息分别见图6和表4。从表4可以看出,TAP氧化CBZ检测到8种中间产物,主要是羟基化卡马西平、环氧卡马西平、吡啶类醛和酮等。

表4 LC-MS/MS检出的TAP氧化卡马西平的中间产物Table 4 Intermediates detected by LC-MS/MS during CBZ degradation in TAP system
羟基化易发生在前沿电子密度(frontie electron density,FED)较高的位置[32]。因此,CBZ分子结构中氮杂卓环的烯烃双键最易于受到·的攻击。而·能够以不同的方式与烯烃双键反生反应[33]。首先,·能够攻击烯烃双键形成中间产物P1(10,11-10,11-环氧卡马西平),它首先由Doll等在UV光解CBZ时发现,是相关文献中检出最为频繁的中间产物之一[34]。通过不稳定中间产物的简易环收缩作用,中间产物 P1的环氧键能够开环,从而形成了中间产物吖啶-9-甲醛。Kosjek等[35]在使用ClO2氧化CBZ时也发现了吖啶-9-甲醛。吖啶-9-甲醛能够被进一步氧化形成中间产物 P2(吖啶酮)。采用光降解CBZ,同样发现了吖啶酮存在于降解产物中[36]。吖啶-9-甲醛进一步通过坎尼扎罗反应(Cannizzaro reaction)转化为9-吖啶羧酸[35]。此外,10,11-10,11-环氧卡马西平还能够被·氧化生成中间产物P3[33]。
3 结 论
(1)在TAP系统中,CBZ的降解受到PS初始浓度和系统温度的双重影响。
(2)TAP技术对 CBZ具有良好的去除效果,CBZ的降解符合拟一级反应动力学。随着反应温度的升高,PS的分解速率提高,从而导致CBZ降解速率提高。
(3)Fe0能够显著地提高CBZ的降解速率及矿化度,最佳投加量为0.05 g·L−1,相应的降解速率为 0.1681 min−1。
[1]Calisto V, Domingues M R M, Erny G L,et al. Direct photodegradation of carbamazepine followed by micellar electrokinetic chromatography and mass spectrometry [J].Water Research, 2011, 45: 1095-1104
[2]Zhang Y, Geiben S W, Gal C. Carbamazepine and diclofenac:removal in wastewater treatment plants and occurrence in water bodies [J].Chemosphere, 2008, 73: 1151-1161
[3]Appavoo I A, Hu J Y, Huang Y,et al. Response surface modeling of carbamazepine (CBZ)removal by graphene-P25 nanocomposites/UVA process using central composite design [J].Water Research,2014, 57: 270-279
[4]Mcdowell D C, Huber M M, Wagner M,et al. Ozonation of carbamazepine in drinking water: identification and kinetic study of major oxidation products [J].Environmental Science & Technology,2005, 39(20): 8014-8022
[5]Guan Y H, Ma J, Li X C,et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J].Environmental Science & Technology, 2011, 45(21):9308-9314
[6]Anoniou M G, De La Cruz A A, Dionysiou D D. Degradation of microcystin-LR using sulfate radicals generated through photolysis,thermolysis and e-transfer mechanisms [J].Applied Catalysis B:Environmental, 2010, 96(3-4): 290-298
[7]Shukla P, Wang S B, Singh K,et al. Cobalt exchanged zeolites for heterogeneous catalytic oxidation of phenol in the presence of peroxymonosulphate [J].Applied Catalysis B:Environmental, 2010,99(1-2): 163-169
[8]Chen Xiaochang(陈晓畅), Wang Weiping(王卫平), Zhu Fengxiang(朱凤香). Study on the degradation of AO7 by UV/K2S2O8system: kinetics and pathways [J].Environmental Science, 2010,31(7): 1533-1537
[9]Tan C Q, Gao N Y, Deng Y,et al. Heat-activated persulfate oxidation of diuron in water [J].Chemical Engineering Journal, 2012, 203(1):294-300
[10]Anipsitakis G P, Dionysiou D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt [J].Environmental Science & Technololgy, 2003, 37(20): 4790-4797
[11]Rao Y F, Qu L, Yang H S,et al. Degradation of carbamazepine by Fe(II)-activated process [J].Journal of Hazardous Materials, 2014,268: 23-32
[12]Deng J, Shao Y S, Gao N Y,et al. Degradation of the antiepileptic drug carbamazepine upon different UV-based advanced oxidation processes in water [J].Chemical Engineering Journal, 2013, 222:150-158
[13]Yang Zhaorong(杨照荣), Cui Changzheng(崔长征), Li Bingzhi(李炳智),et al. Degradation of carbamazepine and oxcarbazepine by heat-activated persulfate [J].Acta Scientiae Circumstantiae, 2013,33(1): 98-104
[14]Liang C J, Huang C F, Mohanty N,et al. A rapid spectrophotometric determination of persulfate anion in ISCO [J].Chemosphere, 2008,73(9): 1540-1543

[16]Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J].Journal of Physical and Chemical,1988, 17(3): 1027-1284
[17]Buxton G V, Greenstock C L, Helman W P,et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O−)in aqueous solution [J].Journal of Physical and Chemical Reference Data, 1998, 17(2): 513-886
[18]Klaning U K, Sehested K, Appelman E H. Laser flash photolysis and pulse radiolysis of aqueous solutions of the fluoroxysulfate ion,SO4F−[J].Inorganic Chemistry, 1991, 30(18): 3582-3584
[19]Maruthamuthu P, Neta P. Radiolytic chain decomposition of peroxomonophosphoric and peroxomonosulfuric acids [J].Journal of Physical Chemistry, 1977, 81(10): 937-940
[20]Huie R E, Clifton C L, Alstein N. A pluse radiolysis and flash photolysis study of the radicals SO2-,SO3-,SO4-, and SO5-[J].International Journal of Radiation Application Instrumentation,Part C,Radiation Physics and Chemistry, 1989, 33(4): 361-370
[21]Liang C J, Huang S C. Kinetic model for sulfate/hydroxyl radical oxidation of methylene blue in a thermally-activated persulfate system at various pH and temperatures [J].Sustainable Environment Research, 2012, 22(4): 199-208
[22]Liang C J, Bruell C, Marley M C,et al. Thermally activated persulfate oxidation of trichloroethylene (TCE)and 1,1,1-trichloroethane (TCA)in aqueous systems and soil slurries [J].Soil & Sediment Contamination, 2003, 12(2): 207-228
[23]Huang K C, Couttenye R A, Hoag G E. Kinetics of heat-assisted persulfate oxidation of methyltert-butyl ether (MTBE)[J].Chemosphere, 2002, 49(4): 413-420
[24]Ghauch A, Tuqan A M, Kibbi N. Ibuprofen removal by heated persulfate in aqueous solution: A kinetics study [J].Chemical Engineering Jouranl, 2012, 197(15): 483-492
[25]Ghauch A, Tuqan A M. Oxidation of bisoprolol in heated persulfate/H2O systems: Kinetics and products [J].Chemical Engineering Journal, 2012, 183(5): 162-171
[26]Gu X G, Lu S G, Li L,et al. Oxidation of 1,1,1-trichloroethane stimulated by thermally activated persulfate [J].Industrial &Engineering Chemistry Research, 2011, 50(19): 11029-11036
[27]Waldemer R H, Tratnyek P G, Johnson R L,et al. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products [J].Environmental Science & Technology, 2007, 41(3):1010-1015
[28]Liang C J, Bruell C J, Marley M C,et al. Persulfate oxidant forin situremediation of TCE(Ⅰ)∶ Activation by ferrous ion with and without a persulfate-thiosulfate redox couple [J].Chemosphere, 2004, 55(9):1213-1223
[29]Zhao J Y, Zhang Y B, Quan X,et al. Enhanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxydisulfate at ambient temperature [J].Separation and Purification Technology, 2010, 71(3): 302-307
[30]Zhou T, Li Y Z, Ji J,et al. Oxidation of 4-chlorophenol in a heterogeneous zero valent iron/H2O2Fenton-like system: Kinetic,pathway and effect factors [J].Separation and Purification Technology, 2008, 62(3): 551-558
[31]House D A. Kinetics and mechanism of oxidations by peroxydisulfate[J].Chemical Review, 1962, 62(3): 185-200
[32]Hubner U, Seiwert B, Reemtsma T,et al. Ozonation products of carbamazepine and their removal from secondary effluents by soil aquifer treatment – Indications from column experiments [J].Water Research, 2014, 49: 34-43
[33]Rao Y F, Chu W, Wang Y R. Photocatalytic oxidation of carbamazepine in triclinic-WO3suspension: Role of alcohol and sulfate radicals in the degradation pathway [J].Applied Catalysis A:General, 2013, 468: 240-249
[34]Doll T E, Frimmel F H. Removal of selected persistent organic pollutants by heterogeneous photocatalysis in water [J].Catalysis Today, 2005, 101(3/4): 195-202
[35]Kosjek T, Andersen H R, Kompare B,et al. Fate of carbamazepine during water treatment [J].Environmental Science & Technology,2009, 43(16): 6256-6261
[36]Chiron S, Minero C, Vione D,et al.Photodegradation processes of the antiepileptic drug carbamazepine, relevant to estuarine waters [J].Environmental Science & Technology, 2006, 40(19): 5977-5983
