谈初中教师在“溶液浓度的表示”教学中易忽视的几个问题
2015-06-18田长明
田长明
摘要:在“溶液浓度的表示”的教学过程中,初中教师常常只注重质量分数的计算和一定溶质质量分数溶液的配制,对一些看似不起眼的问题常常忽视。本文就学生的知识盲区、测量过程中的精确度、配制溶液时的操作细节和仪器的误差等几个问题展开阐述,希望能引起初中化学教师的关注。
关键词:质量分数;溶液的配制;知识盲区;化学教学
文章编号:1005–6629(2015)4–0040–03 中图分类号:G633.8 文献标识码:B
初中化学课程标准(2013版)对“溶液浓度的表示”一节的要求是“能进行溶质质量分数的简单计算,能配制一定溶质质量分数的溶液”。教师基本能围绕这一要求展开教学,但在教学过程中,对一些看起来不太起眼的问题常常忽视,笔者列举以下几点:
1 重视情境创设,忽视学生知识的盲区
“学起于思,思源于疑”,思维总是在一定的问题情境中产生的,通过情境,提出问题,使教学信息具有新奇性,从而使学生产生好奇心和求知欲,极大地激发了学生探究动机和兴趣,有利于培养学生创新所需要的思维素质和探究能力。但我们在创设问题情境的时候,对学生的知识盲区不能视而不见。
案例1 如图1所示为市售的浓盐酸的相关信息,实验室要利用该浓盐酸配制50g质量分数为5%的稀盐酸,需要浓盐酸多少毫升?水多少毫升?
教师利用浓盐酸试剂瓶上标签的部分内容设置问题情境,这是一个很好的想法,但我们有些老师对问题的分析,只是局限于这道题怎么作答,对情境中一些学生的知识盲点则轻易放过,例如该题情境中的“化学纯”就是学生的知识盲区。初中学生对物质分类的认识还比较浅显,学生不知道化学纯和纯净物的概念区别,化学纯是否就是纯净物?如果不是纯净物,那化学纯又代表什么?
学生可以通过标签上的“含HCl 37%”,分析出化学纯不是纯净物,但化学纯是什么?教师应该给学生提供资料卡。
通过资料卡,学生对药品按纯度分类的知识有所了解,对物质分类的认识会更加深刻。
2 重视计算方法,忽视精确程度的思考
自然科学的研究就是实验、测量并对测量结果进行分析、认识的过程,测量是化学实验的重要手段之一,而精确度和有效数字是测量的重要基础内容。但初中教师在教学中通常重视计算的方法,对于计算过程中数据的精确度和有效数字问题通常是忽略的。
案例2 你能计算A、B、C三杯糖水的质量分数吗?
答:A杯糖水的质量分数为5.6%
计算的过程好像没有问题,但笔者觉得这是一道伪命题。一勺糖的质量约3g,一杯水的体积约200mL,看图2A中的水的体积约是杯体积的二分之一,三个关键参数都是一个大约的数值,如何求溶质的质量分数?计算的结果居然可以精确到5.6%,真是有点不可思议。
案例3 t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体。下列相关叙述正确的是( )
A.升高温度上层清液变为不饱和溶液
B. t℃时,熟石灰的溶解度为0.3g
C.烧杯中溶液的质量小于50.15g
D.上层清液中溶质质量分数大于0.3%
教师分析:这道题的正确选项是“C”,因为氢氧化钙没有完全溶解,所以上层清液是饱和溶液,在该温度下的溶解度小于0.3g。

答案没有问题,教师的分析过程也没有问题,笔者疑惑的是试题的数据。熟石灰是0.15g,水是50g,熟石灰的溶解度为0.3g,质量分别精确到0.01g、1g、0.1g,同一试题,质量有3种精度,显然是不合适的。我们在使用天平时,必须考虑天平分度值的选择,其依据是称量结果精确度的要求,一方面要防止用精度不够的天平来称量,以免准确度不符合要求,另一方面也要防止滥用过高精度的天平来称量,以免造成浪费。另外应该注意的是同一实验应使用同一台天平和砝码。
3 重视配制流程,忽视实验操作的细节
一定质量分数的溶液的配制通常有两种途径,一种是一定质量固体溶于一定体积的溶剂中,一种途径是浓溶液的稀释。配制的流程可用以下示意图表示: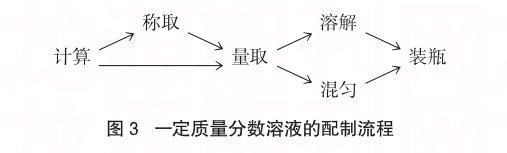
教师在教学过程中往往重视实验的流程,对操作过程的细节问题没有引起高度的关注,致使学生在操作时出现诸多不规范的地方。以配制50g 10%的氯化钠溶液为例:
称取过程中的细节:用托盘天平称取一定量氯化钠固体,学生操作过程中突出的问题表现在两方面,一是在托盘上加药品。当药品很少量时,不会用右手轻拍拿药匙手的手腕来填足药量;二是药品过量的处理。当在托盘上添加的药品过量时,学生习惯性的用药匙将多余药品放回原试剂瓶。
溶解过程中的细节:学生会将量筒量取的40mL蒸馏水一下子全部倒入小烧杯中进行溶解,溶解后装瓶。而不是先倒入部分蒸馏水进行溶解,将溶解后的食盐水倒入试剂瓶里,然后用剩余的蒸馏水洗涤小烧杯2~3次,将洗涤液也倒入试剂瓶,塞紧试剂瓶塞,将溶液混合均匀。
4 重视理论分析,忽视实验仪器的误差
在定量分析中,由于受分析方法、测量仪器和分析工作者主观条件等方面的限制,使测量的结果不可能和真实含量完全一致,客观上存在着难以避免的误差。误差又分系统误差和偶然误差,其中系统误差是由分析过程中某些确定的、经常性的因素引起的,主要包括:仪器误差、方法误差、试剂误差、操作误差等。系统误差可以通过校正的方法予以减小或消除;偶然误差又称随机误差,偶然误差是由一些随机因素引起的,大小和正负都难以预测,且不可以被校正[1]。
在教学过程中,对所配溶液进行误差分析也是教学中一个重要内容,但笔者认为不是所有的分析都具有价值。
案例4 要配制50g 20%的KNO3溶液,需要量取水的体积 ▲ mL。若其他操作都正确,在用量筒量取水时,仰视读数,则所配制的溶液溶质质量分数将 ▲ 。(填“偏大”,“偏小”,“不变”)
教师分析:溶质质量=溶液质量×溶质的质量分数,配制50g 20%的KNO3溶液,需KNO3的质量=50g×20%=10g;溶剂质量=溶液质量-溶质质量,则所需蒸馏水的质量=50g-10g=40g;水的密度为1 g·mL-1,则需要量取水的体积为40mL。用量筒量取水的体积时,仰视读数,读数比实际偏小,则会导致所量取水的实际体积大于所量的值,即所量取的水的实际体积偏大,溶剂的质量偏大,故所得溶液的质量分数偏小。
教师的分析似乎很有道理,但初中教材中一定质量分数溶液的配制只是粗略的配制,因此对仪器的精度要求不是很高,如称量固体用的是托盘天平,量取液体用的是量筒。量筒本身就存在着较大的误差,如50mL量筒的误差是±1mL,为了研究量筒的实验误差,笔者做了如下实验:
课题:配制50g 10%的氯化钠溶液
实验:用电子天平称5.00g氯化钠,再用50mL的量筒量取45mL的水,将两者在烧杯中混合(不用玻璃棒搅拌),用电子天平称混合后的总质量(去皮),记录数据。重复实验3次。
再选用另外2只50mL的量筒,重复上述实验。实验数据如表1~3所示。
通过上述实验数据可知,有些量筒是正误差,有些量筒是负误差。因此仰视和俯视造成的误差和量筒本身的误差综合在一起,究竟溶质的质量分数是偏大还是偏小就不能确定了。笔者认为量筒读数时,仰视和俯视,读数偏大还是偏小是可以讨论的,但对于粗配一定质量分数的溶液,这样的误差分析没有什么实际的意义。
教学是自由的,但教学又是严谨的。初中教师如何在把握教学重点的同时,对我们一些常忽视的问题也要引起高度的关注。
参考文献:
[1]华中师范大学等.分析化学(上册第三版)[M].北京:高等教育出版社,2002:42~43.
