“摩尔”概念难点成因及化解策略
2015-06-18龙琪
摘要:“摩尔”概念作为中学化学教学难点的主要表现有:学生易混淆相关概念,化学史上“摩尔”概念的发展历程波折而漫长;该概念刚被引进我国时也曾难倒很多老师;与“摩尔”相关的误解广泛存在。其难点成因主要来自于三个方面:概念本身、学生的学习基础以及教师的教学方法。基于这些原因分析,本文从教学设计和教材编写两个方面给出了难点化解策略。
关键词:摩尔;物质的量;阿伏伽德罗常数;教学难点
文章编号:1005–6629(2015)4–0032–06 中图分类号:G633.8 文献标识码:B
如果对中学化学里的所有概念进行排序,不管是以其在知识体系中的重要性为标准,还是以学习难度为标准,或是以教学难度为标准,再或是以科研关注度为标准,“摩尔”及其相关概念都会名列前茅。至今这一选题依然在热议中,笔者对这一教学难题的认识也在逐渐深入。
1 “摩尔”成为难点知识的表现形式
“摩尔”概念成为难点知识有很多表现形式。首先,学生易混淆相关概念,将“摩尔”等同于“物质的量”、“质量”、“阿伏伽德罗常数”、“微粒个数”、“气体分子数”,甚至认为“摩尔”是分子的性质。
其次,从化学史的角度来看,“摩尔”这一概念的明确界定和统一认识的历程波折而漫长。“摩尔”的最初定义与现在的内涵是不一样的。1900年,俄德化学家奥斯特瓦尔德(Osrwald,Friedrich Wilhelm,1853~1932)首次提出“摩尔(mole)”这个名称,他把“摩尔”定义为以克为单位的质量[1],而不是微观粒子的计数单位。在当时,奥斯特瓦尔德根本不可能把“摩尔”定义为微观粒子的计数单位。因为他反对道尔顿和阿伏伽德罗提出的原子分子学说,阿伏伽德罗用“molecule”一词表示分子,意为“small mass”,而奥斯特瓦尔德偏偏选用“mole”一词,意为“big mass”[2]。这说明,即使是化学家,他们对微观世界的认识、理解和接受也是有一定难度的。此外,“摩尔(mole)”这一名称诞生于1900年,其对应的物理量-“物质的量(amount of substance)”于1961年才诞生[3]。也就是说,“摩尔”这一物理量单位的出现早于其表示的物理量“物质的量”。这种先有单位后有物理量的现象在科学界比较少见。直至1971年,在第十四届称量与测量大会(14th General Conference on Weights and Measures)上,科学界才正式定义“摩尔”、“物质的量”和“阿伏伽德罗常数”,将“摩尔”纳入国际单位制体系,作为七个SI基本单位之一。可见,经历了大半个世纪,科学界才明确和统一了“摩尔”这一概念的内涵和名称。然而,即使有了明确定义,在1971年后的相当长时间内,科学界对“摩尔”一词的使用仍然存在争议,有的科学家还继续使用“当量(equivalent weight)”这一古老名称[4]。
再其次,“摩尔”概念在我国高中化学中刚被引入的时候,也曾难倒了很多老师。继国务院60号文件[1977]规定在我国推行SI制后,高一课本就引入了“摩尔”这一新单位,废除了过去采用的克分子、克原子、克离子、克分子体积等旧单位。1980年前后,摩尔概念及其应用在国内仍然很不统一[5]。那段时间关于如何理解“摩尔”、“物质的量”概念的介绍性、商榷类的文章比较多。这种现象说明很多教师当时也很难理解和掌握“摩尔”概念。如今三十多年过去了,关于“摩尔”及“物质的量”问题的探讨还在继续,但是关注焦点已经由如何理解概念转移到如何讲授概念上来。
最后,与“摩尔”相关的误解广泛存在,比如误以为“阿伏伽德罗常数”的提出者和测量者是阿伏伽德罗本人(Avogadro,Amedeo,1776~1856)。这样的错误在土耳其的一本中学科学教材上曾出现过[6]。再比如,有很多学生误以为“摩尔”是一位化学家。还有,我们熟知的百度百科上也有科学性问题,在对“克分子”的介绍中,有这么一句描述“化学物质的量就是摩尔”[7],这个错误十分明显。
2 “摩尔”成为学习难点的原因分析
“摩尔”成为学习难点至少有三个方面的原因:概念本身的原因;学生的原因;教师的原因。
2.1概念本身的原因
2.1.1与“摩尔”相关的知识与技能不仅多,而且难
与“摩尔”学习相关的知识与技能有很多。其前序知识有原子、分子、质量、相对原子质量、相对分子质量、碳-12原子、H2、H2SO4等具体的物质概念、物理量及其单位、国际单位制的SI基本单位、常数、宏观与微观等。并序知识有物质的量、阿伏伽德罗常数;后续知识有摩尔质量、气体摩尔体积及标准状况、摩尔浓度、阿伏伽德罗定律等。
化学技能方面,化学式、化学方程式的书写与计算不仅是“摩尔”概念的学习基础,而且是深入理解概念的重要手段和有效途径。以“摩尔”为核心的计算又是这部分的学习重点和学习难点,公式很多,对计算能力的要求很高。很多教师都发现,学生对“摩尔”概念的掌握最终还是通过大量做题来实现的,计算能力不强的学生很难学好这部分内容。
可见,与“摩尔”相关的概念与知识都十分抽象,其概念本身就难以理解,具有较大的学习难度。加上它们在“摩尔”学习过程中又密集出现,就会产生叠加效应。可以说,“摩尔”概念的学习难度很大程度上来自于这些相关知识和技能的难度。
2.1.2 “摩尔”概念的不合常理之处
“摩尔”概念除了在内涵意义上较难理解以外,它还有很多不合常理之处,让人不可思议。
首先,“阿伏伽德罗常数”的提出和测量者不是阿伏伽德罗本人。最先提出“阿伏伽德罗常数”这一名称的是法国科学家佩兰(Jean Baptiste Perrin,1870~1942)。1908年,他将通常情况下1克分子(即1摩尔)气体中所含有的分子数定义为阿伏伽德罗常数[8]。最早对阿伏伽德罗常数测量有贡献的科学家是奥地利化学家洛喜密脱(Joseph Loschmidt,1821~1895)以及匈牙利化学家泰安(Karoly Than,1834~1908)[9]。1865年,洛喜密脱估算出,在通常情况下1立方厘米气体中所含有的分子数为1.83×1018;1889年,泰安测出通常情况下,1克分子(即1摩尔)气体所占的体积为22330立方厘米。于是,最早的阿伏伽德罗常数的值是1.83×1018×22330=4.09×1022。化学史上,人们把阿伏伽德罗常数的测量归功于洛喜密脱和泰安[10]。
可见,阿伏伽德罗常数的提出和测量都是阿伏伽德罗去世以后的事情,与他本人没有直接关系。人们以他的名字命名这个数主要源自两个原因:(1)阿伏伽德罗提出了分子假说,这为阿伏伽德罗常数的测定奠定了理论基础;(2)阿伏伽德罗于1811年提出分子假说,但由于学术权威的反对以及其他原因,该理论被埋没了近半个世纪,直至1860年的首届卡尔斯鲁厄国际化学会议,在他的同胞康尼查罗的大力宣传下,他的分子假说才被学术界接受和认可。这一年阿伏伽德罗已经离世。后人为了纪念这位科学家,将“阿伏伽德罗常数”以他的名字命名。
其次,在科学上,很多物理量单位的名称都采用科学家的名字来命名,以示纪念。然而当年奥斯特瓦尔德选用“摩尔”一词的用意是为了反对原子分子论,与科学家的姓名无关。但巧合的是,“摩尔”一词在西方国家确实也是一种人名,这就容易使学生产生误解,常常有学生把“摩尔”作为外号来称呼自己的化学老师。
再次,从单位换算的角度来看,“摩尔”与“个”这一单位换算的数值不仅不是整数,而且是一个大得让学生无法想象的数字——6.02×1023。这个数值从何而来很难跟学生解释清楚。其准确值至今科学家还在研究。
最后,单位物理量通常是可以观察到的。比如1克有多重,1毫升有多少,1米有多长,1秒有多快等,学生都可以感知到。但是1摩尔是多少?学生只能通过质量或者体积来间接地感知,并且同为1摩尔的物质,可能在质量上和外观上差距甚远。也就是说,1摩尔这个单位很难给学生一致性的直观量化的感性认识。
2.2 学生方面的原因
2.2.1 学习基础不牢
前文已述,“摩尔”概念的学习要建立在很多化学概念和化学技能之上。这些相关概念和技能本身就比较抽象,看不见摸不着,学生的学习基础不是很牢固。再从时间上看,这些概念的学习一般在九年级上学期的前半段完成,等到学习“摩尔”的时候,已有约一年的时间过去了,这些相关概念可能已经变得模糊不清。
2.2.2 语言理解能力不够
教材上对“摩尔”的定义是“1摩尔粒子集体所含的粒子数与0.012kg 12C中所含的原子数相同”。第十四届称量与测量大会上给出的定义是“The mole is the amount of substance of a system which contains as many elementary entities as there are atoms in 0.012 kilogram of carbon-12[11]”。可见,教材上的“摩尔”定义源自学术定义的翻译。这样的定义在文字表述上十分严谨,学术性很强,但读起来却很拗口,阅读能力不强的学生很难读懂这句话。即使读懂了句子,但由于对相关背景知识的要求较高,学生也很难真正理解这个定义的丰富内涵。
2.2.3 认知发展水平不够
国外有研究者根据皮亚杰的认知发展理论认为,学生学不好“摩尔”这一概念,既不是教师的原因,也不是学生不努力,而是他们的认知水平还没有发展到形式运算阶段[12]。皮亚杰把儿童的认知发展分成四个阶段:(1)感知运动阶段:0~2岁,靠感觉获取经验。(2)前运算阶段:2~7岁,能使用语言及符号等表征外在事物,具有推理能力但不符逻辑,主要是直接推理。(3)具体运算阶段:7~11岁,能使用具体物体的操作来协助思考。(4)形式运算阶段:11~16岁,开始会类推,有逻辑思维和抽象思维。
“摩尔”是一个将质量、体积等宏观物理量与原子数分子数等微观世界联系起来的概念,对抽象思维的要求较高。认知发展水平仍处于具体运算阶段的学生很难将宏观与微观联系起来。
2.3 教师方面的原因
教材上直译“摩尔”定义的做法给教学带来了困难。严谨的学术化语言以及英语和汉语这两种语言习惯上的差异,使得对这种定义的理解要求与学生的实际水平之间存在较大差距。教师在进行“摩尔”概念教学时,如果认识不到学生学习的难点在哪里,或者教师本人对有关概念的理解不深刻,就会机械地照搬教材上的定义和顺序给学生讲解,难以产生好的教学效果。
比如教材上最为关键的内容是这三句话:“摩尔是物质的量的单位”,“1摩尔物质含有阿伏伽德罗常数个微粒”,“1摩尔粒子集体所含的粒子数与0.012kg 12C中所含的原子数相同”。有调查显示[13],关于“物质的量”,学生感觉它不像物理量的专有名词,而像生活用语,其意义和内涵教材上也没有解释清楚,只讲是宏观与微观的桥梁,他们不理解是什么意思。“阿伏伽德罗常数”也难以理解,不知道为什么选用这个数值。可见,“物质的量”、“阿伏伽德罗常数”的学习难度不亚于“摩尔”,将“摩尔”的讲解建立在这两个概念之上,无异于空中楼阁。因此,前两句话对于学生来讲其实是没有意义的。
第三句话是“摩尔”的定义,除了前文所述的句子拗口以外,还有一些化学背景知识需要给学生解释清楚。首先是“粒子集体”,不仅要强调是原子、分子、电子、离子之类的微粒,还要有各种类型的例子使其具体化。其次,在没有学过同位素概念的前提下,碳-12原子对学生来讲也十分陌生。因此,第三句话不宜在“摩尔”概念学习的开始阶段出现,而要放在学生初步形成“摩尔”概念以后,在深化理解阶段再引入上述定义。
“摩尔”概念教学中,教材上的顺序一般是先介绍“物质的量”,然后介绍“摩尔”。绝大部分的教师也是按照这个顺序进行教学,并且从国际基本单位制引出“物质的量”。这种普遍流行的导入方法其实是不科学的。很多学生在学习“摩尔”之前并不知道国际单位制体系及七个SI基本单位,反倒是学了“摩尔”以后才知道的。教育心理学告诉我们,教学的起点是学生已经知道了什么。这种从学生不知道的知识来引出新知识的做法有悖于教学规律。调查也证实了这一点[14],学生认为列出国际规定的七大物理量和单位引出“物质的量”和“摩尔”,对他们的学习没有多大帮助。因为有的物理量和单位他们根本不熟悉,即使是熟悉的“质量”和“时间”,他们也搞不清楚定义。真正对他们有帮助的还是做题,通过大量练习,他们逐渐明白了“物质的量”这一宏观与微观的桥梁作用。
3 “摩尔”概念的教学设计
基于以上的难点成因分析,笔者认为,“摩尔”概念的教学首先要打破教材上的固有顺序(如图2所示),采用新的讲解顺序(如图3所示)。
重点介绍“摩尔”,淡化“物质的量”,回避或者延后“阿伏伽德罗常数”。具体的教学思路是:表示微观粒子数量多少的单位“个”→表示微观粒子数量多少的单位摩尔(mol)→1mol某种微粒集合体中所含的微粒数与0.012kg 12C中所含的原子数(NA)相同,其近似值为6.02×1023,即1摩尔≈6.02×1023个(微观粒子)→表示微粒集合体中所含的微粒数多少的物理量就是物质的量(n)→微粒个数(N)与物质的量的转换关系n=N/NA→辨析相关概念。
上述教学设计思路是基于学生容易理解的“个”数以及他们熟悉的单位换算,将“摩尔”概念嫁接在学生已知已会的知识与技能之上,从而化解了“摩尔”的学习难度。当学生建立起“摩尔”的概念以后,再将“物质的量”概念建立在“摩尔”概念之上。
回避或者延后介绍“阿伏伽德罗常数”可以简化与“摩尔”相关的知识与概念,调整后的前序知识有原子、分子、质量、H2、H2SO4等具体的物质概念、物理量及其单位。并序知识有物质的量;后续知识有摩尔质量、气体摩尔体积及标准状况、摩尔浓度、阿伏伽德罗定律、阿伏伽德罗常数等。这样处理不仅不会降低教学要求,而且可以避免很多不必要的学习疑问,有利于学生对“摩尔”相关内容的理解和应用[15]。
具体到课堂教学,可以做如表1所示的教学设计。
4 教材编写上的化解策略
很多一线教师的教学依据就是化学教材,为了便于教师们实施上述教学设计,中学化学教材中关于“摩尔”相关内容的编写是否可以做如下调整。
4.1 增加前序知识的复习内容
在正文之前的引言部分,或者在导学栏目中,增加以下前序知识的复习内容:原子、分子、质量、相对原子质量、相对分子质量、碳-12原子、H2、H2SO4等具体的物质概念、物理量及其单位。
4.2 调整“摩尔”、“物质的量”、“阿伏伽德罗常数”的顺序和比重
重点介绍“摩尔”,淡化“物质的量”,回避或者延后“阿伏伽德罗常数”。关于这一观点,已有论文专述[16],在此不再赘述。此外,建议在章节标题上,要显示“摩尔”。鲁科版教材的题目比较明确:“化学中常用的物理量-物质的量”,人教版教材的题目也比较明确:“物质的量单位-摩尔”。如果将这两个题目综合起来就更明确了:“物质的量及其单位摩尔”。阿伏伽德罗常数可以一带而过,或者放在阿伏伽德罗定律部分一起介绍。
4.3 增加化学史内容
历史的视角是人们认识事物的重要方面。化学史内容提供了化学知识和概念发展的具体情境。“摩尔”及其相关概念的提出和发展有很多令人费解之处,这些反常多是由于历史原因造成的。给学生呈现那段历史,有助于学生理解概念发展的来龙去脉。化学史的内容像故事一样,学生也会比较感兴趣,从而增加化学这门学科的人文情怀。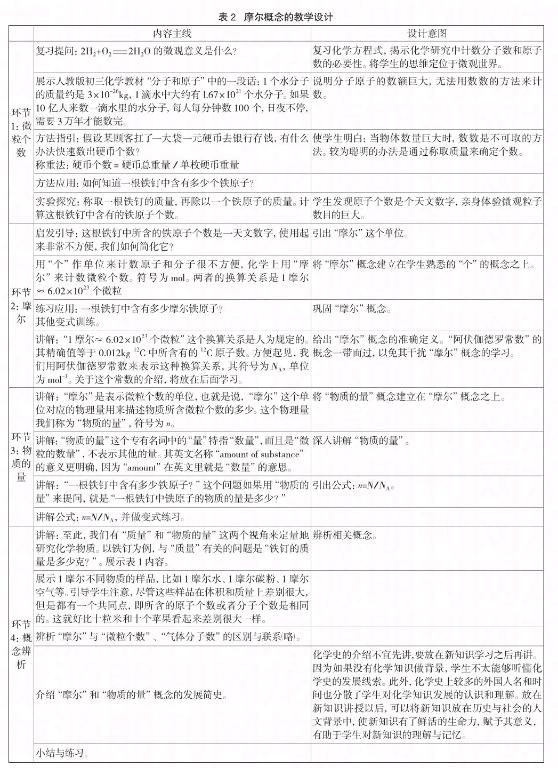
参考文献:
[1] Ostwald, W. The principles of Inorganic chemistry[M]. London: Macmillan and Co.Limited,1902:156.
[2][3] CarloS. Furió, RafaeL. Azcona, Jenaro Guisasola & Mary Ratcliffe. Difficulties in teaching the concepts of‘amount of substanceand‘mole[J]. International Journal of Science Education,2000,Vol. 22,(12):1285~1304.
[4] Kira Padilla, Carles Furio-Mas. The Importance of History and Philosophy of Science in Correcting Distorted Views of‘Amount of Substanceand‘MoleConcepts in Chemistry Teaching [J]. Science & Education,2008,(17):403~424.
[5]刘立寿.关于摩尔的概念及其应用的意见——兼与有关同志商榷[J].化学教育,1980,(3):45~47.
[6] Aleaddinoglu, G., Ozbakan, M., Ozkan, I., Ozkar, S., Gurbuz, A., Yilmaz, M.C., et al.: Fen Bilimleri 2 (Science 2)[M]. Istanbul: Ogretmen El Kitabi. Milli Egitim Basimevi,1995:123.
[7]百度文库.克分子[DB/OL]. http://baike.baidu. com/view/114721.htm?fr=aladdin,2014-11-7.
[8][10] Mustafa Sarikaya. A view about the short histories of the mole and Avogadros number [J]. Found Chemistry,2013,(15):79~91.
[9] William B. Jensen. How and When Did Avogadros Name become Associated with Avogadros Number? [J]. Journal of Chemical Education,2007,84(2):223.
[11] Mills, I. M., C Vitas, T., Homann, K., Kallay, N. and Kuchitsu, K. IUPAC, Quantities, units and symbols in physical chemistry [M]. Oxford:Blackwell,1993:70.
[12] Goodstein, M. & Howe, A. The use of concrete methods in secondary chemistry instruction [J]. Journal of Research in Science Teaching,1978,(15):361~366.
[13][14]钟志健.“物质的量”教学难度成因剖析[J].化学教学,2014,(10):8~12.
[15][16]龙琪,马春生.化解“摩尔”学习难点的教材修订建议[J].化学教育,2012,(11):7~10.
