两种用FITC标记红桂木凝集素方法的比较*
2015-06-15廖烈君尹利君曾麒燕
廖烈君 尹利君 曾麒燕
(广西医科大学生物化学与分子生物学教研室,广西 南宁 530021)
论 著
两种用FITC标记红桂木凝集素方法的比较*
廖烈君 尹利君 曾麒燕△
(广西医科大学生物化学与分子生物学教研室,广西 南宁 530021)
目的:红桂木凝集素(Artocarpus lingnanensis lectin,ALL)与异硫氰酸荧光素(FITC)偶联方法的探究。方法:分别采用透析法和固化法使FITC与红桂木凝集素偶联,检测偶联物的F/P值。结果:固相化法的F/P值达1.02,其它方法F/P值约为0.758。结论:采用固化法使FITC标记红桂木凝集素,实验重复性较好,方法稳定可靠,且可获得较高偶联率的红桂木凝集素偶联异硫氰酸荧光素(ALL-FITC)利于后续实验研究。
FITC;凝集素;透析;浓缩
凝集素是一类能与糖类特异性结合并能使细胞凝集的蛋白质或糖蛋白[1-2]。它能与糖专一地、非共价地可逆结合,并具有凝集细胞和沉淀聚糖或糖复合物的作用,而细胞表面糖链物在细胞癌变、浸润和转移中都起着重要作用[3-4]。因此近年来,凝集素渐渐成为研究细胞生物膜表面性质变化的重要探针。为更好的开展红桂木凝集素(Artocarpus lingnanensis lectin,ALL)作为分子探针的研究和进一步研究红桂木凝集素受体在肿瘤细胞上的分布情况,需要建立用荧光素标记红桂木凝集素的方法。凝集素与异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)结合的方法文献报道中主要有透析法和固化法,且结合物的F/P值有较大的不同[5]。目前还未有FITC标记ALL的相关报道,本实验将对透析法和固化法用FITC标记红桂木凝集素的效果进行探索研究。
1 材料与方法
1.1 仪器与试剂
纯化的ALL,为本课题组制备;FITC(F7250,美国Sigma公司);透析袋(分子量10000)(美国Sigma公司);半乳糖(美国Sigma公司);Sepharose 4B(美国Pharmacia公司);DAPI(瑞士罗氏公司);BCA蛋白试剂盒(中国碧云天公司);其余试剂均为国产分析纯。DAPI班氏试剂(无水硫酸铜1.47g,溶于100 ml热水中,冷却后稀释到150 ml,取柠檬酸钠173 g,无水碳酸钠100 g和600 ml水共热,溶后冷却定容850 ml,再与150 ml硫酸铜混匀即可);PBS(pH7.2)缓冲液(自配)。激光共聚焦显微镜尼康NIKONA1。
1.2 方法
1.2.1 透析法制备FITC-ALL
1.2.1.1 交联
将5 mg红桂木凝集素冻干粉溶于5 ml的0.15 mol·L-1磷酸二氢钠,pH9.0溶液,称取100 μgFITC,在4℃条件下缓慢加入上述溶液中,混合均匀,置于摇床上避光4℃反应20 h。
1.2.1.2 纯化偶联物
将偶联物FITC-ALL在PBS缓冲液中充分透析,至透析液由黄绿色变透明清亮为止,透析过程4℃避光。偶联物置于4℃避光保存。
1.2.1.3 偶联物F/P值测定
测定偶联物FITC-ALL的A495查FITC标准曲线得其FITC的浓度,用BCA蛋白试剂盒做标准曲线测定ALL的浓度,代入以下公式:
1.2.2 固化法制备FITC-ALL
1.2.2.1 ALL固相化-亲和吸附
称取红桂木凝集素30 mg溶于5 mlPBS中,BCA蛋白试剂盒做标准曲线,计算出该溶液中蛋白质浓度及蛋白质总量,加30 mlSepharose4B(预先经PBS浸泡)混匀,置于4℃冰箱过夜。次日,吸取上清液,用少量PBS洗Sepharose4B 3次;合并各次上清液,BCA蛋白试剂盒做标准曲线,计算上清液中蛋白质含量,代入下列公式,得到红桂木凝集素吸附率为82%。
1.2.2.2 ALL与FITC结合
称取FITC 500 μg,溶于PBS 1 ml,逐滴加入ALL-Sepharose4B中,混匀,轻摇20 min避光4℃放置6 h。然后装入层析柱,避光。柱用PBS洗,直至洗出液无明显荧光为止。再改用0.2 mol·L-1Gal 0.01 mol·L-1PBS(pH7.2)缓冲液(含0.1 mol·L-1NaCl)溶液洗脱结合于Sepharose4B上的ALL-FITC,分试管收集,合并有荧光部分的洗脱液。
1.2.2.3 纯化偶联物
将偶联物FITC-ALL在PBS缓冲液中充分透析,去除半乳糖后(用班氏试剂检测),避光4℃保存。
1.2.2.4 ALL-FITC质量鉴定
1.2.3 染色
胃癌石蜡切片置于60℃烘箱烤片1 h,二甲苯脱蜡两次各10 min,梯度酒精水化各5 min,PBS(pH7.2)缓冲液摇床震洗3次各3 min,加入FITC-ALL适量(完全覆盖组织),4℃避光静置4 h,后用PBS(pH7.2)缓冲液洗3次,每次3 min,加入0.1 ug·ml-1DAPI适量(完全覆盖组织),4℃避光静置30 min,在激光共聚焦显微镜下拍照观察。
2 结果
透析法测得F/P值为0.758,固相化法测得F/P值为1.02。在荧光标记红桂木凝集素的方法中,固相化法较第一种方法偶联效果好。但用两种方法制备的FITC-ALL染胃癌切片均得到较好的效果,见图1。
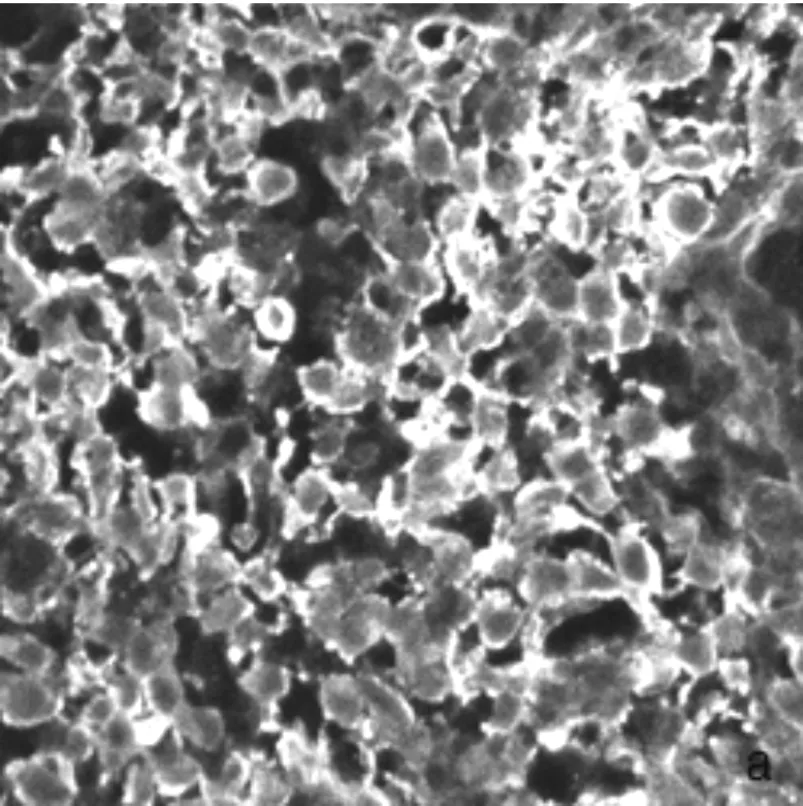
(a)固化法制备的FITC-ALL
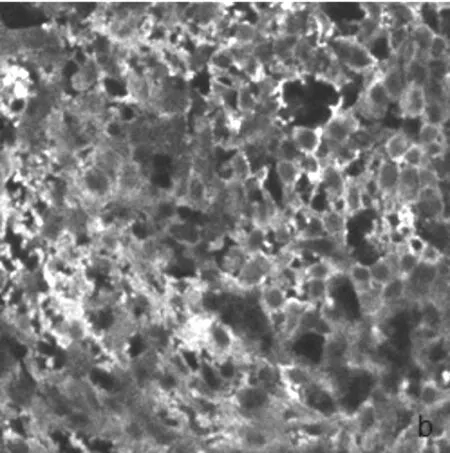
(b)透析法制备的FITC-ALL
3 讨论
凝集素是一类不同于免疫球蛋白的蛋白质或糖蛋白,在生物界中分布广泛,几乎存在于各种有机体,它们的存在调节着许多生物学过程。凝集素能与糖专一地、非共价地可逆结合,这种结合的能力与配体和受体的结合特性一致,因而就把这种能与之相应的凝集素特异性亲和的糖类称之为凝集素结合受体[6]。这类结合受体多存在于细胞膜表面和胞质,利用凝集素可与其受体特异性结合的这一特性,能够分离纯化这些细胞膜和胞浆上的糖蛋白或糖脂,并对这些糖蛋白或糖脂进行研究。由于凝集素这一特异性的识别功能,国内外的学者都非常重视利用凝集素作为探针,以区别正常组织细胞和肿瘤细胞。用标记凝集素作为探针成为了研究肿瘤细胞上能和凝集素特异性结合的蛋白或糖脂的重要手段。凝集素由于具有多价结合能力,能与酶、荧光素、生物素、胶体金、铁蛋白等结合而不影响其生物学活性,因此,凝集素可用于免疫细胞化学的研究,以及肿瘤的诊断评价等;目前最常用的方法之一就是用荧光标记,标记凝集素为研究体内各种糖基化机制和信号转导途径提供强有力的技术支持,同时了增强了研究结果的动态性[7]。
根据文献[5]本实验所用ALL提取纯化时采用的是0.01 mol·L-1PBS(pH7.2)缓冲液透析,所以透析法采用同样的PBS透析,以达到去除未结合的FITC纯化偶联物的目的,但透析法在去除未结合的FITC时并不能同时去除未反应的ALL,所以实验所需FITC的量需要绝对大于将与ALL结合的量,造成试剂的浪费。固化法的优点是使ALL亲和吸附于Sepharose4B使之固化,保护了ALL与糖反应的基团,使ALL在反应过程中保持性质稳定,不易失去活性,且ALL活性受FITC量、反应温度及时间影响小。Sepharose4B吸附ALL是有活性的分子,原料中无活性或活性低的分子及反应中失去活性的分子,均随溶液流出,达到分离的目的。固化法所制备出的偶联物F/P值达1.02,重复性好;透析法方法简便但制备的偶联物F/P值较低,且透析时不能同时去除未反应的ALL,若有ALL残留则可能使F/P值偏小,这也可能是透析法制备的偶联物F/P值较低的原因之一,所造成的实验误差较大。
凝集素由于其特异性的糖结合活性等特点,在许多生物学过程中均发挥着重要的作用[7]。传统的研究重点是对其的分离纯化以及一般性质的研究上,随着分子生物学、生物技术等方面的实验手段的发展,对凝集素的研究将着重于对其结构和功能以及如何应用于生物、医学方面。标记凝集素为这一研究方向提供了可行性,本实验作为初步的开始,还需更多的优化使荧光标记凝集素成为研究糖复合物在生理及病理条件下是如何发挥其作用的有力工具。
1 Boland CR, Chen YF, Rinderle SJ, et al. Use of the lectin from Amaranthus caudatus as a histochemical probe of proliferating colonic epithelial cells[J]. Cancer Res, 1991, 51(2):657-665.
2 Sams JS, Lynch HT, Burt RW, et al. Abnormelition of lectin histochemistry in familial polyposis coli and hereditary nonpolyposis colorectal cancer[J]. Cancer, 1990, 66(3):502-508.
3 Lotan R, Ito H, yasui W,et al. Expression of a 31-kda lactosidebinding lectin in normal human gastric mucosa and in primary and metastatic gastric carcinomas[J]. Int J Cancer, 1994, 56(4):474-480.
4 黄忠发,张淑真,蓝正文,等. 利用凝集素修饰的二氧化硅玻璃球去除胶原蛋白中的内毒素[J]. 分析化学, 2013, 41(10):1482-1486.
5 张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社, 1999.
6 Goldstein IJ, Hughes RC, Monsigny T, et al. What should be called a lectin[J]. Nature, 1980, 285:66-66.
7 鲍锦库. 植物凝集素的功能[J]. 生命科学, 2011, 23(6):533-540.
8 蔡茜茜,李巧玲,刘舒云,等. 植物凝集素研究与展望[J]. 食品科学技术学报, 2013, 31(6):51-57.
9 Strauchen JA. Lectin receptors as markers of lymphoid cells. II. Reed-Sternberg cells share lectin-binding properties of monocyte macrophages[J]. Am J Pathol, 1984, 116(3):370-376.
10 Kellokumpu IH. Differences in lectin reactivities of cellular glycoconjugates between primary human colorectal carcinomas and their metastases[J]. Cancer Res, 1986, 46(9):4620-4625.
11 邓勇,关祺芳. 红桂木,白桂木和木菠萝种子凝集素生物学性质的比较分析[J].广西医科大学学报, 1995, 12(02):183-185.
12 周德义,杨尔滨. 白桂木凝集素的纯化与性质研究[J]. 生物化学与生物物理学报(英文版), 1995, 27(01):61-66.
13 朱其芳,吴耀生. 采用白桂木凝集素-HRP测定唾液SIgA方法的建立[J]. 广西医科大学学报, 1999, 16(5):593-595.
14 王婧娉,李璐,曾麒燕. 红桂木凝集素对树突状细胞生长的影响[J]. 广西医学, 2012, 34(6):670-672.
15 崔博,曾麒燕. 红桂木凝集素对Jurkat T淋巴细胞生长的影响[J]. 广西医学, 2011, 33(04):410-413.
Comparison study of two methods labeling ALL with FITC*
Liao Lie-Jun,Yin Li-Jun,Zeng Qi-Yan△
(Department of Biochemistry and Molecular Biology, Guangxi Medical University, Guangxi Nanning 530021)
Objective:To investigate the method of labeling artocarpus lingnanensis lectin(ALL) with FITC. Methods: It was calculated separately the ratio of FITC to artocarpus lingnanensis lectin(ALL) of the FITC-labeled ALL made by dialysis method and solidification method. Results: The F/P ration of FITC-labeled ALL made by solidification method was 1.02, the F/P ration of FITC-labeled ALL made by dialysis was 0.758. Conclusions: Both of the two methods of labeling ALL with FITC were successful, the solidification method is better than dialysis method.
FITC; Lectin; Dialysis; Solidification
国家自然科学基金(编号:81160366),广西自然科学基金(桂科攻10124001A-23)
廖烈君,女,在读硕士研究生,主要从事生物化学与分子生物学方面的研究,Email:83424777@qq.com。
△通讯作者:曾麒燕,女,教授,主要从事肿瘤免疫方面的研究,Email:zqy2002422@qq.com。
2014-12-19)
