人非抗凝血块中基因组DNA提取不同方法的比较
2015-06-15邱亚青玉凤党万太周京国
邱亚,青玉凤,党万太,周京国
(1.川北医学院附属医院医学研究中心;2.川北医学院附属医院风湿免疫科,四川 南充 637000)
人非抗凝血块中基因组DNA提取不同方法的比较
邱亚1,青玉凤2,党万太2,周京国2
(1.川北医学院附属医院医学研究中心;2.川北医学院附属医院风湿免疫科,四川 南充 637000)
目的:比较三种不同方法提取人非抗凝血块基因组DNA的效果差异。方法:分别采用酚/氯仿法,天根试剂盒,Invitrigen purelinkTM试剂盒提取冻存时间较长的非抗凝血块基因组DNA,测定浓度、OD260/280值,琼脂糖凝胶电泳检测提取的DNA浓度和纯度,测定PCR产物灰度值。结果:三种方法都可以提取出基因组DNA,测定DNA浓度分别为:(35.56±15.27)ng/μL,(45.13±16.54)ng/μL,(57.93±14.5)ng/μL,组间存在统计学差异(P<0.01),A260/A280值分别为:1.46±0.19,1.49±0.16,1.519±0.23,三组间比较差异无统计学意义(P>0.05);三种方法提取的基因组DNA都能通过PCR扩增出目的条带,PCR产物电泳灰度值结果分别为:75.421±3.435,149.32±6.875和229.52±19.55,组间比较差异有统计学意义(P<0.01)。结论:三种不同方法都能提取出冻存时间较长的非抗凝血块基因组DNA,但Invitrigen purelinkTM试剂盒法效果最好。
基因组DNA;非抗凝血块;提取;比较
血液基因组DNA作为遗传信息的载体在临床检测,分子生物和遗传学等领域中具有重要地位,良好的血液基因组DNA为后续的PCR实验,多态性检测,基因重组等实验提供了优质的模板,血液基因组DNA的提取已经成为非常重要的实验手段。目前常用方法有酚/氯仿法[1],高盐沉淀法[2],固相吸附法[3],碘化物法[4,5],主要用于提取新鲜抗凝血高质量基因组DNA。但对于少数冻存时间较长的非抗凝血块标本,使用常规的方法难以提取到高纯度的基因组DNA。因此我们尝试采用几种不同的试剂盒和方法提取冻存时间超过两年的非抗凝血块基因组DNA,并比较不同方法和不同的试剂盒提取效果的差异,以期建立一种稳定而优质的提取长期冻存非抗凝血块基因组DNA的方法。
1 材料与方法
1.1 试剂材料与设备
DNA抽提试剂盒分别购自北京天根公司(0.1~1 mL血凝块基因组DNA提取试剂盒(离心柱型)、Invitrigen公司(purelinkTMGenomic DNA mini Kit(50rxn)、紫外分光光度计(biodrosis BD-2000)、BIORAD MyCycler梯度PCR仪、powerpacTMHC电泳仪、61S水平电泳槽(美国BIORAD公司)、Fusion Fx5凝胶成像系统(法国VILBER公司)、Heal Force Neofuge 15R(香港力康生物科技有限公司)。红细胞裂解液为本实验室自行配制,配方为10 mmol/L、NaCl、10 mmol/L Tris-HCl、5 mmol/L MgCl2、2×Taq PCR酶购自北京天根生物公司,PCR引物由上海生工合成,HphI限制性内切酶购自NEB公司。
1.2 实验方法
1.2.1 提取冻存血凝块标本的基因组DNA 将冻存于-80 ℃冰箱中2~4年的非抗凝全血血凝块100例置于室温下自然解冻,将重量为2 mm3(相当于全血200 μL)的血凝块剪碎成0.1 mm3体积大小碎块,加入PBS浸泡15 min,以玻璃匀浆器匀浆成糊状,行常规的酚/氯仿法抽提基因组DNA,具体操作为:吸取500 μL匀浆后的血凝块PBS混合液,加入两倍体积红细胞裂解液,混匀,冰浴10 min,4 ℃ 2 500 rpm离心10 min,弃上清,重复一次操作得到白细胞,加入白细胞裂解液(5 mmol/L NaCl,10 mmol/L EDTA,10 mmol/L Tris-HCl)400 μL,10% SDS 160 μL,蛋白酶K 20 μL,56 ℃水浴4 h,加入500 μL酚/氯仿/异戊醇,静置10 min,4 ℃ 12 000rpm离心10 min,吸取上清至另一干净EP管,加等体积氯仿混匀,静置10 min,4 ℃ 12 000rpm离心15 min。取上清至新Ep管,加1/10体积3 mol/L醋酸钠,2倍体积预冷无水乙醇冰浴3 min,4 ℃12 000 rpm离心5 min,沉淀用预冷70%乙醇洗涤控干后,加入50 μL TE液溶解沉淀。
与前述同样的方法剪碎血凝块,加入1 mL红细胞裂解液立即匀浆,然后分别以天根血凝块基因组DNA提取试剂盒(离心柱型)和Invitrigen purelinkTM血液基因组DNA提取试剂盒提取血凝块基因组DNA,操作步骤见试剂盒说明书。
1.2.2 基因组DNA的鉴定 ①用超微量紫外分光光度计检测各提取方法得到的DNA在波长为260 nm和280 nm的A260和A280吸光度值和浓度,DNA纯度以A260/A280值为依据。②琼脂糖凝胶电泳:取5μL不同方法提取到的DNA行0.8%琼脂糖凝胶电泳,电压100 V,30 min后观察结果。③PCR扩增:以我们正在研究的低氧诱导因子1α(HIF-1α)基因的一个功能SNP rs11549465序列为模板设计引物,引物序列为上游5’-GCTGAAGACACAGAAGCAAAGAA-3’下游5’-GTGGCATTAGCAGTAGGTTCTTGT-3’,加入TIANGEN 2×Taq PCR polymerse为PCR反应催化酶,25 μL反应体系,94 ℃预变性1 min,94 ℃ 30 s,65 ℃退火30 s,72 ℃延伸1 min,共40个循环,再72 ℃延伸5 min。反应结束取2 μL PCR产物行2.5%琼脂糖凝胶电泳30 min观察结果并以软件计算其电泳条带灰度值。
1.3 统计学分析
2 结果
2.1 三种方法提取DNA的浓度和纯度的比较
三种方法所提取的血液基因组DNA浓度比较差异具有统计学意义(P<0.01),而三种方法所测得的DNA纯度A260/A280值差异均无统计学意义(P>0.05)。
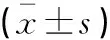
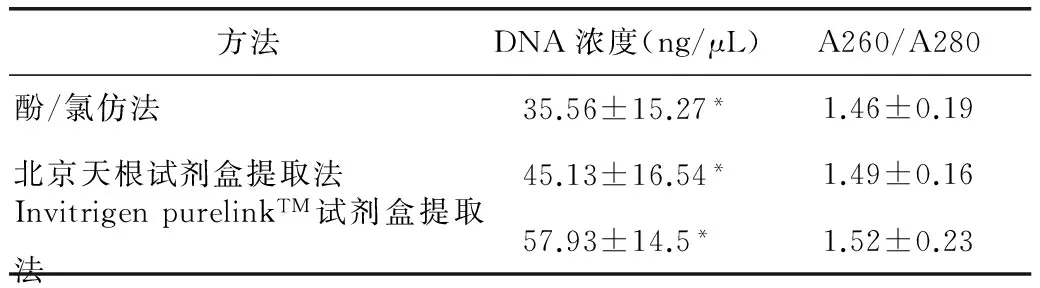
方法DNA浓度(ng/μL)A260/A280酚/氯仿法35.56±15.27*1.46±0.19北京天根试剂盒提取法45.13±16.54*1.49±0.16InvitrigenpurelinkTM试剂盒提取法57.93±14.5*1.52±0.23
*:酚/氯仿法,北京天根试剂盒提取法,Invitrigen purelinkTM试剂盒提取法分别比较DNA浓度均P<0.01,有显著性差异,A260/A280比较各组无统计学意义(P>0.05)。
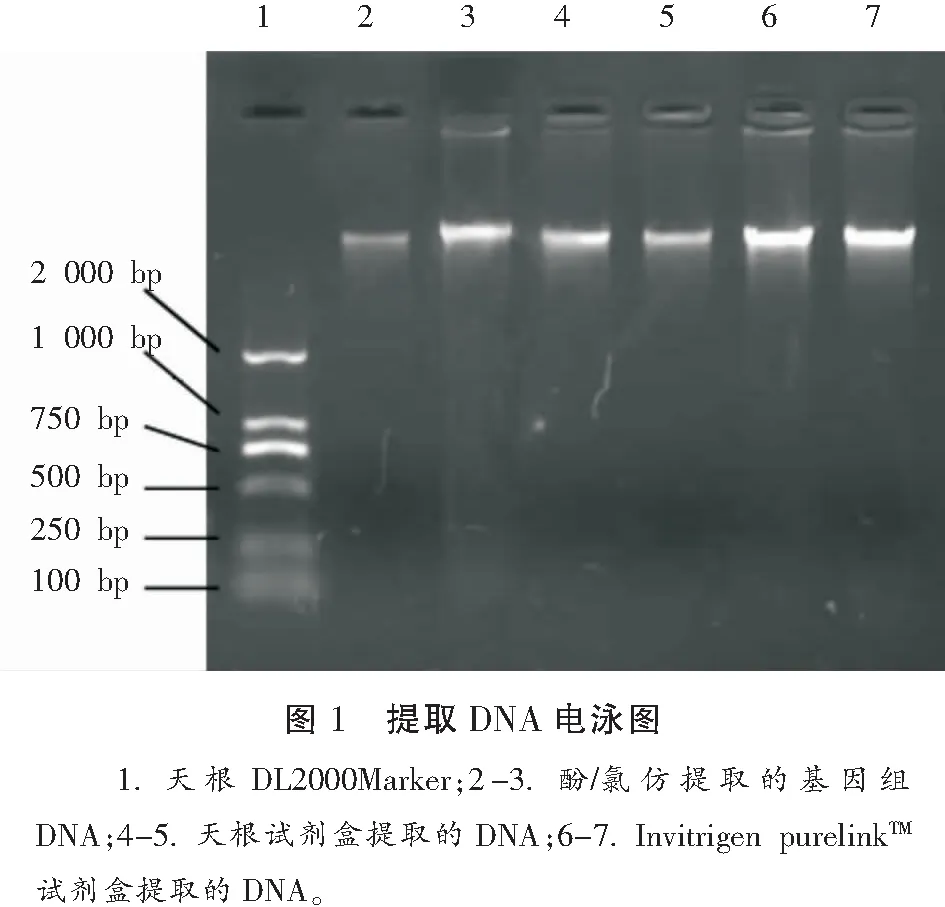
2.2 电泳鉴定
2.5%的琼脂糖凝胶电泳结果显示Invitrigen purelinkTM试剂盒提取的DNA条带明显比其他两种方法明亮,拖尾少,酚/氯仿提取的基因组DNA和天根试剂盒提取的DNA的电泳条带接近(图1)。
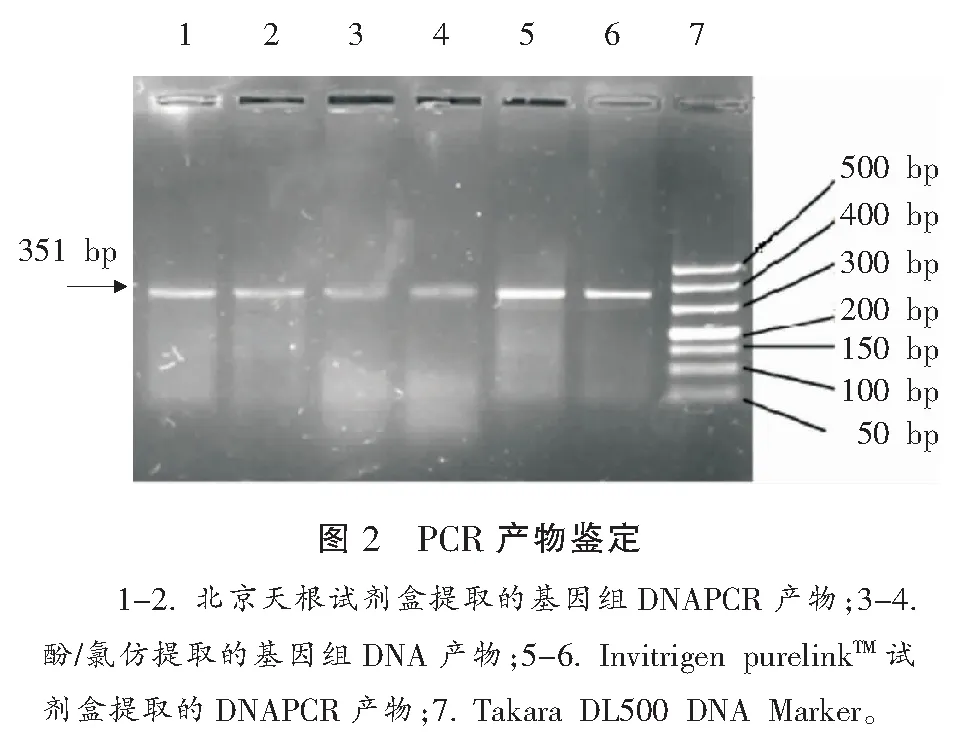
三种方法提取的DNA经过PCR扩增都在350 bp附近出现了条带,与预期的产物长度351 bp相符,而且通过PCR扩增可以看出Invitrigen purelinkTM血液基因组提取试剂盒提取的DNA PCR产物明显比北京天根试剂盒和酚/氯仿法提取的DNA PCR产物条带明亮清晰,北京天根试剂盒提取法得到的DNA PCR产物又比酚/氯仿法提取的DNAPCR产物明亮,这个结果与我们前面的浓度测试结果相符合(图2)。测得酚-氯仿法,天根试剂盒法和Invitrigen试剂盒法的PCR产物电泳条带灰度值结果分别为:75.421±3.435,149.32±6.875和229.52±19.55,三组灰度值比较,差异具有统计学意义,均P<0.01。
3 讨论
对于临床上一些不易得到的珍贵血液样本的保存利用一直是困扰临床医生和实验技术人员的问题,血液样本经过较长时间的冻存,全血中的核酸及其他有形成分会大大降解,所以一般认为超过两年的血液样本就不再适宜提取DNA,造成了临床样本的极大浪费。另外对一些未加抗凝剂的干涸的血迹和血块提取DNA在检验医学、遗传学、法医学等领域的应用也是越来越广泛,怎样才能利用有限的样本提取到优良的基因组DNA用于下游的研究是值得我们思考的问题,因此我们尝试比较几种不同的方法以找到一种高效的提取方法应用于相关领域。
有研究者发现酚/氯仿法提取冻存血DNA与试剂盒法效果相当[7],我们的研究却发现试剂盒法所提DNA浓度总的高于酚-氯仿法,其中Invitrigen purelinkTMGenomic DNA Kit试剂盒法最高,这可能不仅因为试剂盒本身提取效率较高,还与对血凝块的处理方法不同有关。在本研究中,酚/氯仿法加入PBS匀浆血凝块标本,而试剂盒法采用红细胞裂解液匀浆样本。红细胞裂解液作为高盐溶液在提取核酸中的作用是造成红细胞膜内外离子浓度差异产生较大渗透压而使红细胞溶胀破裂,因此直接使用红细胞裂解液匀浆的操作使红细胞裂解更充分,清除了红细胞碎片以后的白细胞中的DNA更容易释放[7],这种方法比加入PBS匀浆以后再加入红细胞裂解液的方法DNA得率更高。
本研究的PCR结果也证实Invitrigen purelinkTMGenomic DNA Kit试剂盒提取的DNA作为模板是优于其他两种方法的,Invitrigen purelinkTMGenomic DNA Kit试剂盒是一种高通量多用途的DNA提取试剂盒,可以从细胞、组织、细菌、血液、唾液等多种来源样本直接提取DNA,其本质是一种高盐沉淀法,并且采用高质量蛋白酶K将所有蛋白降解成为肽链或小片段的氨基酸使DNA分子完整地被分离出来[8],然后采用高盐沉淀蛋白质并且反复使用硅胶吸附柱纯化DNA[9],最后获得较高浓度和质量的DNA,70%乙醇洗涤也降低了DNA中盐的浓度,充分保证后期的PCR,Southern印迹杂交等临床检测和研究。
我们发现三种方法提取的DNA琼脂糖电泳结果均有明显拖尾现象,A260/A280显示三种提取方法的纯度没有统计学差异,并且均低于1.8,这可能与样本本身污染较严重有关,即使处于-80 ℃低温环境,样本的冻存时间过长核酸也会降解,所以在可能的条件下,选择冻存时间较长的样本需慎重,最好选用新鲜血液样本立即完成基因组DNA的提取以保障实验质量。但是如果因为条件限制确实无法避免地须从陈旧血提取DNA,我们认为可以适当增加红细胞和白细胞裂解液,蛋白酶K的用量(增加白细胞裂解效率),并后期纯化DNA以达到更好的实验效果。
总之,酚/氯仿试剂盒法都可以提取出冻存时间较长的非抗凝血凝块基因组DNA,并且可以满足PCR、酶切等实验要求,但是我们也证实试剂盒法提取DNA较传统的酚/氯仿法得到更满意的效果,而且Invitrigen试剂盒的提取效果优于天根试剂盒。
[1] Sambrook J,Fritsh EF,Maniatis T.分子克隆实验指南(第三版)[M].北京:科学出版社,2002:463-471.
[2] Miller SA,Dykes DD,Polesky HF.A simple salting out procedure for extracting DNA from human nucleated cells[J].Nucleic Acids Res,1988,16(3):1215.
[3] Tian H,Hühmer AF,Landers JP.Evaluation of silica resins for direct and efficient extraction of DNA from complex biological matrices in a miniaturized format[J].Anal Biochem,2000,283(2):175-191.
[4] Attal J,Cajero-Juarez M,Petitclerc D,etal.A simple method of DNA extraction from whole tissues and blood using glass powder for detection of transgenic animals by PCR[J].Mol Biol Rep,1996,22(1):37-46.
[5] 赵书平,张俊洁,尤建,等.一种碘化钾提取外周血基因组DNA的方法[J].中华医学遗传杂志,1999,16(6):395-396.
[6] 李晓晓,赵焕英,杨云廷,等.三种人全血基因组DNA提取方法的比较[J].现代生物医学进展,2013,13(27):5221-5225.
[7] 商亚丽,解军,程牛亮,等.从人血凝块中提取基因组DNA[J].山西医科大学学报,2006,37(8):881-882.
[8] 吴清敏,刘巧红,滕云,等.外周血DNA提取方法的比较[J].中华检验医学杂志,2004,27(7):445-446.
[9] Greater yields of higher-purity gDNA with the familiar spin column format PureLinkTMGenomic DNA Kits[J].Nucleic Acid Purification,https://tools.lifetechnologies.com.2015,3.
(学术编辑:赵明才)
The comparison of three different methods in extracting genome DNA from human Non-anticoagulant blood clot
QIU Ya1,QING Yu-feng2,DANG Wan-tai2,ZHOU Jing-guo2
(1.MedicalResearchCenter;2.DepartmentofRheumatologyandImmunology,theAffiliatedHospitaltoNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
Objective:To compare three different methods in extracting genomic DNA from human non-anticoagulant blood clot.Methods:The genomic DNA was isolated from long-time cryopreserved human non-anticoagulant blood clots by using the phenol-chloroform methods,TIANGEN kit and Invitrigen purelinkTMkit respectively.The concentration and purity of DNA were measured by ultraviolet spectrophotometer and agarose gel electrophoresis,and PCR experiment was performed using the extracted genome DNA as a template.Results:The genomic DNA was extracted successfully by three methods.The DNA concentration extracted by the three methods were 35.56±15.27 ng/μl,45.13±16.54 ng/μl,57.93±14.5 ng/μl respectively and the statistical significant difference was found among the three different methods in the purity of DNA(P<0.01).However,A260/A280 of the three groups were 1.46±0.19,1.49±0.16,1.519±0.23 and the statistical difference didn’t existed(P>0.05).The target band all appeared after PCR from genomic DNA by three extracting methods and the gray value of three group PCR products was 75.421±3.435,149.32±6.875 and 229.52±19.55 and there was statistical significant difference(P<0.01).Conclusion:The genomic DNA could be extracted from human non-anticoagulant blood clots by three different methods,however,the Invitrigen purelinkTMkit was the best.
Genome DNA;Non-anticoagulant blood clots;Extraction;Comparision
10.3969/j.issn.1005-3697.2015.04.12
四川省卫生厅项目(100160),南充市科技局项目(14A0032)
2015-03-14
邱亚(1976-),女,四川南充人,硕士,主治医师,主要从事风湿免疫性疾病研究。
周京国,E-mail:jgzhou@nsmc.edu.cn
时间:2015-8-4 23∶32 网络出版地址:http://www.cnki.net/kcms/detail/51.1254.R.20150804.2332.024.html
1005-3697(2015)04-0470-04
R394
A
