同步放化疗与单纯放疗对局部晚期食管癌疗效的对比分析
2015-06-12马桂香蒋文慧施前进王利娟吕燕青
胡 筱, 马桂香, 蒋文慧, 施前进, 王利娟, 丁 雷, 庄 燕, 吕燕青
临床与基础研究
同步放化疗与单纯放疗对局部晚期食管癌疗效的对比分析
胡 筱, 马桂香, 蒋文慧, 施前进, 王利娟, 丁 雷, 庄 燕, 吕燕青
目的 对比同步放化疗和单纯放射治疗对无法手术的局部晚期食管癌患者的疗效。方法 收集2008年1月至2009年12月收治的局部晚期食管癌患者91例,其中单纯放射治疗组52例,同步放化疗组39例。两组患者均采用适形放射治疗,同步放化疗组患者在放疗开始后第一周末即开始多西他赛化疗,共2周期。比较两组的完全缓解率、总有效率、生存率及毒副反应。 结果 同步放化疗组可以取得更高的完全缓解率(P=0.015),总有效率(CR+PR)两组间差异无统计学意义(P=0.149); 1、2、3年生存率两组差异均有统计学意义(均P<0.05);同步放化疗组Ⅲ~Ⅳ级放射性食管炎发生率高于单纯放疗组,而Ⅲ~Ⅳ级骨髓抑制及Ⅲ~Ⅳ级放射性肺炎发生率两组间无统计学意义 (均P>0.05)。结论 与单纯放疗组相比,同步放化疗可以明显提高局部晚期食管癌患者的完全缓解率及远期生存率,但不会明显增加毒副反应。
食管癌;同步放化疗;放疗;多西他赛
食管癌是我国最常见的恶性肿瘤之一,也是最难治愈的恶性肿瘤之一,预后较差。目前,手术切除是食管癌最主要的治愈手段,但大部分患者就诊时,肿瘤已经处于局部晚期或有远处转移[1-2],需要依靠包括放疗和其他学科的综合治疗。局部晚期食管癌患者单纯放疗虽可以保留食管的功能,但无法降低远处转移率,患者的远期生存率仍然非常低[3]。目前,同步放化疗已经广泛应用于食管癌患者,包括可手术切除患者的术前新辅助放化疗[4-5]及术后辅助放化疗[6],还包括无法手术的食管癌患者的治疗,它可以增加局部控制率,提高患者的远期生存率[3, 7-8]。本研究回顾性分析于2008年1月至2009年12月在我科治疗的91例初治局部晚期食管癌患者,比较同步放化疗和单纯放射治疗组的近期疗效及长期生存率,并进行毒副作用评价。现报告如下。
1 资料与方法
1.1 临床资料 入组条件:经病理组织学或细胞学确诊的食管鳞状细胞癌患者;年龄在18~75岁;预期生存时间超过3个月;ECOG评分0~1分;无合并其他肿瘤;血常规基本正常:WBC≥4.0×109/L,NEU≥1.5×109/L,HGB≥90 g/L,PLT≥100×109/L;肝肾功能基本正常:ALT、AST、TBIL在正常值上限2.5倍以内,Cr、BUN在正常值上限1.5倍以内;无穿孔前征象(包括龛影、穿透性溃疡、成角);局部晚期患者,无锁骨上淋巴结或远处转移;无严重心肺疾患。共91例入组,其中同步放化疗(同步组)39例,单纯放疗(单放组)52例。两组的一般情况详见表1,经比较,两组性别、年龄及病变部位差异无统计学意义(均P>0.05),具有可比性。
1.2 治疗方法 单放组:模拟机定位,新华XHA-600,FocusSoft-XTps2.0适形系统放射治疗,1次/d,2 Gy/次,5次/周;DT:58~60Gy,29~30分次,6~7周完成。放射靶区包括原发病灶,向上下各扩展3cm,向左右扩展2cm。同步组:放疗方案同单放组,放疗开始后第1周末即开始化疗。化疗药物采用多西他赛,40 mg·m-2·d-1,第1天、第8天,间隔2周再次用药,完成2周期化疗。
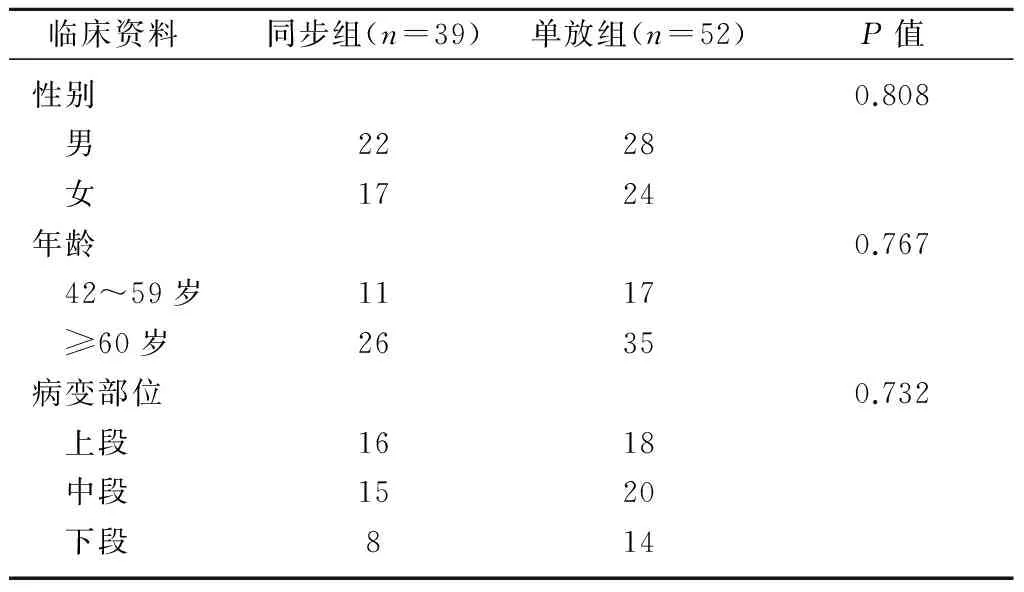
表1 两组患者一般临床资料的比较
1.3 疗效评价 近期疗效:根据内镜或CT检查结果,采用RECIST标准进行近期疗效评价,完全缓解(CR)+部分缓解(PR)为治疗有效。远期疗效:总生存率计算从第一次治疗的时间开始,比较两组患者的1、2、3年总生存率。
1.4 放化疗毒副反应评价 放化疗过程中,每周查血常规2次,定期查肝肾功能。参照抗癌药物常见毒副反应分级标准(WHO)评价毒副反应,按RTOG标准评价两组患者的放射性食管炎反应。
1.5 随访 治疗后的前两年每3~4个月复查1次CT扫描或内镜检查,随后每年复查2次。
1.6 统计学分析 所有患者均随访至2013年6月30日。应用SPSS 16.0统计软件,采用Kaplan-Meier法计算两组患者生存率,Log-rank法检验差异显著性,近期疗效及毒副反应比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较 两组近期疗效详见表2。两组相比,同步放化疗可以取得更高的完全缓解率,差异有统计学意义(P=0.015)。总有效率(CR+PR)两组差异无统计学意义(P=0.149)。
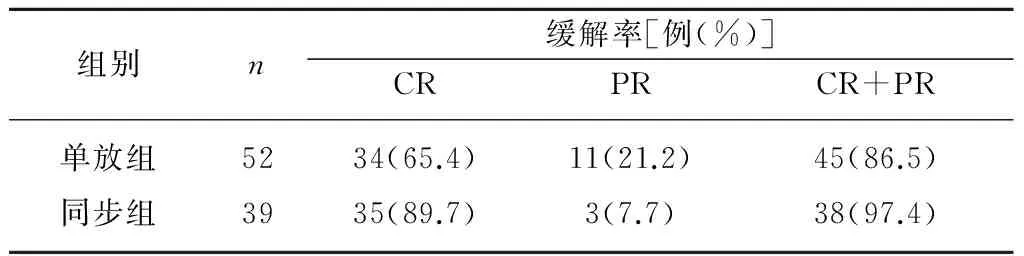
表2 两组患者近期疗效的比较
2.2 远期疗效的比较 截至随访终点,有19例患者仍存活,其中,单纯放疗组有7例,同步放化疗组有12例。两组的1、2、3年生存率详见表3,采用Kaplan-Meier法计算两组患者生存率,1、2、3年生存率差异均有统计学意义(均P<0.05)。
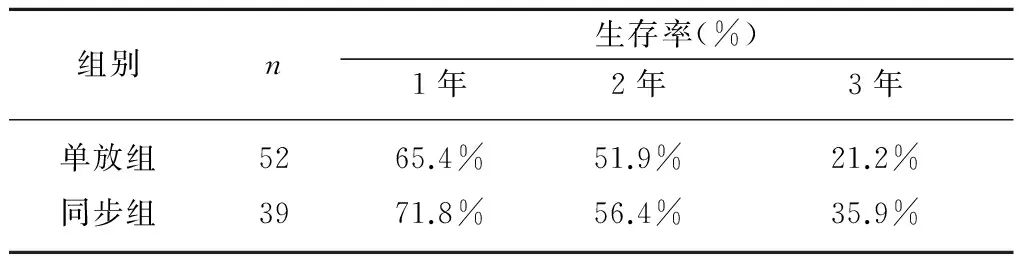
表3 两组患者远期疗效比较
2.3 两组患者放化疗毒副反应的比较 两组化疗毒副反应情况详见表4。同步组有8例(20.5%)出现Ⅲ~Ⅳ级放射性食管炎,高于单放组的2例(3.8%),两组间差异具有统计学意义(P=0.029)。同步组有7例(17.9%)出现Ⅲ~Ⅳ级骨髓抑制,单放组有2例(3.8%),两组相比差异无统计学意义(P=0.061)。同步组有3例(7.7%)出现Ⅲ~Ⅳ级放射性肺炎,单放组为4例(7.7%),两组相比差异无统计学意义 (P=1.00 )。
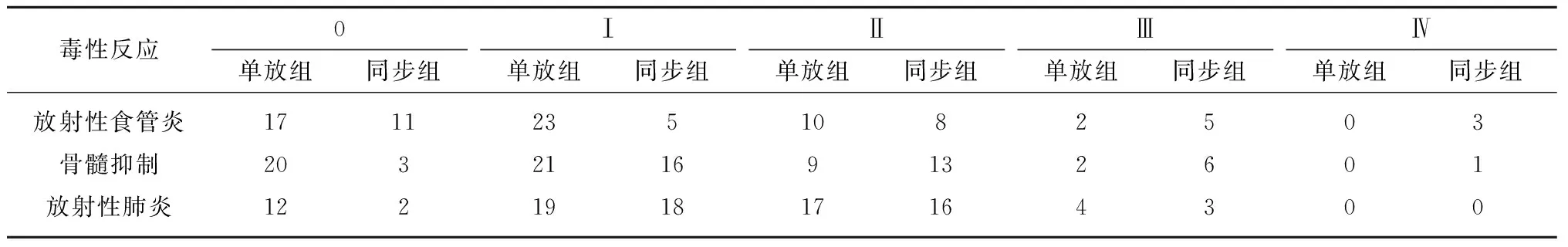
表4 两组患者放化疗毒副反应比较(例)
3 讨论
食管癌是最常见的恶性肿瘤之一,发病率占消化道恶性肿瘤的第3位,具有高侵袭性,占肿瘤相关死亡率的第7位[9]。单纯放疗虽然可以保全器官的功能,但局部复发率高达52%~77%,5年生存率只有0~21%[10-11]。同步放化疗具有以下优点:一是可增加放疗的敏感性;二是有助于控制微转移灶[12];三是可以保全器官功能。目前,关于同步放化疗研究较多的有食管癌[13]、肺癌[14]、直肠癌[15]、头颈部肿瘤[16]等。许多研究证实,同步放化疗较单纯放疗具有更好的局部控制率并能取得更高的远期生存率[10, 17]。同步放化疗可缩小食管癌原发肿瘤体积,杀灭全身的亚临床瘤灶,而且还可以杀灭原发灶中因乏氧等因素抗拒放射线而残存的肿瘤细胞,更好地减少局部复发和远处转移,从而改善近期及远期生存率。Kono等[18]研究表明,同步放化疗既可以通过诱导肿瘤细胞凋亡介导细胞毒性效应,也可以通过肿瘤特异性T淋巴细胞,自然杀伤细胞等诱导免疫原性肿瘤细胞死亡。
目前,食管癌同步放化疗研究中常用的化疗药物有顺铂、氟尿嘧啶[19]、伊立替康、紫杉醇等,多西紫杉醇相对较少。本研究采用放疗与单药多西紫杉醇化疗同步治疗局部晚期食管癌,结果显示,同步放化疗组的完全缓解率优于单纯放疗组(P<0.05),总生存率也优于单纯放疗组(P<0.05),但总有效率两组之间差异并无统计学意义,可能与病例数偏少及病例选择偏倚有关。放射线肺炎是食管癌放疗的主要副反应之一,本研究中Ⅲ~Ⅳ度放射线肺炎发生的比例在两组之间差异并无统计学意义(P=1.00 )。而同步放化疗组的Ⅲ~Ⅳ放射性食管炎的发生率高于单纯放疗组(P<0.05),但所有患者均能耐受,且经对症支持治疗后均好转。
综上,我们认为,同步放化疗比单纯放射治疗能更有效地提高食管癌的完全缓解率及远期生存率,其毒副反应虽有增加,但所有患者均能耐受,值得进一步深入研究。
[1] Almhanna K, Strosberg JR. Multimodality approach for locally advanced esophageal cancer[J]. World J Gastroenterol, 2012, 18(40): 5679-5687.
[2] Henry MA, Lerco MM, Naresse LE, et al. Outcome of superficial squamous cell carcinoma of the esophagus: a clinicopathological study[J]. Acta Cir Bras, 2013, 28(5): 373-378.
[3] Shirai K, Tamaki Y, Kitamoto Y, et al. Comparison of chemoradiotherapy with radiotherapy alone in patients with esophageal adenocarcinoma[J]. J Radiat Res, 2011, 52(3): 264-269.
[4] van Hagen P, Hulshof MC, van Lanschot JJ,et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med, 2012, 366(22):2074-2084.
[5] 李学健,贾慧,宋平平,等. 术前同步放化疗联合手术治疗局部晚期食管癌的疗效评价[J].中国肿瘤外科杂志,2014,6(2):77-79,92.
[6] Daiko H, Hayashi R, Sakuraba M, et al. A pilot study of post-operative radiotherapy with concurrent chemotherapy for high-risk squamous cell carcinoma of the cervical esophagus[J]. Jpn J Clin Oncol, 2011, 41(4): 508-513.
[7] Al-Sarraf M, Martz K, Herskovic A, et al. Progress report of combined chemoradiotherapy versus radiotherapy alone in patients with esophageal cancer: an intergroup study[J]. J Clin Oncol, 1997, 15(1): 277-284.
[8] Smith TJ, Ryan LM, Douglass HO Jr, et al. Combined chemoradiotherapy vs. radiotherapy alone for early stage squamous cell carcinoma of the esophagus: a study of the Eastern Cooperative Oncology Group[J]. Int J Radiat Oncol Biol Phys, 1998, 42(2):269-276.
[9] Seki N, Toh U, Sayers TJ, et al. Bortezomib sensitizes human esophageal squamous cell carcinoma cells to TRAIL-mediated apoptosis via activation of both extrinsic and intrinsic apoptosis pathways[J]. Mol Cancer Ther, 2010, 9(6): 1842-1851.
[10] Herskovic A, Martz K, al-Sarraf M, et al. Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus[J]. N Engl J Med, 1992, 326(24):1593-1598.
[11] Earlam R, Cunha-Melo JR. Oesophogeal squamous cell carcinoms: II. A critical view of radiotherapy[J]. Br J Surg,1980,67(7): 457-461.
[12] Shridhar R, Almhanna K, Meredith KL, et al. Radiation therapy and esophageal cancer[J]. Cancer Control, 2013, 20(2): 97-110.
[13] Ikeda E, Kojima T, Kaneko K, et al. Efficacy of concurrent chemoradiotherapy as a palliative treatment in stage IVB esophageal cancer patients with dysphagia[J]. Jpn J Clin Oncol, 2011, 41(8): 964-972.
[14] Le QT, Moon J, Redman M, et al. Phase II study of tirapazamine, cisplatin, and etoposide and concurrent thoracic radiotherapy for limited-stage small-cell lung cancer: SWOG 0222[J]. J Clin Oncol, 2009, 27(18): 3014-3019.
[15] Lee JW, Lee JH, Kim JG, et al. Comparison between preoperative and postoperative concurrent chemoradiotherapy for rectal cancer: an institutional analysis[J]. Radiat Oncol J, 2013, 31(3): 155-161.
[16] Citrin D, Mansueti J, Likhacheva A, et al. Long-term outcomes and toxicity of concurrent paclitaxel and radiotherapy for locally advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 74(4): 1040-1046.
[17] Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group[J]. JAMA, 1999, 281(17): 1623-1627.
[18] Kono K, Mimura K. Immunogenic tumor cell death induced by chemoradiotherapy in a clinical setting[J]. Oncoimmunology, 2013, 2(1): e22197.
[19] Nishimura Y, Hiraoka M, Koike R et al. Long-term follow-up of a randomized Phase II study of cisplatin/5-FU concurrent chemoradiotherapy for esophageal cancer (KROSG0101/JROSG021)[J]. Jpn J Clin Oncol,2012, 42(9): 807-812.
223700 江苏 南京,南京医科大学第二附属医院泗阳分院 肿瘤一病区
胡 筱,男,主治医师,专业方向:消化道肿瘤的化放疗及综合治疗,E-mail:huxiaosyys@163.com
10.3969/j.issn.1674-4136.2015.03.014
1674-4136(2015)03-0189-03
2014-12-03][本文编辑:李 庆]
