2015年美国ASCO年会三阴性乳腺癌研究进展
2015-06-12王晓稼
王晓稼
乳腺癌专题
2015年美国ASCO年会三阴性乳腺癌研究进展
王晓稼
第 51 届美国临床肿瘤学会(ASCO)年会于5月30日至6月2日在芝加哥McCormick Place盛大举行,作者就会议中有关三阴性乳腺癌研究的最新进展进行了综合报道。
三阴性乳腺癌; 治疗; 分型; ASCO年会
第 51 届美国临床肿瘤学会(ASCO)年会于5月30日至6月2日在芝加哥McCormick Place盛大举行,本届大会主题为“启示与创新”,共 25 000 名来自全球的肿瘤领域专家、学者、企业人士参加了本届学术盛会。本届年会讨论了常见恶性肿瘤的临床、基础与转化研究领域进展,特别是大数据与精准医疗、肿瘤免疫治疗等领域信息量很大。除肺癌等常见肿瘤领域外,乳腺癌研究也是最活跃病种之一。
1 乳腺癌领域概述[1-12]
本届年会根据乳腺癌传统的分子分型设有“HER-2/ER”和“三阴性/化疗/局部治疗”等多个专题会场,还有就乳腺癌化学预防、卵巢功能抑制治疗与生育保护、老年乳腺癌个体化策略、BRCA突变相关的检测/筛查/个体化治疗、内分泌治疗耐药机制探讨、乳腺癌骨调节剂辅助治疗作用、HER-2阳性和三阴性乳腺癌新辅助治疗研究、HER-2/TNBC疗效预测问题、HER-2阳性乳腺癌处理与新型靶向药物研制等专题讨论。
在“HER-2/ER”专题中,Poster Discussion有12篇研究进行交流与讨论,主要围绕术后辅助内分泌治疗、新的生物标记物(PIK3CA、HER3和DNA甲基化等)、DNA修复缺陷乳腺癌个体化治疗以及新药研发中的早期结果报告等。大会口头报告(Oral Abstract Session),主要是9篇重要的临床研究结果,如NSABP B-35关于绝经后DCIS采取“肿块切除+放疗” 常规治疗基础上,内分泌治疗选择TAM和阿那曲唑何者更优?CALGB40503关于绝经后激素受体阳性乳腺癌一线选择来曲唑单药或联合贝伐单抗的Ⅲ期临床研究;PALOMA3是最为关注的Ⅲ期临床研究,对于激素受体阳性晚期乳腺癌内分泌解救选择氟维司群500mg基础加或不加CDK4/6抑制剂palbociclib的Ⅲ期临床研究;早期乳腺癌辅助双膦酸盐或地诺单抗(denosumab)治疗Ⅲ期临床研究(S0307和ABCSG-18);HER-2阳性乳腺癌“多西他赛和(或)曲妥珠单抗和(或)pertuzumab”新辅助治疗Ⅱ期临床研究(NeoSphere)5年随访结果;三阳性早期乳腺癌新辅助治疗T-DM1基础上加或不加内分泌治疗Ⅱ期临床研究;HER-2阳性乳腺癌一线选择T-DM1±pertuzumab对曲妥珠单抗紫杉类随机Ⅲ期临床研究(MARIANNE研究);HER-2阳性早期乳腺癌曲妥珠单抗辅助治疗基础上序贯Neratinib安慰剂对照、随机Ⅲ期临床研究(NxteNET)。
大会还针对临床实践中遇到的实际困难与问题分别进行专题讨论,如乳腺癌化学预防——获益与风险;卵巢功能抑制治疗与生育保护中的共识与争议;老年乳腺癌的个体化策略及毒性(AE)预测与控制;BRCA基因突变的临床检测/筛查/个体化治疗争议;肿瘤内分泌治疗耐药机制探讨;肿瘤脑转移临床实践;肿瘤免疫治疗及其靶点(Checkpiont)等。以上尽管不是依托高质量RCT临床研究结果,但通过专题讨论让与会者对该领域的认识耳目一新,达成了共识,也看到了争议。
2 三阴性乳腺癌(TNBC)关键性研究
三阴性乳腺癌(含化疗和局部治疗)9个口头报告中有5个关于TNBC的重要临床研究,如TITAN是早期三阴性乳腺癌辅助化疗选择AC序贯紫杉醇或ixabepilone(ixa)Ⅲ期临床研究[13];一种雄激素受体抑制剂enzalutamide(ENZA)治疗AR(雄激素受体)阳性三阴性乳腺癌Ⅱ期临床研究[14];含卡铂方案新辅助治疗GeparSixto研究中,同源重组缺失(HRD)对三阴性乳腺癌pCR(病理完全缓解)的预测作用[15];BRCA相关和散发性三阴性乳腺癌中,AR和PD-L1表达率与相关性研究[16];新辅助治疗临床研究CALGB 40603及40601联合分析中,三阴性和HER-2阳性乳腺癌保乳率研究等[17]。还有,Perez等[18]报告的是一项Ⅲ期开放、随机、对照、多中心观察聚乙二醇化etirinotecan对照医生选择方案治疗蒽环、紫杉类药物和卡培他滨经治后进展的局部复发和转移性乳腺癌临床研究(BEACON研究)结果值得关注。
AR可能是雄激素驱动TNBC乳腺癌治疗的靶点,恩杂鲁胺(ENZA)是一种AR抑制剂,被批准用于睾丸去势后(castration-resistant)复发转移性前列腺癌(mCRPC)治疗,与比卡鲁胺相比,其显著提高PFS (15.7个月 对 5.8个月,HR=0.44,P<0.000 1)。MDV3100-11研究[14]是一个评估单药ENZA治疗晚期AR阳性TNBC(免疫组化检测AR表达大于0%,作为ITT人群的标准)疗效的开放、Ⅱ期临床研究。研究需要预先检测AR表达,骨转移患者可以入组,既往化疗次数少,但是需排除中枢神经系统转移。主要研究终点为16周时的临床获益率(CBR16),其他如CBR24、PFS、有效率和安全性等,研究第一阶段为26例患者给予ENZA(160mg/d,口服),16周评估CBR时至少3例患者获益(可评价患者AR表达率至少10%,且至少一个可评价病灶),则进入第二阶段研究,第二阶段62例患者,全组入组118例患者,43例无可评价病灶(29例AR <10%,14 AR≥10%),可评价患者75例。结果CBR16为35%(n=26),CBR24为29%(n=22),有效率为8%(2例CR、5例PR),雄激素基因检测阳性(Dx+)者mPFS为32周,阴性者(Dx-)9周。ITT人群(118例)的副反应分析显示,AEs发生率≥10%主要是乏力34%、恶心25%、食欲减退13%、腹泻和潮热各10%。本研究是迄今报告的雄激素受体抑制剂用于TNBC治疗病例数最大的临床研究,研究中AR表达率也最高,全组雄激素相关基因标记(Dx+)达47%,该组CBR16、CBR24和mPFS(周)均较Dx-组高,分别为39%、36%和16周,和11%、7%和8周。该研究结果基本确立了AR抑制剂在AR阳性三阴性乳腺癌治疗中的作用,有必要开展Ⅲ期随机对照研究。
GeparSixto研究将患者随机到PM(紫杉醇+非PEG化脂质体阿霉素)和“PM+卡铂”两组,其分层为TNBC、HER2+/HR-和HER2+/HR+,加了卡铂能改善三阴性患者pCR的研究结果已经报告(von Minckwitz, Lancet Oncology 2014),Minckwitz等[15]则分析三阴性患者肿瘤组织中BRCA突变和同源重组缺失(HRD)预测三阴性乳腺癌含铂新辅助治疗中pCR(ypT0/is ypN0)的作用。结果提示,存在HRD的三阴性乳腺癌患者pCR率显著高于无HRD患者(分别为55.9%和29.8%,P=0.001),特别是方案中添加卡铂后pCR率显著提高(45.2%上升到64.9%,P=0.025),而无HRD患者提高不明显(20.0%至40.7%,P=0.146)。在肿瘤内无BRCA突变(non-tmBRCA)患者中,无论是否使用卡铂,HRD评分高的患者的pCR率也显著高于HRD得分低的患者(分别为49.4%与30.9%,P=0.050)。因此,同源重组缺失评分(HRD score)是三阴性乳腺癌新辅助化疗pCR率良好的预测指标,尤其是针对DNA靶点的治疗药物。
Tung等[16]报告了BRCA相关和散发性三阴性乳腺癌中AR和PD-L1表达相关性,研究入组197例三阴性乳腺癌患者,其中78例(39.6%)来自BRCA1配系突变,119例(60.4%)来自散发性乳腺癌,常规H&E染色观察组织类型、分级、淋巴血管浸润(LVI)和淋巴细胞浸润(LI)。免疫组化检测AR、PD-L1、CK5/6、CK14和EGFR。结果,194例TNBC中AR阳性(≥ 1%核染色)约18.0%,AR强阳性(≥ 10%核染色)约11.3%。BRCA1突变患者中的AR表达率低于散发性TNBC患者(9.2%对23.7%,P=0.01),但PD-L1阳性率在BRCA1突变和散发性TNBC间没有统计学,LI在BRCA1突变TNBC中表达也高于散发性。
3 三阴性乳腺癌其他探索性研究
三阴性乳腺癌新的靶点专场分别是TNBC的生物学综览、TNBC与免疫学以及三阴性乳腺癌新的治疗手段三个专题。在Poster Discussion中7篇涉及三阴性乳腺癌研究,主要讨论关于新药研究以及三阴性乳腺癌治疗探索。
3.1 疗效预测 2014年ASCO会议上报告了PrECOG 0105研究中一项转化性研究分析,关于免疫调节亚型(immunomodulatory,IM)TNBC中肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)预测含铂新辅助方案疗效[9],今年的年会上有更多这方面的研究报告。再次对含铂新辅助化疗临床研究PrECOG 0105进行分析发现,三阴性乳腺癌患者同源重组缺失是含铂新辅助治疗疗效的预测指标,而且不依赖于BRCA1/2突变。
Miyashita等[10]报告TNBC新辅助化疗后残留组织中肿瘤浸润淋巴细胞(TILs )CD8+和FOXP3+的预后意义,结果发现,TNBC患者新辅助化疗后残余肿瘤中TIL CD8+水平或CD8/FOXP3比率高者,RFS和无乳腺癌复发生存(BCSS)显著延长。在多变量分析中,TIL CD8+是RFS强烈的预后因子(HR=3.44,(95%CI:1.74~7.19,P=0.000 3)。CD8+/FOXP3+比例与RFS也有显著相关性(HR=2.00,95%CI:2.00~1.01,P=0.049)。TNBC新辅助治疗后残余肿瘤大和腋下淋巴结转移状态是RFS短独立的相关因素 (分别为P=0.003 2和P=0.009 0)。TIL CD8+高水平也是明显改善患者BCSS的强预测指标(HR=3.58,95%CI:1.48,9.58,P=0.004)。腋下淋巴结转移状态也是BCSS相关因素(P=0.003),TNBC患者TIL CD8+阳性率增加预示RFS更好(P=0.011)。而CD8+/FOXP3+比值增加则强烈提示患者RFS和BCSS更好(分别为P=0.011,P=0.023)。这项研究首次表明,新辅助化疗后非pCR患者肿瘤残余组织中高水平TIL CD8+和CD8+/FOXP3+比例能够预测TNBC患者的预后。
含蒽环和紫杉类方案能够提高TNBC患者的新辅助化疗pCR率并改善无复发生存,但是总体的3年无远处复发生存仍低,作者利用242例以AT新辅助治疗的TNBC患者,建立一种基因表达风险分级系统(RespondR)来筛选出对该方案有效的TNBC人群。129例患者(38例达到pCR)作为训练组,确定了15个最具预测pCR的基因建模(即RespondR),另133例(60例达到 pCR)患者作验证,RespondR分出的低敏感组(RR-low, 55%)、中敏感组(RR-moderate, 21%)和高敏感组(RR-high, 24%) pCR概率分别为0.24、0.29和0.62,5年DRFS 概率分别为0.49、0.61和0.80。在高敏感组中,有丝分裂相关基因上调,而组织细胞外基质和细胞粘附相关基因下调[19]。
含铂方案对TNBC治疗疗效确切,BRCA1/2突变预示铂类药物对转移性TNBC有效,但在新辅助治疗中,散发性TNBC的pCR率有限,KaKlamani的研究观察卡铂联合艾日布林新辅助治疗早期三阴性乳腺癌疗效与安全性,以及同源重组缺失(HRD)对pCR的预测作用。卡铂AUC 6每3周静脉给药1次,艾日布林 1.4mg/m2(d1,d8),每3周重复。主要研究终点为pCR,次要终点为有效率、安全性,肿瘤标本作BRCA1/BRCA2突变、BRCA1启动子甲基化和HRD状态检测。结果入组30例患者中13例(43.3%)达到pCR,主要毒性为1/2度,26例患者治疗前肿瘤组织获得HRD分数,HRD阳性(HRD分数≥42)pCR高(P=0.001 2),在BRCA1/2野生型患者中同样有预测作用(P=0.001 8)[20]。
3.2 新药探索 LCL161是一种抑制细胞凋亡蛋白抑制剂(IAPs)活性的小分子药物,在有基因表达标记(GS)的TNBC模型中,LCL161具有IAP的拮抗作用,并与紫杉醇联合有协同作用。Parton等[21]报告的Ⅱ期临床研究是观察LCL161联合紫杉醇对TNBC新辅助治疗疗效与安全性。患者为可手术初治三阴性乳腺癌(T2N0~2M0),根据基因表达标记分类(GS+或GS-),随机分为paclitaxel (80 mg/m2/week) ± LCL161 (1 800 mg/week) 连续12周给予手术,术后由研究者决定辅助治疗,研究目的是LCL161是否在紫杉醇基础上增加pCR率,预计pCR提高7.5个百分点。共209例患者入组,联合组和紫衫醇单药组pCR率相近,分别为16.0%和16.5%,在GS+亚群,联合组34例GS+者pCR率为38.2%(13/34),高于单药组的17.2%(5/29)。相反,在GS-组,联合组72例仅4例达到pCR(5.6%),单药组73例中12例(16.4%)达到pCR。毒副反应(AE)发生率在30%以上的见表1,其中SAEs在联合组明显增加,发热17.9%对1.0%,肺部病变10.4%对1.9%,肺炎9.4%对0%。结论是LCL161联合紫杉醇能增加GS+亚组三阴性乳腺癌新辅助化疗的pCR率,但是该剂量的毒性增加明显。
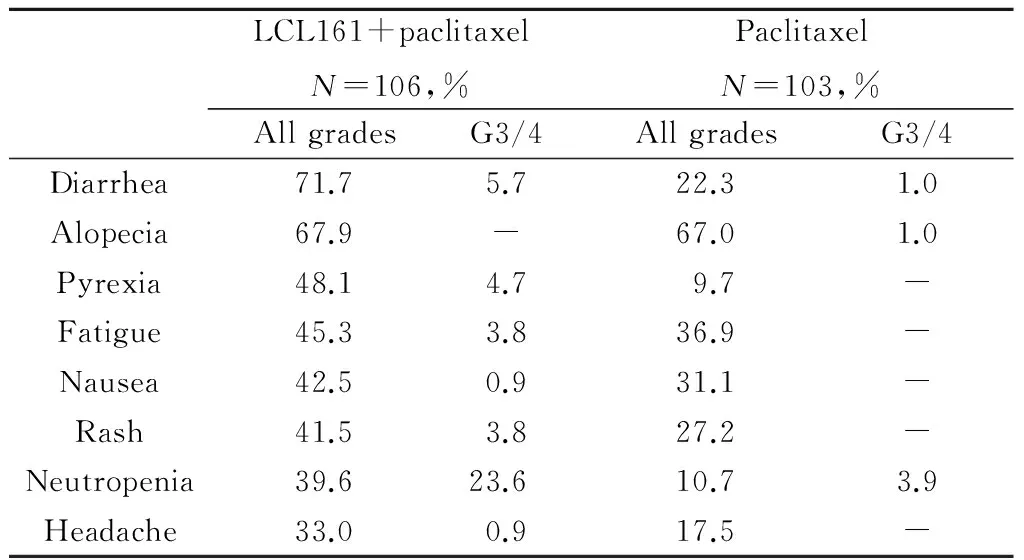
表1 Parton等研究中各组毒副反应发生率30%以上的情况
新药研究主要有LCL161联合紫杉醇用于新辅助Ⅱ期临床研究、veliparib联合每周“卡铂+紫杉醇”Ⅰ期临床研究以及难治性TNBC选择TROP-2单抗-SN38偶联药物IMMU-132(sacituzumab govitecan)Ⅰ/Ⅱ期临床研究等。
Veliparib (ABT-888)是一种小分子口服PARP抑制剂,Pahuja等[22]报告的是一项veliparib(ABT-888)联合“卡铂和紫杉醇”每周方案治疗实体恶性肿瘤和三阴乳腺癌(TNBC)Ⅰ期临床研究,研究是标准的3×3设计,Veliparib选择4个剂量水平(从50~200 mg,BID不等),卡铂周剂量为AUC 2,紫杉醇80 mg/m2/wk,全组30例实体瘤患者,24例乳腺癌患者中22例为TNBC,其他有2例肺癌,及子宫、卵巢、胃和前列腺癌各1例。27例可评价患者中,有效(CR+PR)48%(13例)、稳定(SD)37%(10例)。在TNBC患者中有效率达到52%,其中BRCA1/2突变者有效率60%(3/5),非BRCA1/2突变者有效率67%(CR 1/9,PR 5/9),类型不明者29%(2/7 PR)。3/4度毒性方面主要是中性粒细胞降低60%、贫血17%和血小板降低10%。
TROP-2在大部分上皮性肿瘤中表达,在TNBC中表达率达到90%,IMMU-132是人源化Trop-2单抗与SN-38的偶联物,SN-38是irinotecan具有强抗肿瘤活性的代谢物,Bardia等[23]报告的是难治性TNBC选择TROP-2单抗-SN38偶联药物IMMU-132(sacituzumab govitecan)治疗的Ⅰ/Ⅱ期临床研究,该研究174例难治性上皮性恶性肿瘤中,48例为三阴性乳腺癌患者,中位年龄51(33~81)岁,中位接受化疗数4个(1~11),3/4度毒性反应为中性粒细胞减少症30%(G3:24%,G4:6%),粒缺性发热3%,无患者因为毒性终止治疗。34例可评价患者总有效率为21%(包括1例CR),疾病控制率达74%。可见,IMMU-132对经过多线治疗的晚期TNBC有效,且安全性好,值得进一步临床研究评估与确认。
3.3 三阴性乳腺癌类型特征 Cheang等[24]报告了一项Ⅲ期多中心随机评价卡铂对多西他赛治疗转移性与局部复发三阴性乳腺癌临床研究(TNT)的转化研究分析,发现三阴性乳腺癌原发灶与转移灶之间内在亚型及复发风险的一致性。原发肿瘤组织216例,转移淋巴结66例,复发组织标本13例,复发风险分数采用PAM50法(Parker JCO 2009)。结果,216例原发灶175例(81%)判断为基底细胞样型(BLBC),23例(11%)为HER-2阳性型,13例(6%)为Luminal A (LumA),5例(2%)为Luminal B (LumB);66例淋巴结组织被判定为BLBC 49例(74%),HER-2阳性型12例(18%),LumA亚型2例(3%),LumB亚型3例(5%);13例转移灶92%(12/13)为BLBC,仅1例HER-2阳性型。其中63例患者有配对的原发灶与转移灶组织,其分型间一致性好(P<0.000 1),但1例BLBC者淋巴结转移灶为HER-2阳性,8例LumA患者淋巴结转移灶仅2例LumA(25%)和1例LumB(13%),而另5例为HER-2亚型(63%)。总体上,原发灶为BLBC亚型或其他高风险亚型者,其相应的淋巴结和转移灶类型一致性好,而且,非BLBC亚型患者其转移淋巴结或转移灶不会转变为BLBC亚型,但是LumA亚型患者的淋巴结或转移灶很有可能转变成其他凶险或高风险亚型。
4 结语
三阴性乳腺癌是目前乳腺癌治疗最棘手的亚型之一,HER-2阳性乳腺癌由于有针对驱动基因HER-2的多种靶向治疗药物,其治疗结果显著改善。三阴性乳腺癌作为一类新的类型实际上自身就有多个亚型组成,它们之间的生物学行为截然不同,因此,应该对TNBC进行全方位研究与探索。三阴性乳腺癌研究与治疗策略应该分而治之、各个击破。
[1] Dickler MN, Barry WT, Cirrincione CT, et al. Phase Ⅲ trial evaluating the addition of bevacizumab to letrozole as first-line endocrine therapy for treatment of hormone-receptor positive advanced breast cancer: CALGB 40503 (Alliance)[C]. J Clin Oncol, 2015, 33(suppl a501).
[2] Gralow J, Barlow WE, Paterson AHG, et al. Phase Ⅲ trial of bisphosphonates as adjuvant therapy in primary breast cancer: SWOG/Alliance/ECOG-ACRIN/NCIC Clinical Trials Group/NRG Oncology study S0307[C]. J Clin Oncol, 2015, 33(suppl a503).
[3] Gnant M, Pfeiler G, Dubsky PC, et al.Adjuvant denosumab in breast cancer: Results from 3,425 postmenopausal patients of the ABCSG-18 trial[C]. J Clin Oncol, 2015, 33(suppl a504).
[4] Gianni L, Pienkowski T, Im YH, et al.Five-year analysis of the phase Ⅱ NeoSphere trial evaluating four cycles of neoadjuvant docetaxel (D) and/or trastuzumab (T) and/or pertuzumab (P)[C]. J Clin Oncol, 2015, 33(suppl a505).
[5] Harbeck N, Gluz O, Christgen M, et al.Efficacy of 12-weeks of neoadjuvant TDM1 with or without endocrine therapy in HER2-positive hormone-receptor-positive early breast cancer: WSG-ADAPT HER2+/HR+ phase Ⅱ trial[C]. J Clin Oncol, 2015, 33(suppl a506).
[6] Ellis PA, Barrios CH, Eiermann W,et al. Phase Ⅲ, randomized study of trastuzumab emtansine (T-DM1) ± pertuzumab (P) vs trastuzumab+taxane (HT) for first-line treatment of HER2-positive MBC: Primary results from the MARIANNE study[C].J Clin Oncol, 2015, 33(suppl a507).
[7] Chan A, Delaloge S, Holmes FA,et al. Neratinib after adjuvant chemotherapy and trastuzumab in HER2-positive early breast cancer: Primary analysis at 2 years of a phase 3, randomized, placebo-controlled trial (ExteNET)[C]. J Clin Oncol, 2015, 33(suppl a508).
[8] Stover DG, Selfors LM, Coloff JL, et al.Meta-analysis of breast cancer expression data using published gene signatures to reveal key cellular processes implicated in chemosensitivity and resistance[C]. J Clin Oncol, 2015, 33(suppl a509).
[9] Vinayak S, Gray RJ, Adams S,et al.Association of increased tumor-infiltrating lymphocytes (TILs) with immunomodulatory (IM) triple-negative breast cancer (TNBC) subtype and response to neoadjuvant platinum-based therapy in PrECOG0105[C]. J Clin Oncol, 2014,32:5s(suppl a1000).
[10] Miyashita M, Sasano H, Tamaki K, et al. Prognostic significance of tumor-infiltrating CD8+and FOXP3+lymphocytes in residual tumors and alterations in these parameters after neoadjuvant chemotherapy in triple-negative breast cancer[C]. J Clin Oncol, 2015, 33(suppl a510).
[11] Slamon DJ, Hurvitz SA, Chen D,et al.Predictive biomarkers of everolimus efficacy in HER2+ advanced breast cancer: Combined exploratory analysis from BOLERO-1 and BOLERO-3[C]. J Clin Oncol, 2015, 33(suppl a512).
[12] Somlo G, Frankel PH, Luu TH,et al.Efficacy of the PARP inhibitor (PI) ABT-888 (veliparib[vel]) either with carboplatin (carb) or as a single agent followed by post-progression therapy in combination with carb in patients (pts) with BRCA1- or BRCA2- (BRCA)-associated metastatic breast cancer (MBC)[C]. J Clin Oncol, 2015, 33(suppl a520).
[13] Yardley DA, Bosserman LD, Keaton MR, et al. TITAN: Phase Ⅲ study of doxorubicin/cyclophosphamide (AC) followed by ixabepilone (Ixa) or paclitaxel (Pac) in early-stage, triple-negative breast cancer (TNBC)[C]. J Clin Oncol, 2015, 33(suppl a1000).
[14] Traina TA, Miller K, Yardley DA, et al.Results from a phase 2 study of enzalutamide (ENZA), an androgen receptor (AR) inhibitor, in advanced AR+ triple-negative breast cancer (TNBC)[C]. J Clin Oncol, 2015, 33(suppl a1003).
[15] Minckwitz GV, Timms K, Untch M, et al.Prediction of pathological complete response (pCR) by Homologous Recombination Deficiency (HRD) after carboplatin-containing neoadjuvant chemotherapy in patients with TNBC: Results from GeparSixto[C]. J Clin Oncol, 2015, 33(suppl a1004).
[16] Tung NM, Garber EG, Torous V, et al.Prevalence and predictors of androgen receptor (AR) and programmed death-ligand 1 (PD-L1) expression in BRCA1-associated and sporadic triple negative breast cancer (TNBC)[C]. J Clin Oncol, 2015, 33(suppl a1005).
[17] Golshan M, Cirrincione CT, Carey LA, et al.Impact of neoadjuvant therapy on breast conservation rates in triple-negative and HER2-positive breast cancer: Combined results of CALGB 40603 and 40601 (Alliance)[C].J Clin Oncol, 2015, 33 (suppl a1007).
[18] Perez EA, Awada A, O’Shaughnessy J, et al. Phase Ⅲ trial of etirinotecan pegol(EP) versus Treatment of Physician’s Choice(TPC) in patients(pts) with advanced breast cancer(aBC) whose disease has progressed following anthracycline(A), taxane(T) and capecitabine(C): The BEACON study[C]. J Clin Oncol, 2015, 33 (suppl a1001).
[19] Buechler S, Gokmen-Polar Y, Badve SS.RespondR: A genomic score to predict the responsiveness of triple-negative breast cancer patients to chemotherapy[C]. J Clin Oncol, 2015, 33(suppla1020).
[20] Kaklamani VG, Hughes E, Siziopikou KP, et al.Phase Ⅱ neoadjuvant clinical trial of carboplatin and eribulin in women with triple negative early stage breast cancer (NCT01372579)[C]. J Clin Oncol, 2015, 33(suppl a1017).
[21] Parton M, Bardia A, Kummel S, et al.A phase Ⅱ, open-label, neoadjuvant, randomized study of LCL161 with paclitaxel in patients with triple-negative breast cancer (TNBC)[C]. J Clin Oncol, 2015, 33(suppl a1014).
[22] Pahuja S, Beumer JH, Appleman LJ, et al.A phase Ⅰ study of veliparib (ABT-888) in combination with weekly carboplatin and paclitaxel in advanced solid malignancies and enriched for triple-negative breast cancer (TNBC)[C]. J Clin Oncol, 2015, 33(suppl a1015).
[23] Bardia A, Vahdat LT, Diamond JR, et al.Therapy of refractory/relapsed metastatic triple-negative breast cancer (TNBC) with an anti-Trop-2-SN-38 antibody-drug conjugate (ADC), sacituzumab govitecan (IMMU-132): Phase Ⅰ/Ⅱ clinical experience[C]. J Clin Oncol, 2015, 33(suppl a1016).
[24] Cheang MCU, Bliss J, Dowsett M, et al.Concordance of intrinsic subtyping and risk of recurrence (ROR) scores between matched primary and metastatic tissue from Triple Negative Breast Cancer Trial (TNT)[C]. J Clin Oncol, 2015, 33(suppl a1019).
310022 浙江 杭州,浙江省肿瘤医院 乳腺肿瘤内科
王晓稼,男,医学博士,主任医师,硕士生导师,学科带头人,中国临床肿瘤学协作委员会(CSCO)执行委员
10.3969/j.issn.1674-4136.2015.03.002
1674-4136(2015)03-0141-05
2015-06-12][本文编辑:李筱蕾]
