黔东南小香鸡ALV的流行病学调查及病毒的分离鉴定
2015-06-11赵香胜李瑞典河北省任丘市畜牧水产局062550
赵香胜 李瑞典(河北省任丘市畜牧水产局 062550)
禽白血病病毒(AvianLeukosisVirus,ALV)属反转录病毒科禽C型反转录病毒属成员,可引起禽类多种肿瘤性疾病[1]。该病毒可分为A到J10个亚群,临床上常见的为A、B和J亚型,而C、D亚型在临床上相对少见,E亚群主要以前病毒的形式存在于宿主基因组而广泛存在[2]。由于ALV病毒基因组变异较快,目前尚未有商业化疫苗可供使用,实施严格的净化措施是唯一有效的防控方法[3]。
近年来,随着我国对禽白血病病毒检测和防控力度的加强,我国白羽肉鸡和蛋用型鸡群祖代鸡ALV感染已得到有效控制。然而,我国地方品系鸡分布广泛,品种繁多,因此我国地方品系鸡禽白血病的防控和净化面临着较大挑战,ALV的感染和流行依然存在。同时,近些年中国地方品系鸡种的保护工作逐渐受到重视[4]。黔东南小香鸡是我国特有的地方品系鸡,羽毛色彩丰富多样,外表华丽,肉质细嫩香醇,市场前景良好。为了解我国黔东南小香鸡的ALV感染状况,为净化和保种工作提供技术支持,本研究对我国某地方品系鸡黔东南小香鸡保种鸡群进行了ALV的流行病学调查。
1 材料与方法
1.1 材料(1)主要试剂和仪器:ALV抗原检测试剂盒,ALV-J、ALV-AB抗体检测试剂盒均购自IDEXX公司;病毒RNA提取试剂购自OMEGA公司;RT-PCR反应试剂、DL2000Marker、PMD-18T载体购自大连宝生物公司,其余常规试剂均为国产分析纯。(2)细胞:可区分内外源ALV的鸡胚成纤维细胞系DF-1细胞由本实验室保存、传代。
1.2 血清ALV抗体和蛋清ALV抗原的检测 在该场240日龄的黔东南小香鸡保种鸡群中,随机抽取54只鸡(母鸡40只,公鸡14只),每只鸡分别常规采血0.2~0.5ml,分离血清,使用IDEXX公司ALV抗体检测试剂盒分别检测ALV-J和ALV-AB特异性抗体。同时,收集该保种鸡群40枚鸡蛋,使用IDEXX公司ALV抗原检测试剂盒检测蛋清中ALVp27抗原。
1.3 病毒分离培养 将p27抗原阳性蛋清经0.24μm滤器过滤后接种DF1细胞系,维持7d后盲传一代,7d后取上清使用ALV抗原检测试剂盒(IDEXX公司)检测p27抗原,阳性者收集细胞上清和DF1细胞,所分离病毒置于液氮中保存,并将其命名为QDN-13。
1.4 细胞DNA的提取 将上清p27抗原阳性的DF1细胞用PBS清洗1-2遍,加500μl组织抽提液,5μl蛋白酶K,55℃消化过夜。用苯酚氯仿抽提提取DNA,50μlddH2O溶解,-20℃保存备用。
1.5 ALV的PCR扩增和克隆测序 根据参考文献[5],使用针对env基因两侧保守区的通用引物,PCR扩增env基因的约1.9kb片段。引物如表1所示。PCR反应体系如下:10XPCRbuffer2.5μl, Mg2+*(25mM)2μl, dNTP(2.5mM)2μl,上下游引物各0.5μl,模板DNA2μl,rTaqDNA聚合酶0.5μl,ddH2015μl,共25μL。PCR扩增条件为:预变性95℃ 5min,变性95℃ 1min,复性55℃ 50s,延伸72℃2min,共30个循环,复延伸72℃10min。PCR产物用1%琼脂糖凝胶电泳检测、回收,使用OMEGA凝胶回收试剂盒纯化PCR片段,与PMD-18T载体连接,转化DH5大肠杆菌,挑取白色菌落,酶切验证后挑选阳性克隆送上海生工测序。根据所得序列推导其gp85氨基酸序列。1.6 ZJ13-QDN-2分离株与各亚群参考株同源性和遗传进化树分析 使用DNAstar5.0软件对序列进行拼接、同源性分析和病毒的遗传进化树分析。用于比较的不同亚群ALV参考株及其信息见表2所示。

表1 PCR扩增引物序列
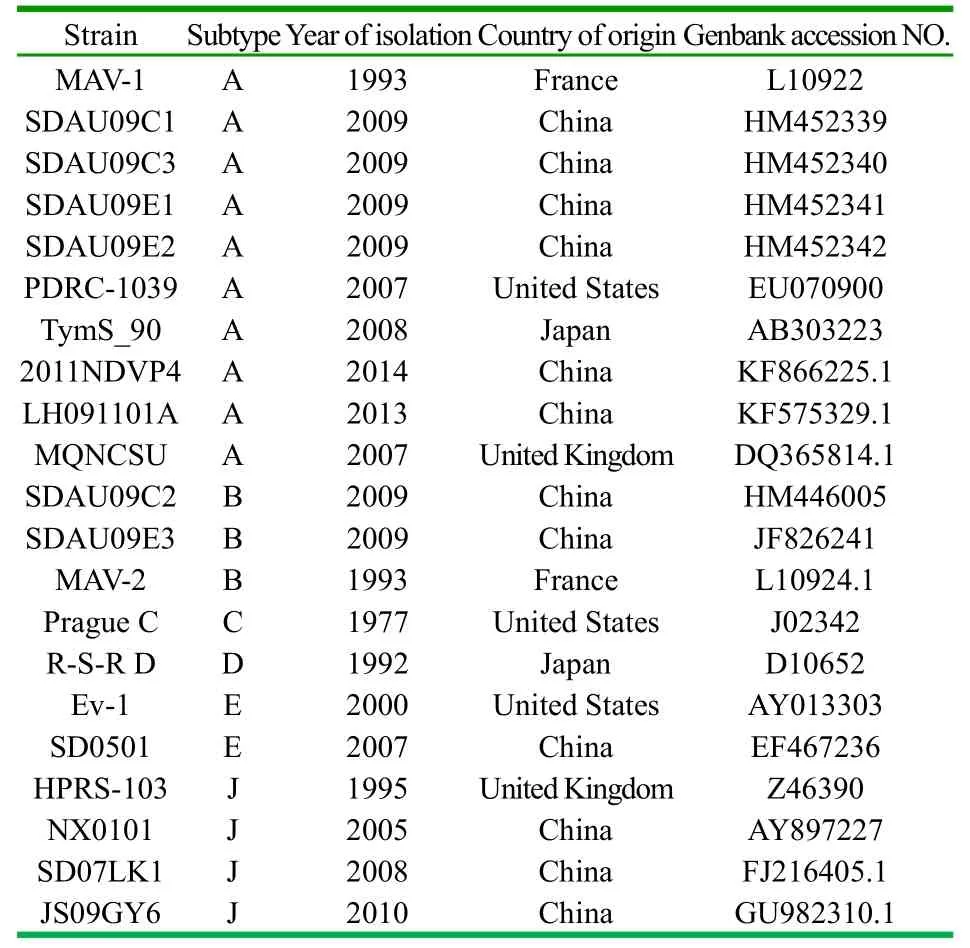
表2 各亚群参考株信息
2 结果
2.1 黔东南小香鸡ALV感染状况 血清抗体的检测结果表明,该保种鸡场的黔东南小香鸡保种鸡群存在着ALV-J和ALV-AB的混合感染。该群鸡ALV-AB的阳性率为16.70%,而ALV-J抗体阳性率仅为1.9%;并且,公鸡ALVAB抗体阳性率远远高于母鸡。蛋清ALV抗原检测结果表明,有高达27.50%的蛋清为P27抗原阳性,这表明,垂直传播在ALV的传播过程中发挥重要作用。

表3 黔东南小香鸡ALV抗原及ALV-JALV-AB抗体阳性率
2.2 蛋清中ALV的分离鉴定 将p27抗原检测阳性的蛋清接种DF1细胞,5%CO2,37℃培养箱中培养7d,收集细胞上清检测ALVp27抗原。对p27抗原阳性细胞使用ALVA/B单因子血清[6]和ALV-J单抗JE9通过IFA进行检测。结果表明,我们在阳性蛋清中分离到一株外源性ALV,并将其定名为ZJ13-QDN-2。
2.3 ZJ13-QDN-2分离株与参考株之间同源性和系统进化树分析 对ALV前病毒DNA的env基因克隆测序,并对序列进行比对分析,结果表明,SDAU14A1的gp85基因长度为1035bp,推导其编码344aa的gp85蛋白。序列比对表明,SDAU14A1的gp85氨基酸序列与A亚群ALV参考株之间同源性为93.1%(89.7%~98.0%),与B亚群ALV参考株之间同源性平均值为79.5%(79.3%~79.8%),与C亚群ALV参考株之间同源性为84.6%,与D亚群ALV参考株之间同源性为83.1%,与E亚群ALV参考株之间同源性平均值为84.4%(84.1%~84.7%),与J亚群ALV参考株之间同源性平均值为38.3%。ZJ13-QDN-2的gp85氨基酸仅与A亚群ALV的同源性高于80%,与其他亚群同源性均较低。系统进化树也表明,我们分离到的ZJ13-QDN-2株属于A亚群ALV。值得注意的是,ZJ13-QDN-2的gp85在氨基酸水平上与分离自法国的MAV-1、分离自其余地方品系鸡的毒株LH091101A在同一进化枝上,这暗示,盲目引种及不当的饲养管理可能是造成该群鸡感染ALV-A的原因。

图1 ZJ13-QDN-2的gp85蛋白与其余参考株同源性比对
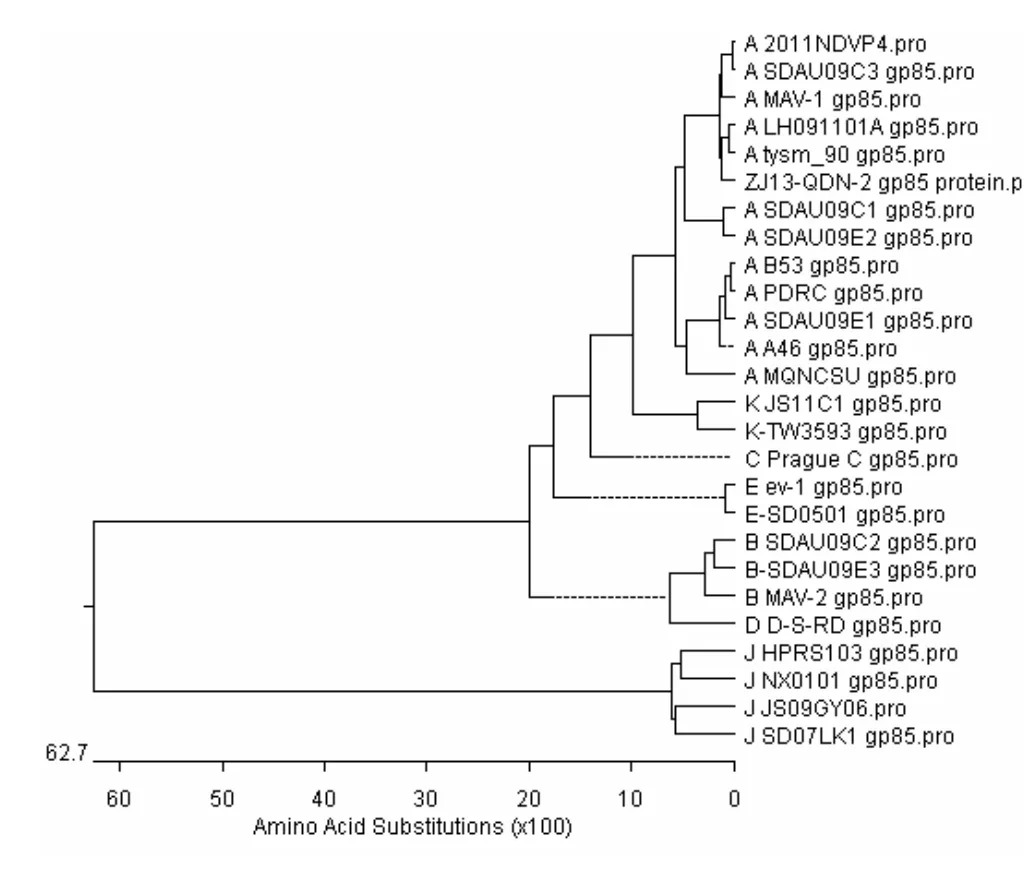
图2 ZJ13-QDN-2的gp85蛋白系统进化树
3 讨论
ALV是一种主要通过垂直传播的的反转录病毒,除了可以诱发鸡的肿瘤,ALV感染还可引起鸡产蛋下降和免疫抑制,给我国养禽业造成巨大经济损失[7]。经过十余年努力,虽然我国的白羽肉鸡和蛋用型祖代鸡基本实现了ALV的净化,但由于饲养管理不善、缺乏严格的监控措施等多种原因,ALV在我国地方品系鸡中仍呈现大规模感染和局部流行的态势。继成子强在中国麻鸡中发现ALV-J的感染后,研究人员先后在山东寿光鸡、芦花鸡、百日鸡、琅琊鸡、鲁西斗鸡、广西黑鸡、龙胜凤鸡、广西三黄鸡、乌骨鸡等我国特有品系鸡中分离鉴定到ALV[8-12]。在这些鸡群中,普遍存在着ALV-J的感染,也有的品系表现ALV-A/B的流行,甚至共感染。在前期调查中,我国6个省的28个地方品系鸡中有22个地方品系鸡ALV-A、ALV-B抗体呈现阳性,23个地方品系鸡对ALV-J抗体呈阳性。这表明,我国地方品系鸡中ALV的净化防控任务依然艰巨。
本研究通过对我国某保种鸡场的黔东南小香鸡保种鸡群进行ALV的流行病学调查,以期为ALV的净化工作提供依据,为我国优良品系鸡的保种工作提供保障。血清流行病学调查的结果表明,在该群鸡中,存在着ALV-J和ALV-AB的混合感染,以ALV-AB的感染为主,并且,公鸡中ALV-AB抗体阳性率显著高于母鸡。有研究表明,公鸡的精液可以作为ALV传播的载体,这提示我们在对该群鸡ALV净化中,需要加强对公鸡的检测淘汰力度。本研究将ALV抗原阳性蛋清接种DF-1细胞,成功分离到一株外源ALV病毒,env基因的克隆测序结果表明,ZJ13-QDN-2分离株为A亚群ALV,这与血清学调查的结果相吻合。Gp85序列分析和系统进化树分析表明,该分离株与分离自法国的MAV-1、分离自其余地方品系鸡的毒株LH091101A在同一进化枝上,它们之间具有较高的同源性。这暗示,该分离株有可能是在国外引种过程中带入我国的。由于引种时检疫不严,引种后管理不善,使得病毒感染了鸡场的该鸡群。另外,需要指出的是,本研究在该黔东南小香鸡保种鸡群中仅分离到A亚群ALV,但并不能排除该鸡群中其他亚群的感染。该鸡群ALV-J抗体阳性率为1.90%,表明该鸡群可能曾经或者正在经历ALVJ的感染。
总之,本研究对我国某保种鸡场的黔东南小香鸡保种鸡群进行了ALV的流行病学调查,并在ALV抗原阳性的蛋清中分离到一株A亚群ALV。这为黔东南小香鸡ALV的净化、优良品种的保藏培育提供了技术支持,也给研究黔东南小香鸡ALV的来源、遗传关系提供了有力的材料。我们需要加强对该黔东南小香鸡保种鸡群ALV的检测力度,实施更加严格的净化淘汰措施,同时加强饲养管理,避免ALV在鸡群中的横向传播,为全面提高种禽健康水平奠定基础。
[1]CalnekBW.高福,苏敬良等译.禽病学[M].第10版.北京:中国农业出版社,1999:529-296.
[2]Payne LN.HPRS-103:a retrovirus stikes back.The emergence of subgroup Javian leukosisvirus.Avian Pathology,1998,27:S36-S45.
[3]崔治中.我国鸡群J亚群白血病流行的过去,现在和将来及其防控—对我国动物疫病防控的启示[J].现代畜牧兽医,2015,1:008.
[4]范建华,俞燕,高明燕等.小群保种的我国地方鸡禽白血病净化措施研究[J].中国畜牧兽医文摘,2013(12):109-111.
[5]Gao Y,Yun B,Qin L,etal.Molecular epidem iology of avian leukosis virus subgroup J in layer flocks in China[J].Journal of clinical m icrobiology,2012,50(3):953-960.
[6]张恒,李传龙,杨明等.禽白血病A亚群病毒gp85的单因子血清制备及其特异性鉴定[J].微生物学报,2011,51(1):134-140.
[7]Lai H,Zhang H,Ning Z,et al.Isolation and characterization of emerging subgroup Javian leukosis virus associated w ith hemangioma in egg-type chickens[J].Veterinarymicrobiology,2011,151(3):275-283.
[8]秦卓明,徐怀英,马秀丽等.从芦花鸡分离的J亚群ALV病毒及其gp85基因演化[J].浙江农业学报,2014,26(5):1180.
[9]潘孝成,赵瑞宏,胡晓苗等.黄羽鸡J亚群禽白血病病毒的分离及gp85基因分析[J].动物医学进展,2014,35(2):51-54.
[10]赵成棣,王波,王健等.地方品种HR土鸡不同亚型禽白血病病毒的共感染[J].中国预防兽医学报,2012,34(3):172-175.
[11]钱琨,朱钰峰,沈海玉等.地方蛋鸡群中A亚群禽白血病病毒的分离与全基因组序列分析[J].中国兽医科学,2011,41(10):1005-1010.
[12]杨凤,孙洪磊,倪伟等.山东不同品系蛋鸡禽白血病流行病学调查[J].畜牧兽医学报,2011,42(5):698-703.
