腹腔镜脾部分切除术(附八例报告)
2015-06-10潘飞郎韧俞亮张涛
潘飞 郎韧 俞亮 张涛
·论 著·(脾脏外科专题)
腹腔镜脾部分切除术(附八例报告)
潘飞 郎韧 俞亮 张涛
目的 探讨腹腔镜脾部分切除术治疗脾脏良性肿瘤的安全性。方法 2009年1月至2014年8月,对8例术前CT或MRI检查明确为脾脏良性肿瘤的病人实施腹腔镜脾部分切除术,肿瘤直径5.2~9.1 cm,平均直径6.9 cm,2例位于脾脏上极,6例位于脾脏下极。其中脾脏囊肿6例,脾脏血管瘤2例。结果 8例均于腹腔镜下完成脾脏部分切除,无中转开腹病例,标本均经劈脐纵行小切口取出。手术时间为115~280 min,平均166.3 min。出血量为100~600 ml,均未输血。术后腹腔引流时间3~5 d,无腹腔出血、胰漏、腹腔感染等并发症。术后住院4~6 d。结论 腹腔镜脾部分切除术治疗位于脾脏一侧的良性肿瘤安全可行。虽然技术上较全脾切除费时费力,但保留了部分脾脏及功能,有其重要的临床意义,对年轻病人尤其如此。
腹腔镜;脾脏部分切除术;脾脏功能;脾脏良性肿瘤
脾脏切除术是外科常见手术方式,用于治疗脾脏肿瘤、脾脏外伤及部分血液系统疾病。随着对脾脏功能研究的不断发展,尤其是对于脾脏免疫功能研究的进展,提示脾脏有其重要的生理功能,对于年轻病人更是如此。同时,全脾切除术后凶险性感染、高血小板状态造成血栓栓塞并发症亦有多项文献报道。脾脏切除后免疫细胞生活的环境消失, 免疫应答及免疫效应物质大大降低,身体处于免疫低下状态,增加了感染的机会,感染发生后机体无法有效清除病菌, 机体内细胞因子调节失去平衡,易发展成脾切除术后凶险感染[1],尤其是在脾切除术后2年内[2]。因此,在治疗脾脏疾病同时应该尽可能保留正常脾脏并维持其正常功能,已在脾脏外科界达成共识。脾脏部分切除术可以满足这种治疗需要,它是指脾脏因外伤或其他非外伤性疾病如脾囊肿、脾血管瘤等需将病变的脾组织切除,保留部分健康脾组织的手术[3]。开腹脾脏部分切除已经成为较成熟的术式,并已经广泛开展。而腹腔镜脾部分切除术由于手术操作要求较高,术中易出血,目前国内多为个案报道[4]。腹腔镜脾部分切除术是基于腹腔镜全脾切除术大宗病例的临床实践,其手术难度远远超过腹腔镜全脾切除术[5]。在2009年1月至2014年8月间,我院对8例术前诊断为脾脏囊肿及确诊或考虑为脾脏血管瘤的病人进行腹腔镜脾部分切除术,手术效果满意,现报告如下。
资料与方法
一、临床资料
8例手术病人中,男性3例,女性5例,年龄22~52岁,平均34.9岁。2例病人有左上腹胀满不适,其余6例病人均为体检发现或进行其他检查时意外发现。6例病人为脾脏囊性病变,2例为脾脏实性病变,考虑为脾脏血管瘤或不典型血管瘤。所有病人术前均行腹部增强CT或MRI检查,以明确肿瘤位置及脾门血管分支走行,肿瘤与脾脏分支血管关系等情况。影像学检查提示肿瘤直径5.2~9.1 cm,平均直径6.9 cm,2例位于脾脏上极,6例位于脾脏下极,一般情况见表1。
手术选择标准:脾脏实性肿瘤直径>5 cm,囊性肿瘤直径>5 cm,有临床症状者,术前CT或MRI检查均提示脾脏良性疾病者。
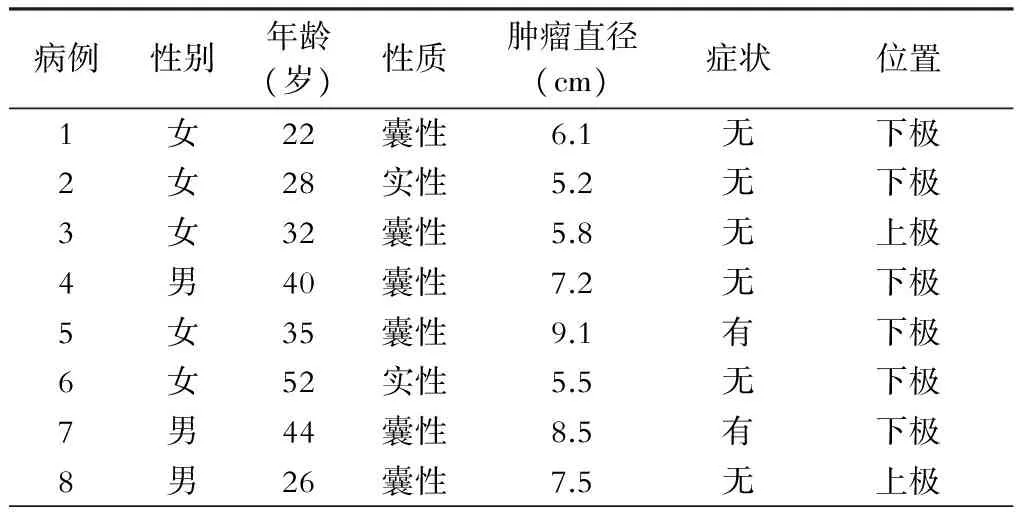
表1 8例脾脏肿瘤病人的一般资料
二、方法
全麻后病人取头高脚低右倾位,左侧肋下垫高。术者位于病人右侧。取紧贴脐环脐下纵行切口,气腹针穿刺后充入CO2气体,至腹内压达到12 mmHg,建立人工气腹。通常在剑突下左侧、左侧腋前线平脐水平放置5 mm Trocar,左侧锁骨中线肋缘下放置12 mm Trocar(Trocar穿刺位置根据脾脏大小做适当调整)。30°腹腔镜经脐部Trocar进入腹腔观察,应用超声刀分离脾周韧带,显示脾脏及肿物。脾脏囊性肿瘤尽可能不减压以保证肿瘤界线清晰。分离脾门血管,寻及脾脏血管的上极支及下极支,注意保护健侧脾脏的血管以保证其血运。对于肿瘤侧的血管,应用可吸收夹或Hem-o-lok夹闭后离断,或应用腔镜下切开闭合器(Endo-GIA 45~2.5 mm)离断患侧血管蒂,进行上极切除尚需离断胃短血管。此时可见脾脏表面出现缺血线。应用超声刀沿脾脏表面缺血线进行脾脏上极或下极切除。观察残留脾脏血运情况,脾脏创面应用氩气刀及双极电凝止血。于脾脏断面下方放置引流管,自左侧腋前线Trocar穿刺孔引出。切除的脾脏标本装袋后经向上延长的劈脐纵行切口取出送病理检查。
结 果
所有病人均于腹腔镜下完成脾脏部分切除,无中转开腹病例。手术时间为115~280 min,平均166.3 min。出血量为100~600 ml,均未输血。术后腹腔引流时间3~5 d,无腹腔出血、胰漏、腹腔感染等并发症。术后住院4~6 d。术后病理回报:3例为上皮性囊肿,3例为假性囊肿,2例为脾脏血管瘤,见表2。术后围手术期观察病人血小板计数变化,较术前有升高但均处于正常范围,所有病例均无血栓相关并发症出现,见表3。所有病例术后均复查腹部增强CT,与术前增强CT比较残留脾脏血供良好。其中1例位于脾脏下极的血管瘤病人术前CT、术中标本切面及术后CT见图1~3,另1例位于脾脏上极的囊肿病人术前及术后见图4~9。
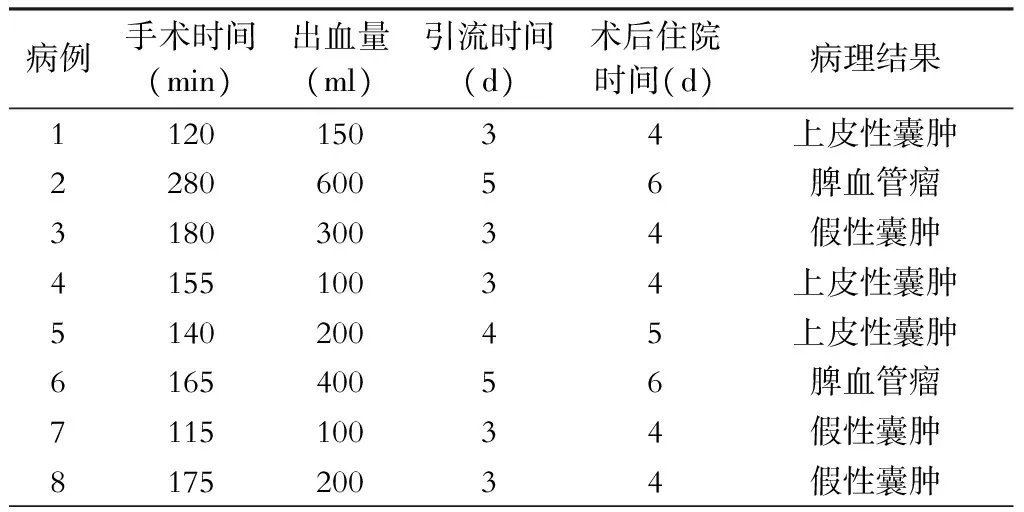
表2 8例脾脏肿瘤病人围手术期情况

表3 8例脾脏部分切除术病人围手术期
讨 论
脾脏良性肿瘤,如脾脏囊肿、脾脏血管瘤等,因其发病率低,且多无明显症状及体征,因此在过去的临床实践中检出率较低。随着人们健康体检意识的提高,腹部B超、CT等影像学检查开展得越来越普遍,脾脏良性肿瘤的检出率也不断提高。针对于此类疾病,尤其是肿瘤局限于脾脏上极或下极的病例,部分脾脏切除术是治疗的最佳方式。自Delaitre 等[6]于1991年完成了首例腹腔镜全脾切除术以后,腹腔镜技术开始应用于脾脏外科。Andrzej等[7]对10例非寄生虫性脾囊肿行部分脾切除术,认为术后脾静脉血流与术前基本一致。随着脾脏基础研究的发展以及对于脾脏免疫功能认识的深入,认为保留脾脏的25%以上,即可维持正常免疫功能[8]。近来的相关研究发现,部分脾切除可以保留一部分记忆性B细胞,而这些细胞所分泌的IgM在机体的抗感染免疫中起着关键作用[9]。这些实验研究为表明脾脏部分切除的必要性,为其提供了理论基础。而脾动脉在脾门处分支供应脾脏上极、下极及中段,这种分区段供血是脾脏部分切除术的解剖学基础。某些病人由于脾动脉的走行发生变异,根据血管的分布,脾脏可分为3~7段[10]。这也使部分脾切除术成为可能。而超声刀、腔镜血管闭合器的出现和应用,也为腹腔镜脾部分切除术提供了器械支持。超声刀切割精度高、凝血效果好、烟雾少、手术视野清晰,采用内镜血管切割器切断离断脾蒂,无需分离血管周围脂肪组织,方便省时[11]。
对于脾脏囊肿,手术绝对适应证为大的、有压迫症状和有破裂可能的囊肿以及寄生虫性和感染性囊肿[12]。一般认为囊肿直径大于5 cm就可以考虑手术治疗。手术的目的是清除囊肿,避免由囊肿引起的并发症,减少复发[13-14]。在本组病例中脾脏囊肿直径均大于5 cm,其中囊肿直径较大的病例已经出现临床症状,因此手术指征明确。与腹腔镜脾囊肿开窗术相比,脾脏部分切除更能防止囊肿的复发[15]。而大于5 cm脾脏血管瘤也是脾脏部分切除术的最佳适应证[16]。多中心的回顾性研究发现,血液系统疾病是也腹腔镜部分脾切除的主要手术适应证[17]。这些血液系统疾病主要包括:自身免疫性溶血性贫血、遗传性球形红细胞增多症、遗传性椭圆形红细胞增多症、免疫性血小板减少性紫癜、慢性粒细胞白血病等。对于脾脏外伤是否可行腹腔镜下脾切除术尚无明确定论,但应执行“先保命再保脾”的原则。但腹腔镜也作为一种探查手段,用尽可能减少损伤的方式明确病人腹腔情况,也决定最适合的手术方式,从而使脾脏的切除机会大为减少[18]。术前脾门血管影像学判断是手术成功的关键环节之一[19]。脾动脉在脾门处分支供应脾脏上极、下极及中段,因此,术前应对病人行腹部增强CT检查,通过CT影像可以评估肿瘤与脾门血管的关系,尤其要明确健侧脾脏的血供分支,以保证术后健侧脾脏有主干动脉或较大分支的供血,不会发生缺血性坏死。腹腔镜下全脾切除通常是在胰腺上缘分离出脾动脉主干进行结扎及阻断,对于部分脾切除术,由于要保留健侧脾脏血供,术中要求在脾门处分离,以明确供应脾脏上极、下极分支血管的位置,此处血管分支多且细,稍不注意就可能引起出血,影响术野甚至导致中转开腹。因此,需要术者对脾门血管的解剖了解细致,仔细分离。在早期病例中,我们对患侧血管分支进行逐一分离,每支血管分离后用可吸收或Hem-o-lok夹闭后离断。后期病例则在脾门上下极之间无血管区,即“二级脾蒂”处进行简单分离,然后应用腔镜下切开闭合器对病侧血管蒂进行切开、闭合和离断。诚然,使用切开闭合器处理患侧血管蒂,确实减少了外科医生的手术成就感,但明显缩短了手术时间,并减少术中出血量。所以,我们推荐在行腹腔镜脾部分切除术时应用切开闭合器离断患侧血管。对于脾脏上极切除的病例,对胃短血管的处理非常重要,因为仅将脾动脉上极支离断,胃短血管仍会提供部分血运至脾上极,此时贸然进行切除会增加出血机会,应将胃短血管全部离断,患侧脾脏缺血线明确后再进行切除。术中需观察健侧脾脏血供情况,在明确健侧脾脏血供良好时才能结束手术。同时,在手术中要确立“及时止血”的观点,即对所有出血,哪怕只是小面积渗血,也要及时、确实止血,因为腹腔镜手术对术野要求很高,加上腔镜本身的放大作用,一旦有出血就会对术野造成影响,而频繁的镜头擦拭不但增加手术的时间,而且术者要不断重新适应监视画面,影响手术操作。因此,操作细致,及时止血是手术顺利完成的良好保障。我们的进镜Trocar均采取紧贴脐下纵行1 cm切口,在手术结束标本装袋后,此切口向上延长劈开肚脐取出标本,再采取整形缝合修复肚脐,利用脐环的收缩特性使得切口外观不明显,达到了隐瘢痕的效果,受到了年轻女性病人的欢迎。
脾脏具有滤过和清除衰老血小板的功能。全脾切除24 h后即有血小板回升,一般于术后1~2周达高峰即是血栓形成的高发期,最常见的是门静脉的栓塞,亦可发生于视网膜动脉、肠系膜动静脉等部位,引起相应的临床表现[20]。这与血小板升高及高凝状态,全脾切除后脾静脉残端形成一盲袋,门静脉血流量减少、血流缓慢,局部静脉壁损伤均有关[21]。脾脏部分切除术可以保留脾脏的生理功能,在本组病例中,无一例出现血小板的明显变化或是血栓栓塞并发症的发生,这与全脾切除术相比优势明显。
我们的经验表明,对于局限于脾脏上、下极的良性肿瘤,进行腹腔镜脾部分切除术是安全可行的,不仅保留了脾脏功能,也达到了微创效果。
(本文图1~9见封二)
1 潘思波,车斯尧,黎福良,等.脾切除后暴发性感染2例.中国现代普通外科进展,2014,17:783.
2 Morgan TL,Tomich EB.Overwhelming post-splenectomy infection (OPSI): a case report and review of the literature. J Emergency Medicine,2012,43:758-763.
3 乔海泉,姜洪池,代文杰.部分脾切除术.医师进修杂志,1999,22:20-21.
4 Wang J,Yu JC,Kang WM.Laparoscopic partial splenectomy for giant hemangioma misdiagnosed as splenic cyst:A case report. Chin Med Sci J,2010,25:189-192.
5 Corcione F,Pirozzi F,Aragiusto G,et al.Laparoscopicsplenectomy:experience of a single center in a series of 300 cases.Surg Endosc,2012,26:2870-2876.
6 DelaitreB,Maignien B,Icard P.Laparoscopic splenectomy.Br J Surg,1992,79:1334.
7 Szczepanik AB,Meissner AJ.Partial splenectomy in the management of nonparasitic splenic cysts.World J Surg,2009,33:852-856.
8 史炼钢,贾友鹏,肖在鹏,等.保留脾脏的胰体尾肿瘤切除术的应用探讨.中华普通外科学文献:电子版,2012,6:210-213.
9 Tracy ET,Haas KM,Gentry T,et al.Partial splenectomy but not total splenectomy preserves immunoglobulin M memory B cells in mice.J Pediatr Surg,2011,46:1706-1710.
10Ignjatovic D,Stimec B,Zivanovic V.The basis for splenic segmental dearterialization: a post-mortem study.Surg Radiol Anat, 2005,27:15-18.
11何前进,毛伟明,易茂林,等.腹腔镜脾切除术八例.腹部外科, 2012,25:254-255.
12张澜波,李勇,李通.成人脾囊肿外科治疗.北京医科大学学报,1995,27:225-226.
13武振,姚琪远. 腹腔镜治疗非寄生虫性脾囊肿3例附文献复习.腹腔镜外科杂志,2011,16:196-199.
14朱小勇,李鹏,胡晓,等.脾巨大囊肿一例报道.腹部外科,2013,26:301.
15陈焕伟,王峰杰,邓斐文,等.腹腔镜部分脾切除治疗脾囊肿2例报告并文献复习.中华腔镜外科杂志(电子版),2014,7:49-51.
16Petroianu A,Teixeira BC,de Alencar LF.Partial splenectomy for treatment of splenic hemangioma.Chirurgia (Bucur),2009,104:483-486.
17Héry G,Becmeur F,Méfat L,et al.Laparoscopic partial splenectomy:Indications and results of a multicenter retrospective study.Surg Endosc,2008,22:45-49.
18陈双,周军.重视外伤性脾保留手术.中华普通外科学文献:电子版,2008,2:446-448.
19褚海波,张廷国. 脾脏外科的微创时代——腹腔镜保脾术. 腹腔镜外科杂志,2013,18:881-885.
20汪大伟,姜洪池.脾切除术后并发症及处理.腹部外科,2012,25:7-8.
21陈国富,范国华. 脾切除术后门静脉系统血栓形成的临床分析.中国普外基础与临床杂志,2012,19:649-652.
Laparoscpic partial splenectomy: Report of 8 cases
PanFei,LangRen,YuLiang,ZhangTao.
DepartmentofHepatobiliarySurgery,BeijingChaoyangHospital,Beijing100020,China
LangRen,Email:dr-langren@hotmail.com
Objective To discuss the security of operation of laparoscopic partial splenectomy. Methods Medical records of 8 patients with benign splenic tumor were reviewed retrospectively. The patients were diagnosed with CT or MRI and treated with laparoscopic partial splenectomy in our hospital from January 2009 to August 2014. The diameter of the tumors ranged from 5.2 to 9.1 cm (mean, 6.9 cm). In operation, pneumoperitoneum was established through the inferior umbilical fold with Veress insufflation needle. The upper pole or anus perineum blood vessels were isolated and clipped at the hilum of spleen. The spleen was removed partially from ischemia line. Results All of the 8 operations were completed by laparoscopy, and no patient converted to open operation. Duration of operation was from 115 to 280 min (mean, 166.3 min). Intraoperative blood loss was from 100-600 mL. After the procedure, abdominal drainage was maintained for 3 to 5 days. The hospital stay of the patients was 4 to 6 days. None of them had pancreatic injury, pancreatic fistula, hemorrhage, or abdominal infection. Conclusions Laparoscopic partial splenectomy is safe to treat benign splenic tumors.
Laparoscopy; Partial splenectomy; Spleen function; Benign splenic tumors
100020 北京,首都医科大学附属北京朝阳医院肝胆外科
郎韧,Email:dr-langren@hotmail.com
R657.6
A
10.3969/j.issn.1003-5591.2015.06.011
2015-10-14)
