血小板/淋巴细胞比值与胃癌分期及转移情况关系的临床研究
2015-06-10胡逸林李勇沈雁兵
胡逸林 李勇 沈雁兵
·论 著·(临床研究)
血小板/淋巴细胞比值与胃癌分期及转移情况关系的临床研究
胡逸林 李勇 沈雁兵
目的 探讨高血小板/淋巴细胞比值与胃癌分期及转移情况的关系,为胃癌生物学行为的早期预测寻找新的指标。方法 回顾性的收集自2010年1月至2014年12月行手术治疗的456例胃癌病人的临床资料。记录病人的年龄、性别、肿瘤位置(贲门癌、胃体癌、胃窦癌、残胃癌)、分期(早期/进展期)、转移情况(有/无)、组织病理特征(腺癌、印戒细胞癌、黏液腺癌、其他类型癌)、TNM分期、术前24 h血常规指标等资料。按肿瘤分期及转移情况分别对病人进行分组,比较组间病人一般资料及血小板/淋巴细胞比值(PLR)的差异。结果 本次研究共纳入胃癌病人456例,其中早期胃癌(EC)65例(14.3%),进展期胃癌(AC)391例(85.7%);有远处转移(M1)145例(31.8%),无远处转移(M0)311例(68.2%)。EC与AC相比,M0与M1相比,病人年龄分布、性别构成、肿瘤发生位置及组织学类型相比,组间差异无统计学意义(P值均>0.05),与AC组相比,EC组病人术前24 h PLR相对较低(160.33±71.52比231.64±107.52),组间差异有统计学意义(t=2.43,P<0.01),与M1组相比,M0组病人术前24 h PLR相对较低(205.61±107.44比251.02±94.83),组间差异有统计学意义(t=3.14,P<0.001)。PLR预测早期胃癌与进展期胃癌的ROC曲线下面积为0.68(P<0.001, 95%CI为0.62~0.74),在PLR=190时其敏感性和特异性分别为74.7%和67.7%;PLR预测转移胃癌与无转移胃癌的ROC曲线下面积为0.79(P<0.001, 95%CI为0.74~0.84),在PLR=215时其敏感性和特异性分别为73.0%和63.4%。结论 术前PLR与胃癌病人的临床分期及是否发生远处转移有关,高PLR值多提示胃癌病人可能处于疾病进展期或已发生远处转移,且PLR=190、215可能是预测进展期胃癌和合并远处转移胃癌的临界值。
血小板/淋巴细胞比值;胃癌;临床分期;远处转移
当前,在多数发展中国家,胃癌依然是常见的导致病人死亡的消化道肿瘤之一,由此而带来的社会经济负担仍然是亟待解决的社会问题[1-2]。国内季加孚教授[3]撰文指出,我国早期胃癌的检出率尚不足10%,而韩国和日本分别达到30%和50%。2007年一项涉及上海10家医院早期胃癌检出率的调查结果显示,该地区的胃癌总体检出率为2.01%,且其中早期胃癌的检出率仅为9.61%,因此,我国胃癌的诊疗仍处于较低水平[4-5]。以上数据集中反映的问题是我国胃癌总体检出率较低,且检出的胃癌病人当中多数为进展期胃癌。进展期胃癌的预后较差,相关研究报道结果显示,虽经严格根治性手术治疗,但其局部复发率仍在50%以上,长期生存率不足30%。因此,如何有效提高进展期胃癌的诊疗水平是改善我国胃癌病人预后的有效措施。尽管当前胃癌生化标志物众多[6],但一种简便、可稳定预测病人肿瘤临床进展特征的生化标志物对病人预后判断和治疗方案的选择具有重要意义[7]。相关研究结果已经证实血小板/淋巴细胞比值与食管癌、乳腺癌等恶性肿瘤的生物学行为有关[8-10],本研究拟探讨其与胃癌临床分期及转移情况关系。
资料与方法
一、一般资料
本次研究共纳入自2010年1月至2014年12月于我科就诊,并行手术治疗的胃癌病人487例。病人纳入标准:诊断明确的胃癌病人。排除标准为:①近2个月内曾接受输血治疗;②病人合并有活动性出血或凝血功能障碍;③合并感染性疾病;④正在接受抗凝治疗;⑤合并其他器官恶性疾病;⑥正在接受免疫抑制治疗或合并血液系统疾病。按照上述纳入排除标准,31例病人被排除,最终456例病人纳入本次研究。其中男性323例,女性133例,平均年龄(64.5±12.7)岁,接受D1以上根治性手术314例,姑息性手术142例。
二、方法
1.肿瘤分期标准 按照中国早期胃癌筛查及内镜诊治共识意见(2014·长沙)相关条款的规定,早期胃癌是指癌组织仅局限于黏膜层或黏膜下层,不论是否合并淋巴结转移,除早期胃癌之外的所有病理类型统称为进展期胃癌。
2.病人分组及观察指标 按照病人临床疾病分期及远处器官转移情况分别分为早期胃癌(early gastric cancer, EC)组、进展期胃癌(advanced gastric cancer, AC)组,转移组(M1)、无转移组(M0)。观察指标主要包括病人年龄分布、性别构成、肿瘤位置、肿瘤组织学类型、术前24 h血小板/淋巴细胞比值(platelet/lymphocyte ratio, PLR)。
三、统计学处理
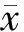
结 果
一、纳入病人的一般特征分析
本次研究共纳入胃癌病人456例,早期胃癌65例(14.3%),进展期胃癌391例(85.7%);有远处转移145例(31.8%),无远处转移311例(68.2%);贲门癌65例(14.3%),胃体癌157例(34.4%),胃窦癌226例(49.6%),残胃癌8例(1.8%);腺癌365例(80.0%),印戒细胞癌63例(13.8%),黏液腺癌15例(3.3%),其他类型癌13例(2.9%);TNM分期ⅠA期38例(8.3%),ⅠB期50例(11.0%),Ⅱ期52例(11.4%),ⅢA期74例(16.2%),ⅢB期60例(13.2%),Ⅳ期182例(39.9%)。
二、早期胃癌(EC)与进展期胃癌(AC)病人一般情况及术前24 h PLR比较
病人年龄分布、性别构成、肿瘤发生位置及组织学类型相比,组间差异无统计学意义(P均>0.05);与AC组相比,EC组病人术前24 h PLR相对较低,组间差异有统计学意义,见表1。
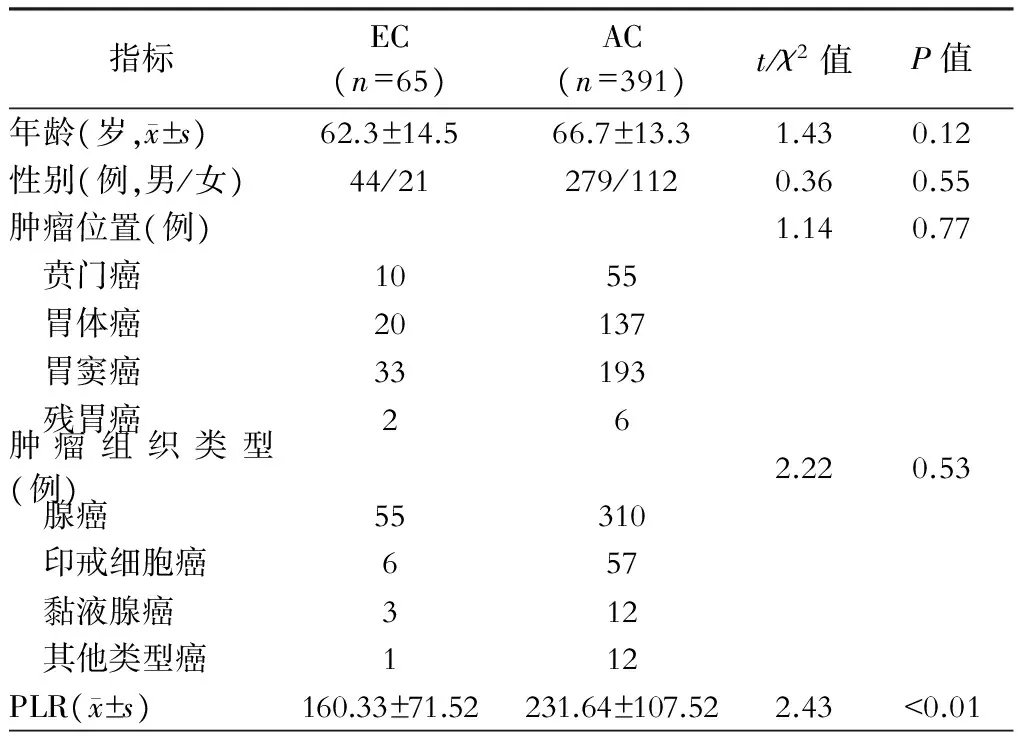
表1 早期胃癌(EC)与进展期胃癌(AC)病人一般情况及术前24 h PLR比较
三、转移胃癌(M1)与无转移胃癌(M0)病人一般情况及术前24 h PLR比较
病人年龄分布、性别构成、肿瘤发生位置及组织学类型相比,组间差异无统计学意义(P均>0.05);与M1组相比,M0组病人术前24 h PLR相对较低,组间差异有统计学意义,见表2。
四、PLR区分早期胃癌、进展期胃癌,有转移胃癌、无转移胃癌临界值的ROC分析
分别绘制PLR预测胃癌临床分期与远处转移的ROC曲线,结果显示PLR预测早期胃癌与进展期胃癌的ROC曲线下面积为0.68(P<0.001, 95%CI为0.62~0.74),在PLR=190时其敏感性和特异性分别为74.7%和67.7%;PLR预测转移胃癌与无转移胃癌的ROC曲线下面积为0.79(P<0.001, 95%CI为0.74~0.84),在PLR=215时其敏感性和特异性分别为73.0%和63.4%,见图1、2。

图1 PLR预测早期胃癌与进展期胃癌的ROC曲线

图2 PLR预测胃癌发生远处转移的ROC曲线
讨 论
当前世界范围内,多数胃癌病人检出时已处于疾病进展期或合并远处转移,虽然伴随外科手术的发展和肿瘤多学科诊疗技术的进步,包括胃癌在内的多种恶性肿瘤的临床预后已经较前大大改善,但因胃癌所致的肿瘤相关性死亡仍在12%以上,居所有恶性肿瘤相关性死亡的第二位[11]。而早期胃癌经及时有效治疗,其5年生存率高,在90%以上,基于这一情况,学者们努力寻找一种简便、无创、稳定且与肿瘤生物学行为关系密切的早期预测肿瘤分期与远处转移情况的指标。相关研究结果已经证实血小板/淋巴细胞比值与食管癌、乳腺癌等恶性肿瘤的生物学行为有关[8-10]。而本研究结果显示,术前24 h PLR与胃癌生物学行为有关,进展期胃癌、合并远处转移的胃癌病人其PLR水平较早期胃癌和无远处转移胃癌病人高,组间差异有统计学意义(P<0.05),且分别以PLR=190、215作为预测进展期胃癌和合并远处转移胃癌的临界值具有较好的敏感性和特异性。
虽然肿瘤所致的炎症反应和亚临床凝血功能异常的确切机制尚不确定,但相关研究已有充分证据证明二者之间存在一定程度上的联系。
肿瘤细胞在生长过程中可产生多种炎症因子和生长因子,进而激发免疫抑制介质的产生和释放[12]。肿瘤细胞所产生的促炎因子IL-1、IL-3和IL-6有促进巨核细胞增殖分化的作用[13],而作为巨核细胞增殖产物的血小板也相应升高;同时,肿瘤细胞释放的IL-10和TGF-β则具有明显的免疫抑制作用,可引起病人淋巴细胞计数降低[14]。血小板计数升高是机体在炎症反应和罹患恶性肿瘤状态下典型的血常规指标变化之一[15-16],血小板的激活是恶性肿瘤的自然发展过程,通过促进肿瘤血管生成、细胞外基质降解、释放黏附分子和生长因子这些重要的成分促进肿瘤的生长和转移[17]。在正常情况下,血小板 / 淋巴细胞是保持相对的动态平衡。但是一旦血小板/淋巴细胞的动态平衡被打破,血小板相对上升,淋巴细胞相对减少,意味着机体的正常免疫功能被破坏,抵抗肿瘤的能力下降,从而影响病人预后。血小板增多和淋巴细胞计数减少与胃癌病人不良临床结局有关,可作为病人预后不良的预测指标[18]。一方面肿瘤细胞产生和释放的促炎因子可上调血液中血小板水平,另一方面,血小板所产生的活性介质可促进肿瘤微环境内的血管生成、加速肿瘤生长、抑制肿瘤细胞凋亡[19]。淋巴细胞减少与恶性肿瘤病人预后不良的机制主要与肿瘤细胞产生和释放的炎症介质有下调辅助性T4淋巴细胞、上调异质性T8淋巴细胞,最终通过抑制机体先天性细胞免疫功能而抑制肿瘤的生长、扩散有关[20]。
综上所述,本研究结果表明,基于肿瘤炎症微环境理论建立的PLR评价体系与胃癌的临床分期及是否发生远处转移有关,高PLR值多提示胃癌病人可能处于疾病进展期或已发生远处转移,且PLR=190、215可能是预测进展期胃癌和合并远处转移胃癌的临界值,在临床相关辅助检查选择及治疗方案的制定过程中可作为一种参考指标。
1 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002.CA: Cancer J Clin,2005,55:74-108.
2 于杰,龚治林.胃癌术后早期炎症与肠道黏膜通透性的关系.腹部外科,2010,23:361-362.
3 季加孚,孟化.胃癌的早期诊断.腹部外科,2006,19:262-265.
4 胡凯,沈世强,郑勇斌.快速康复外科在胃癌手术中的应用.腹部外科,2009,22:350-352.
5 上海市早期胃癌临床协作组.上海不同等级10个医疗机构早期胃癌的筛选结果比较.中华消化内镜杂志,2007,24:19-22.
6 Feng JF,Huang Y,Zhao Q,et al.Clinical sig -nificance of preoperative neutrophil lymphocyte ratio versus platelet lymphocyte ratio in patients with small cell carcinoma of the esophagus.Sci World J,2013,2013:504365.
7 Krenn-Pilko S,Langsenlehner U,Thurner EM,et al.The elevated preoperative platelet-to-lymphocyte ra -tio predicts poor prognosis in breast cancer patients.Br J Cancer,2014,110:2524-2530.
8 Hussein MR,Ahmed RA.Analysis of the mononuclear inflammatory cell infiltrate in the non-tumorigenic,pre-tumorigenic and tumorigenic keratinocytic hyperproliferative lesions of the skin. Cancer Biol Ther,2005,4:819-821.
9 Jaiswal M,LaRusso NF,Gores GJ.Nitric oxide in gastrointestinal epithelial cell carcinogenesis: linking in flammation to oncogenesis. Am J Physiol Gastrointest Liver Physiol,2001,281:G626-634.
10Kwon HC,Kim SH,Oh SY,et al.Clinical signifi -cance of preoperative neutrophil-lymphocyte versus platelet-lymphocyte ratio in patients with operable colorectal cancer. Biomarkers,2012,17:216-222.
11Pisani P,Parkin DM,Ferlay J.Estimates of the world wide mortality from eighteen major cancers in 1985.Implications for prevention and projections of future burden. Int J Cancer,1993,55:891-903.
12Salazar-Onfray F,Lopez MN,Mendoza-Naranjo A.Paradoxical effects of cytokines in tumor immune surveillance and tumor immune escape.Cytokine Growth Factor Rev,2007,18:171-182.
13Alexandrakis MG,Passam FH,Moschandrea IA,et al.Levels of serum cytokines and acute phase proteins in patients with essential and cancer-related thrombocytosis.Am J Clin Oncol,2003,26:135-140.
14Lee S,Oh SY,Kim SH,et al.Prognostic significance of neutrophil lymphocyte ratio and platelet lymphocyte ratio in advanced gastric cancer patients treated with FOLFOX chemotherapy.BMC Cancer,2013,13:350.
15Stone RL,Nick AM,McNeish IA,et al.Paraneoplastic thrombocytosis in ovarian cancer.N Engl J Med,2012,366:610-618.
16Wagner DD.New links between inflammation and thrombosis. Arterioscler Thromb Vasc Biol,2005,25:1321-1324.
17Kono SA,Heasley LE,Doebele RC,et al.Adding to the mix:fibroblast growth factor and platelet-derived growth factor receptor pathways as targets in non-small cell lung cancer.Curr Cancer Drug Targets,2012,12:107-123.
18Aliustaoglu M,Bilici A,Ustaalioglu BBO,et al.The effect of peripheral blood values on prognosis of pa-tients with locally advanced gastric cancer before treatment.Med Oncol,2010,27:1060-1065.
19Jain S,Harris J,Ware J.Platelets:linking hemostasis and cancer. Arterioscler Thromb Vasc Biol,2010,30:2362-2367.
20Fogar P,Sperti C,Basso D,et al.Decreased total lym-phocyte counts in pancreatic cancer:an index of adverse outcome.Pancreas,2006,32:22-28.
A clinical study of the relationship between platelet/lymphocyte ratio and staging, metastatic of gastric cancer
HuYilin,LiYong,ShenYanbing.
DepartmentofGeneralSurgery,WuhanGeneralHospitalofGuangzhouMilitary,Wuhan430070,China
Huyilin,Email:hylgfox@163.com
Objective To investigate the relationship between platelet/lymphocyte ratio (PLR) and staging, metastatic of gastric cancer, and to search a new biological marker for the early prediction of gastric cancer biological behavior. Methods The clinical data of 456 patients who were diagnosed as having gastric cancer and accepted surgery treatment from Jan. 2010 to Dec. 2014 were respectively collected. Patient age, sex, tumor location (cardia cancer, corpus cancer, antrum cancer, remnant cancer), stage (early/advanced), metastatic (M1/M0), histopathologic features (adenocarcinoma, signet ring cell, mucinous, miscellaneous), TNM staging and preoperative 24 h blood routine were recorded. Patients were grouped according to the tumor stage and metastatic respectively. The general information and platelet/lymphocyte ratio were compared. Results 456 patients were enrolled in this study finally, including 65 (14.3%) cases of early gastric cancer and 391 (85.7%) cases of advanced gastric cancer; 145 (31.8%) cases of distant metastasis and 311 (68.2%) cases without distant metastasis. There was no significance difference in age, gender, position and histological type between EC/AC and M1/M0 respectively (P>0.05 for all). The PLR value in EC group was significantly lower than in AC group (160.33±71.52 vs. 231.64±107.52,t=2.43,P<0.01). The PLR value in M0 group was significantly lower than in M1 group (205.61±107.44 vs. 251.02±94.83,t=3.14,P<0.001). The AUC of PLR to predict early and advanced gastric cancer was 0.68 (P<0.001, 95% CI:0.62-0.74), the sensitivity and specificity in PLR=190 were 74.7% and 67.7% respectively. The AUC of PLR to predict early and advanced gastric cancer was 0.79 (P<0.001, 95% CI:0.743-0.84), the sensitivity and specificity in PLR=190 were 73.0% and 63.4% respectively. Conclusions Preoperative PLR is associated with the clinical staging and metastasis of gastric cancer. High PLR values may indicate advanced cancer or distant metastasis, and PLR=190, 215 is likely to be the cut off value of predicting advanced gastric cancer and the existence of distant metastasis.
Platelet/lymphocyte ratio; Gastric cancer; Clinical stage; Metastasis
430070 武汉,广州军区武汉总医院普通外科
胡逸林,Email:hylgfox@163.com
R735.3
A
10.3969/j.issn.1003-5591.2015.06.021
2015-06-04)
