温度对大黄鱼源变形假单胞菌胞外产物酶活力的影响
2015-06-09覃映雪黄力行徐晓津鄢庆枇
周 琳,覃映雪,黄力行,马 英,徐晓津,林 茂,鄢庆枇
(1.集美大学水产学院,福建厦门 361021;2.农业部东海海水健康养殖重点实验室,福建厦门 361021)
温度对大黄鱼源变形假单胞菌胞外产物酶活力的影响
周 琳1,2,覃映雪1,2,黄力行1,2,马 英1,2,徐晓津1,2,林 茂1,2,鄢庆枇1,2
(1.集美大学水产学院,福建厦门 361021;2.农业部东海海水健康养殖重点实验室,福建厦门 361021)
为了研究大黄鱼源变形假单胞菌胞外产物的致病性,在内脏白点病的高发温度(18℃)培养大黄鱼的病原菌——变形假单胞菌,利用玻璃纸覆盖平板技术制备其胞外产物,测定不同温度(低温不致病温度12℃、高发致病温度18℃和高温不致病温度28℃)下其胞外产物的酶活力.结果显示:变形假单胞菌胞外产物的淀粉酶、丝氨酸蛋白酶类、天冬氨酸蛋白酶类、类胃蛋白酶、类糜蛋白酶、卵磷脂酶、酸性磷酸酯酶和碱性磷酸酯酶的活性受温度影响比较大,28℃条件下酶活力显著(P<0.05)高于12℃或者18℃时的酶活力;半胱氨酸蛋白酶类、氨肽酶的活性和溶血活性受温度影响没有显著性变化(P>0.05).实验结果表明,虽然变形假单胞菌胞外产物是其致病因素之一,但大黄鱼内脏白点病在特定温度(16~20℃)下高发并非是由于胞外产物在该温度下的活性较高.该结果增进了对大黄鱼内脏白点病发病机理的认识.
大黄鱼;变形假单胞菌;胞外产物;温度
0 引言
大黄鱼(Larimichthyscrocea)是中国最重要的海水养殖鱼类之一[1].近年来,网箱养殖大黄鱼的病害频发,特别是内脏白点病,已经成为网箱养殖大黄鱼的常见病害,且造成了巨大的经济损失[2].变形假单胞菌(Pseudomonasplecoglossicida)已被证明是闽东地区大黄鱼内脏白点病的病原菌[2-3].
病原菌的胞外产物(Extracellular products,ECP)是其在致病过程中释放出的生命代谢产物,作为侵染机体的主要成分之一,起决定病原菌毒力的重要作用[4].而温度因素作为环境因子中的重要成分之一,不仅与病原菌胞外产物的酶活性密切相关[5],还与细菌致病性相关蛋白的分泌关系密切[6].由变形假单胞菌引起的内脏白点病是一种典型的温度依赖性疾病,仅在水温16~20℃下爆发,当水温超过20℃时该病自然消退[2],但环境温度对大黄鱼源变形假单胞菌ECP酶活力的影响尚不清楚.本文拟在内脏白点病的高发温度(18℃)下培养大黄鱼的病原菌——变形假单胞菌,然后分离纯化其ECP,测定不同温度(低温不致病温度12℃、高发致病温度18℃、高温不致病温度28℃)下ECP的酶活力及溶血活性,以期增进对养殖大黄鱼内脏白点病的致病机理的认识.
1 材料和方法
1.1 实验菌株
变形假单胞菌NZBD11由本实验室分离自患内脏白点病的大黄鱼的病灶部位[2],保存于-80℃.
1.2 胞外产物的制备
变形假单胞菌胞外产物的制备参考Rojas等[7]的玻璃纸覆盖平板技术并略作修改,具体如下:将菌株活化后,洗涤并稀释,然后取20μL均匀涂布在表面覆有一层无菌玻璃纸的平板上,18℃培养48 h.每个平板再用4 mL 0.01 mol/L的无菌PBS(pH=7.4)洗下菌苔,在4℃、13000 r/min下离心30 min,取上清,置于-80℃冷冻,然后置于真空冷冻干燥机内冻干成白色或淡黄色粉末.用适量的无菌PBS充分溶解,高速离心后用0.22μm的滤膜过滤,再用考马斯亮蓝法测定其蛋白质含量,小量分装,置于-80℃保存备用.
1.3 胞外产物酶活力的测定
1.3.1 淀粉酶活力
淀粉酶活力的测定根据碘-淀粉比色法,将反应温度设成12,18,28℃,并按照南京建成生物工程研究所的淀粉酶测试盒说明书操作.将每毫克胞外产物与底物作用30 min水解10 mg淀粉定义为1个淀粉酶活力单位(n=4).
1.3.2 胞外蛋白酶活力
丝氨酸蛋白酶类、半胱氨酸蛋白酶类及天冬氨酸蛋白酶类酶活力的测定:将丝氨酸蛋白酶抑制剂苯甲基磺酰氟PMSF、半胱氨酸蛋白酶抑制剂碘乙酸和天冬氨酸抑制剂抑胃肽分别添加到胞外产物样品中,使它们的终浓度(或质量浓度)分别为100 mmol·L-1、100 mmol·L-1、2.5μg·mL-1[8],30~60min后利用Folin试剂显色法分别在反应温度为12,18,28℃下测定各蛋白酶类的酶活力.在波长660 nm下,用酶标仪测定各个样品的吸光度.其中除天冬氨酸蛋白酶类测定时底物缓冲液为酸性,余为中性.定义:每毫克胞外产物每分钟分解蛋白质生成1μg氨基酸相当于各蛋白酶类的1个酶活力单位(n=3).
类胃蛋白酶和类糜蛋白酶活力的测定根据Dai等[9]的方法,在反应温度为12,18,28℃下,采用南京建成生物工程研究所的试剂盒进行酶活力检测.定义:每毫克胞外产物每分钟分解蛋白质生成1μg氨基酸相当于类胃蛋白酶或类糜蛋白酶的1个酶活力单位(n=3).
氨肽酶活力的测定是以L-亮氨酸-4-硝基苯胺(LpNA)为底物进行测定的[10],具体操作为:取0.4 mL的胞外产物样品,然后加入6 mL 0.05 mol/L的Tris-Hcl缓冲液(pH=8.0),将其放入水浴中预热5 min,加入0.4 m L 25 mmol/L的LpNA的乙醇底物溶液,分别于12,18,28℃准确反应10 min,立即放入冰浴中,冷却5 min后,在405 nm处测定样品的吸光度.以双蒸水代替胞外产物样品作为对照.在pH=8.0下,每毫克胞外产物每分钟分解LpNA生成1μmol对硝基苯胺定义为一个氨肽酶活力单位(n=3).
1.3.3 磷酸酯酶活力
酸/碱性磷酸酯酶的活力都是以对硝基苯磷酸二钠(pNPP-Na)为底物来进行测定[11].磷酸酯酶活力反应体系的总体积为5mL,其中包括1mL 5mmol·L-1的pNPP-Na底物、1mL 10 mmol·L-1的MgSO4及3 mL 0.2 mol·L-1且pH值为5.0的HAc-NaHc缓冲液(含0.1 mol·L-1、pH=10.1的Na2CO3-NaHCO3),分别于12,18,28℃水浴预热5 min,然后加入100μL的胞外产物样品,准确反应10 min,用2.5 mL的0.2 mol·L-1NaOH终止反应,在420 nm处测定样品的吸光值,以双蒸水代替胞外产物样品作为对照.在pH=5.0下,每毫克胞外产物每分钟分解pNPP-Na生成1μmol对硝基苯酚定义为一个酸性磷酸酯酶活力单位(n=3);在pH=10.1下,每毫克胞外产物每分钟分解pNPP-Na生成1μmol对硝基苯酚定义为一个碱性磷酸酯酶活力单位(n=3).
1.3.4 卵磷脂酶活力
用蒸馏水分别配制无菌的蛋黄液(体积分数为2.5%)琼脂平板若干,在已经打孔后的琼脂平板上分别加入20μL已制备的胞外产物样品,用等量的生理盐水(体积分数为0.85%)作为阴性对照.分别于12,18,28℃恒温箱内培养48 h,测量孔直径(d)和不透明晕圈(D)的大小.通过比较每毫克胞外产物形成的不透明晕圈D与孔直径d的比值大小来判断胞外产物卵磷脂酶活力(n=3)的强弱.比值越大,则胞外产物中的酶活力越强.
1.4 溶血活性测定
制备1%(体积分数)的绵羊血红细胞.用无菌的PBS缓冲液分别对等量的胞外产物样品作2倍系列稀释处理,即1∶2~1∶1024.以不加任何物质的红细胞稀释为自然溶血对照,以无菌双蒸水稀释的红细胞悬液为100%对照.取100μL的绵羊血红细胞悬液,分别依次加入已经倍比稀释的100μL胞外产物样品,充分混匀,分别于12,18,28℃水浴1 h,4℃过夜;振荡,4000 r/min离心10min;取上清液,在545 nm处测定样品的吸光度(n=3).
1.5 数据统计
实验所得数据均利用SPSS 17.0软件进行统计分析,根据单因素方差检验进行比较,P<0.05表示差异显著,P>0.05表示差异不显著.
2 结果
2.1 温度对变形假单胞菌ECP淀粉酶活力的影响
由图1可知,变形假单胞菌ECP具有一定的淀粉酶活力,并且其活力受温度影响.具体表现为:18℃和28℃条件下淀粉酶的活力显著(P<0.05)高于12℃时的酶活力;虽然28℃时测得的淀粉酶活力略高于18℃的,但两者之间没有显著性差异(P>0.05).
2.2 温度对变形假单胞菌ECP蛋白酶活力的影响
如图2所示,变形假单胞菌ECP具有一定的丝氨酸蛋白酶类、半胱氨酸蛋白酶类、天冬氨酸蛋白酶类的酶活力及类胃蛋白酶、类糜蛋白酶、氨肽酶的酶活力,且丝氨酸蛋白酶类、半胱氨酸蛋白酶类及天冬氨酸蛋白酶类的酶活力明显要大于类胃蛋白酶、类糜蛋白酶和氨肽酶的酶活力.
图2a和图2d表明,18℃条件下,丝氨酸蛋白酶类和类胃蛋白酶活力都略高于12℃时的酶活力,但是没有达到显著性差异(P>0.05);28℃条件下这两类酶的酶活力显著(P<0.05)高于18℃时的酶活力.
图2b表明,变形假单胞菌ECP具有一定的天冬氨酸蛋白酶类的酶活力,并且其活力受温度的影响.具体表现为:18℃条件下天冬氨酸蛋白类酶活力显著(P<0.05)高于12℃时的酶活力;28℃条件下的酶活力也显著(P<0.05)高于18℃时的酶活力.
图2c和图2f表明,半胱氨酸蛋白酶类和氨肽酶在12,18,28℃条件下的酶活力差异不显著(P>0.05);28℃下这类蛋白酶类的酶活力也高于18℃时的酶活力,但差异依然不显著(P>0.05).
图2e中,类糜蛋白酶28℃时的酶活力显著(P<0.05)高于12℃时的酶活力.
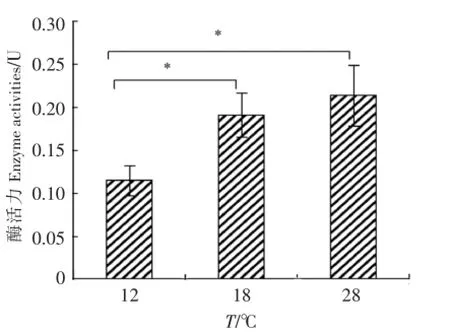
图1温度对变形假单胞菌ECP淀粉酶酶活力的影响(n=3)Fig.1 E ffectof tem perature on the am y lase activities of ECP of P.p lecoglossicida(n=3)
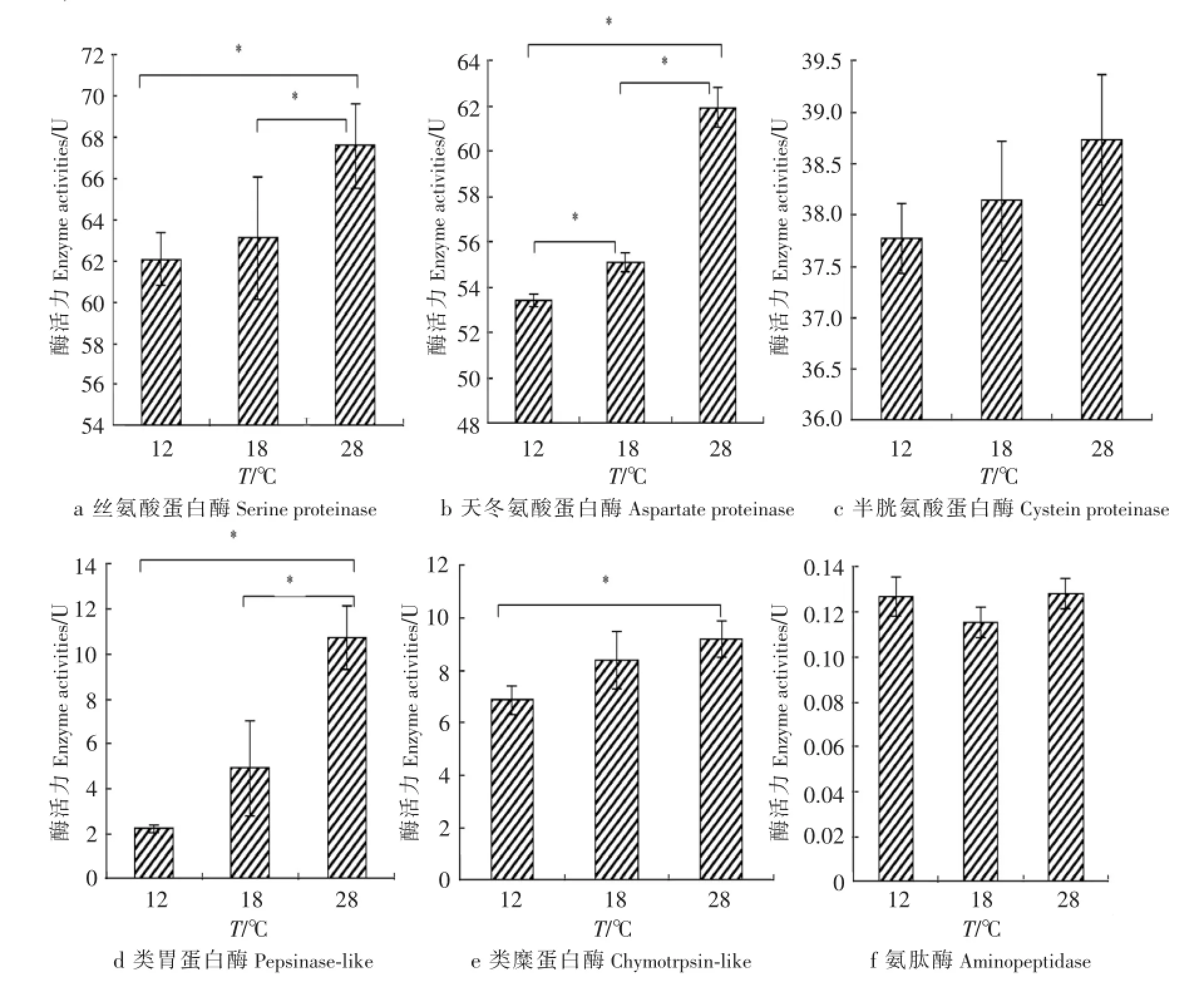
图2温度对变形假单胞菌ECP蛋白酶活力的影响(n=3)Fig.2 Effectof tem perature on the proteinase activities o fECP of P.plecog lossicida(n=3)
2.3 温度对变形假单胞菌ECP磷酸酯酶活力的影响
如图3a所示,变形假单胞菌ECP具有一定的酸性磷酸酯酶活力,并且其活力受温度的影响.具体表现为:18℃条件下酸性磷酸酯酶活力显著(P<0.05)高于12℃时的酶活力;28℃条件下的酶活力显著(P<0.05)高于18℃时的酶活力.由图3b可知,变形假单胞菌ECP具有一定碱性磷酸酯酶活力,并且其活力受温度的影响.具体表现为:28℃时测定的碱性磷酸酯酶活力显著(P<0.05)高于12℃和18℃时的酶活力;12℃和18℃温度下两者之间的酶活力差异不显著(P>0.05).
2.4 温度对变形假单胞菌ECP卵磷脂酶活力的影响
如图3c显示,18℃和28℃条件下卵磷脂酶活力显著(P<0.05)高于12℃时的酶活力;虽然28℃时测得的卵磷脂酶活力略高于18℃时的,但两者之间没有显著性差异(P>0.05).
2.5 温度对变形假单胞菌ECP溶血价的影响
在温度对溶血价大小的影响实验中,变形假单胞菌ECP对无菌脱纤维绵羊红细胞的溶血性很微弱,溶血价都接近1∶2,而且都没有显著性差异(P>0.05).
3 讨论
温度不仅与病原菌胞外产物酶蛋白的表达调控密切相关[6],还与胞外产物酶活性有关[5].许多溶藻弧菌、鳗弧菌、海豚链球菌、嗜水气单胞菌等致病菌的胞外产物研究都探讨了环境因素对胞外产物酶活性的影响[5-6,12-13].魏玉西等[14]在温度对鳗弧菌胞外蛋白酶活性的影响实验中表明蛋白酶活性在40~60℃比较稳定,最适反应温度为60℃;左凤琴等[13]在研究鱼源溶藻弧菌的胞外蛋白酶最适温度为50℃,对热稳定性较差.以上这些研究均表明致病菌的胞外产物酶活性受环境因素的影响,且最适反应温度都在50~60℃范围内.由于这些文献的研究温度都超出水产养殖的水温范围,而本文是研究变形假单胞菌的ECP在养殖水温下的作用,因此本文的温度设置为低温不致病温度12℃、高发致病温度18℃和高温不致病温度28℃.
本研究在不同培养温度(12,18,28℃)来源的变形假单胞菌胞外产物酶活力检测实验中发现,来源于18℃培养温度的胞外产物中的半胱氨酸蛋白酶类、天冬氨酸蛋白酶类、丝氨酸蛋白酶类、类胃蛋白酶、卵磷脂酶和类糜蛋白酶活力显著(P<0.05)高于来源于12℃和28℃培养温度的酶活力,说明这些胞外产物酶活性可能与变形假单胞菌的毒性密切相关.但是之前的结果无法说明这种差异是因为变形假单胞菌在不同温度下酶蛋白表达差异造成的,或者是温度对酶活性的影响造成的,因此有必要进行12,18,28℃这三个温度对胞外产物酶活力影响的研究.
本文研究结果显示,在温度12,18,28℃条件下,半胱氨酸蛋白酶类酶活性、氨肽酶活性和溶血活性随温度的升高没有显著性变化,说明氨肽酶活性和溶血活性受环境温度影响不大,而淀粉酶、丝氨酸蛋白酶类、天冬氨酸蛋白酶类、类胃蛋白酶、类糜蛋白酶、卵磷脂酶、酸性和碱性磷酸酯酶的活性随温度的升高总体呈现上升的趋势.大黄鱼蛋白质含量高,而且蛋白质组成机体许多重要结构并参与大部分的新陈代谢,如果大黄鱼机体的蛋白质被微生物所降解,势必造成机体的功能障碍.磷脂构成细胞的膜结构,如果被降解,也会影响细胞功能甚至引起死亡.在变形假单胞菌的胞外产物中,丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶和卵磷脂酶活力较高,说明这些酶可能在变形假单胞菌的致病过程中起作用.虽然变形假单胞菌ECP中有多种酶的活性,但绝大部分酶在发病温度(18℃)并没有表现出比不发病温度(12℃和28℃)更高的活力,这说明大黄鱼内脏白点病的发生机理很复杂,不局限于ECP的酶活力.具体致病机理有待于进一步的研究.
4 结论
变形假单胞菌胞外产物具有多种酶活性,是其致病因素之一.变形假单胞菌的胞外产物在发病温度(18℃)并没有表现出比不发病温度(12℃和28℃)更高的酶活性.变形假单胞菌胞外产物在致病过程中的具体作用有待于进一步的研究.
[1]CHIC F,HU FY,WANG B,etal.Purification and characterization of three antioxidant peptides from protein hydrolyzate of croceine croaker(Pseudosciaenacrocea)muscle[J].Food Chemistry,2015,168:662-667.
[2]胡娇,张飞,徐晓津,等.大黄鱼(Pseudosciaenacrocea)内脏白点病的病原分离鉴定及致病性研究[J].海洋与湖沼,2014,45(2):409-417.
[3]MAO Z J,LIM F,CHEN JG.Draft genome sequence ofPseudomonasplecoglossicidastrain NB2011,the causative agent ofwhite nodules in large yellow croaker(Larimichthyscrocea)[J].Genome Announc,2015,1:e00586-13.
[4]覃映雪,苏永全,王军,等.哈维氏弧菌TS-628菌株胞外产物(ECP)蛋白酶活性的研究[J].海洋水产研究,2008,29(1):81-85.
[5]张旭丽.罗非鱼海豚链球菌疫苗研制及胞外产物特性分析[D].湛江:广东海洋大学,2010:1-54.
[6]BISNO A L,BRITOM O,COLLINSCM.Molecular basis of group a streptococcal virulence[J].The Lancet Infectious Diseases,2003,3:191-200.
[7]ROJASR,MIRANDA C D,OPAZO R,et al.Characterization and pathogenicity ofVibriosplendidusstrains associated with massivemortalities of commercial hatchery-reared larvae of scallopArgopectenpurpuratus(Lamarck,1819)[J]. Journal of Invertebrate Pathology,2015,124:61-69.
[8]WON K M AND PARK I.Pathogenicity ofVibrioharveyito cultured marine fishes in Korea[J].Aquaculture,2008,285:8-13.
[9]DAIY,WANG T T,WANG YF,et al.Activities of digestive enzymes during embryonic development in the crayfishProcambarusclarkia(Decapoda)[J].Aquaculture Research,2009,40:1394-1399.
[10]WANG P,ZHANG X,ZHANG J.Molecular characterization of fourm idgutaminopeptidase nisozymes from the cabbage looper,Trichoplusiani[J].Insect Biochemistry and Molecular Biology,2005,35:611-620.
[11]杨立红,高兴喜,缪静,等.斑玉蕈酸性磷酸酯酶的酶学性质研究[J].菌物学报,2011,30(5):744-752.
[12]潘厚军,石存斌,刘瑞明,等.鳜嗜水气单胞菌GYK1株胞外产物提取、纯化及生物学活性分析[J].南方水产,2006,2(3):1-6.
[13]左凤琴,简纪常,吴灶和.鱼源溶藻弧菌胞外产物的特性研究[J].水生生物学报,2006,30(5):553-558.
[14]魏玉西,汪靖超,程殿林,等.鳗弧菌(Vibrioanguillarum)胞外产物中蛋白酶的纯化及其性质[J].应用与环境生物学报,2002,8(4):414-418.
(责任编辑 朱雪莲 英文审校 张子平)
Effect of Tem perature on the Enzyme Activity of Extracellular Products of Peseudomonas plecoglassicida Isolated from Larim ichthys crocea
ZHOU Lin1,2,QIN Ying-xue1,2,HUANG Li-xing1,2,MA Ying1,2,XU Xiao-jin1,2,LIN Mao1,2,YAN Qing-pi1,2
(1.Fisheries College,Jimei University,Xiamen 361021,China;2.Key Laboratory of Healthy Mariculture for the East China Sea,Ministry of Agriculture,Xiamen 361021,China)
In order to study the pathogenicity of ECP fromPeseudomonasplecoglassicida,theP.plecoglassicidawere cultured at high pathogenic temperature and its ECPwas prepared by the cellophane plate technique.The enzyme activities of ECPweremeasured at different temperatures(hypothermy nonpathogenic temperature 12℃,high pathogenic temperature 18℃and hyperthermy nonpathogenic temperature 28℃). The results showed that the activities of amylase,serine proteinase,aspartate proteinase,pepsinase-like,chymotrpsin-like,lecithinase,acid phosphatase and alkaline phosphatase of ECP ofP.plecoglassicidawere affected by temperature notably,and at28℃their activitieswere significantly higher than at12℃or 18℃(P<0.05)while the enzymatic activities of cysteine proteinase,aminopeptidase and hemolysis activity were not significantly changed(P>0.05).The results of this paper revealed thatP.croceavisceralwhite spot dis-ease had high incidence at specific temperature interval(16~20℃)notbecause ECP possess higher activity at this temperature interval although the ECP is one of the pathogenic foctors.The research results of this paper could improve the understanding of pathogenesis ofP.croceavisceral white spot disease.
Larimichthyscrocea;Peseudomonasplecoglossicida;extracellular products;temperature
S 941.42
A
1007-7405(2015)05-0333-06
2015-03-31
2015-06-01
国家自然科学基金项目(31272699,31272669,31202030);海洋经济区域创新发展示范项目(14PYY050SF03);厦门南方海洋研究中心项目(14CZP032HJ06);厦门市科技项目(3502Z20133016);厦门市海洋与渔业局科技项目(201357)
周琳(1989—),女,硕士,从事微生物学方向研究.通信作者:鄢庆枇(1971—),男,教授,从事微生物学方向研究.E-mail:yanqp@jmu.edu.cn.
