ASPP2表达对食管癌术后疗效评价意义的研究
2015-06-09李东田洪超李树臣牛凤英殷培伟
李东 田洪超 李树臣 牛凤英 殷培伟
(山东新泰第二人民医院 山东新泰 271219)
ASPP2表达对食管癌术后疗效评价意义的研究
李东 田洪超 李树臣 牛凤英 殷培伟
(山东新泰第二人民医院 山东新泰 271219)
目的:探讨ASPP2在食管癌术后患者中的表达水平及意义,证实ASPP2对食管癌术后疗效评价的可行性。探讨ASPP2在食管癌组织转变过程中的分子作用机制,ASPP2表达与食管癌患者术后疗效的关系。方法:采用免疫组化方法检测45例食管癌、20例食管良性瘤及20例正常食管组织中ASPP2、P53的表达水平。进一步分析ASPP2、P53的表达与食道癌临床病理特征的关系。采用Spearman等级相关的方法,对ASPP2、P53的表达水平进行相关性分析。结果:三组标本组织中ASPP2、P53的表达水平比较P<0.05,具有显著性差异。结论:食管癌组织中ASPP2表达显著下降,P53水平明显增高,ASPP2、P53的表达与食管癌的直径侵袭和淋巴结转移有关,ASPP2、P53的异常表达是食管癌发生和发展的重要因素,ASPP2是判断食管癌术后疗效的较好指标。
食管癌;ASPP2;P53;基因;疗效
食管癌(esophageal cancer)是全球内发病率极高的恶性肿瘤,占全世界食管癌死亡例数的50%以上[1]。5年生存率仅为10%-15%[2]。食管癌术后5年生存率仅为25%左右,那么怎样才能够让食管癌患者术后预后有一良好的评价方法成为研究热点[3]。ASPP2是一个新的蛋白质家族,具有促进凋亡的作用,特异性地增强p53等细胞凋亡功能,ASPP2能与p53结合并特异性增强p53与促凋亡基因启动子的结合,从而促进细胞凋亡。本研究对此进行研究来证实ASPP2异常表达与食管癌术后转移、发展密切相关,可以成为食管癌术后疗效评估的的分子生物学特异性指标。
1.资料与方法
1.1 一般资料
收集2012年6月至2014年6月本院胸外科住院的食管疾患患者手术切除的食管组织85例,其中食管癌45例,食管良性瘤20例,正常食管(取自食管良性瘤患者的瘤旁2cm以上)组织20例。每例均有完整的临床资料,其中男性35例,女性30例。食管癌组平均年龄61.5(45-78)岁,鳞状细胞癌35例、腺癌5例、未分化癌5例,按2001年国际抗癌联盟TNM分期:Ⅰ期11例,Ⅱ期25例,Ⅲ期6例,Ⅳ期3例;无淋巴结转移者16例,有淋巴结转移者29例。食管良性瘤组男性12例、女性8例,平均年龄55.2(45-67)岁,其中平滑肌瘤10例、息肉8例、乳头状瘤2例。所有病例均术后常规病理检查确诊,术前均未化疗、放疗。
1.2 随机方法
本研究中所纳入患者采用分层随机分组化法,根据研究对象进入试验时重要的临床特征或危险因素分层(如年龄、性别、病情、疾病分期、检验、检查等),然后在每一层内进行随机分组,最后分别合并为观察组和对照组。以避免指定实验研究及治疗所带来的偏差,提高患者的已知和未知特性被均衡分布到各治疗组的可能性,增强各组统计学的可比性。
2.方法
2.1 标本采集
每例标本同时取材2块,一块中性福尔马林固定,石蜡包埋用于免疫组化、病理确诊、组织分型等;一块备用。
2.2 P53免疫组化及检测方法
2.2.1 载玻片的预处理
将载玻片用洗衣粉水浸泡过夜,自来水流水冲洗30min,蒸馏水冲洗3次,烤干,放入95%的乙醇中浸泡30min,干净绸布擦干。
2.2.2 防脱片处理
用丙酮按1:50的比例稀释APES配制成工作液,将清洗后的载玻片放入新鲜配制的APES工作液中20-30sec,取出玻片略干燥5min,再放入纯丙酮溶液中刷洗2-3次,洗去未结合的APES,凉干装盒,防尘防污染备用。
2.2.3 免疫组化染色程序
⑴组织切片依次置于二甲苯浸泡5min→二甲苯浸泡5min→100%乙醇浸泡5min→95%乙醇浸泡5min→80%乙醇浸泡5min→70%乙醇浸泡5min→自来水冲洗→蒸馏水浸泡5min;
⑵加新配制的3%H2O2于组织切片上,室温孵育10min,以消除内源性过氧化物酶活性;蒸馏水冲洗,PBS(PH7.2-7.4)浸泡5min;
⑶抗原热修复:将装有枸椽酸盐缓冲液的玻片缸放人微波炉中加热,切片位于液面以下;当液面出现小水泡时开始计时,8min后取出玻片缸冷却至室温,蒸馏水洗后,用PBS洗2min;
⑷加正常山羊血清工作液(蓝色液体)封闭,室温孵育15min,倾去勿洗;
⑸滴加1:100稀释的鼠抗人p53单克隆抗体,4℃过夜,次日PBS洗3次,每次5min。用已知p53阳性的胃癌组织标本做阳性对照,PBS代替一抗作阴性对照;
⑹滴加生物素标记的通用型二抗工作液(黄色液体),室温孵育30min,PBS洗3次,每次5min;
⑺滴加辣根过氧化物酶标记的链霉卵白素工作液(橙色液体),室温孵育30min,PBS洗3次,每次5min;
⑻DAB即用型试剂配制:于1ml双蒸水中加入1滴A液混匀,然后将试剂B和C各一滴加入其中再次混匀,配好后避光保存,0.5h内应用;
⑼加现配制的DAB显色液覆盖标本,显色约2-5min,然后自来水充分冲洗。
2.2.4 复染和封片
苏木素复染组织切片15-30sec,自来水冲洗,然后依次进行脱水、透明和中性树胶封片,具体步骤依次为75%乙醇浸泡2min→85%乙醇浸泡2min→95%乙醇浸泡2min→100%乙醇浸泡2min→二甲苯Ⅰ浸泡2min→二甲苯Ⅱ浸泡2min→中性树胶封片,光学显微镜下观察结果。
2.2.5 免疫组化结果判定
p53蛋白的阳性颗粒在细胞核,细胞核中出现棕黄色颗粒即为阳性细胞。综合染色强度和阳性范围,对p53蛋白的表达进行临床病理评分。染色强度:基本未着色、染色与背景相似者为0分,着色浅、略高于背景者为1分,中度着色明显高于背景者为2分,强染、着色深棕色者为3分;阳性范围:<10%为0分,10%-24%为1分,25%-49%为2分,50%-75%为3分,>75%为4分。染色强度和阳性范围相加,≥2分为阳性。
2.3 ASPP2检测方法[4]
2.3.1 将组织样品与试剂混合,10分钟低温离心,弃上清,保证被检样品要求,同型对照管中加入荧光标记同型对照抗体,做阴性对照;待测管中加入荧光标记的一抗,做为实验管,各加3μl(按抗体使用说明书,一抗可做选择几个梯度1:20、50、100倍稀释)混匀即可。
2.3.2 滴加0.01mol/L,pH7.4的PBS于待检标本片上,10min后弃去,使标本保持一定湿度。
2.3.3 滴加适当稀释的荧光标记的抗体溶液,使其完全覆盖标本,置于有盖搪瓷盒内,保温一定时间(参考:30min)。
2.3.4 取出玻片,置玻片架上,先用0.01mol/L,pH7.4的PBS冲洗后,再按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸3-5 min,不时振荡。
2.3.5 取出玻片,用滤纸吸去多余水分,但不使标本干燥,加一滴缓冲甘油,以盖玻片覆盖。
2.3.6 上机检测,先做同型对照,用荧光显微镜观察,观察标本的特异性荧光强度。染色强度:基本未着色、染色与背景相似者为0分,着色浅、略高于背景者为1分,中度着色明显高于背景者为2分,强染、着色深棕色者为3分;阳性范围:<10%为0分,10%-24%为1分,25%-49% 为2分,50%-75%为3分,>75%为4分。染色强度和阳性范围相加,≥2分为阳性。
2.4 统计方法
使用SPSS11.5统计软件进行分析,所有计量资料的数据以均数士标准差(X±s)表示,计量资料比较用t检验,计数资料比较用X2检验,采用Spearman等级相关的方法,对相关性进行分析,P<0.05为差异有显著性。
3.结果
3.1 三组标本组织中ASPP2、P53在食管癌组织中的的表达分别是11.11%(5/45);93.7(42/45)在食管良性肿瘤中表达;65%(13/20); 10.0(2/20)在正常食管组织中的表达75.0%(15/20);5.0%(1/20)
三组食管组织中ASPP2、P53表达差异有显著性(P<0.01),见表1

表1 ASPP2、P53在食管癌组织、食管良性肿瘤、正常食道组织中的表达
3.2 ASPP2、P53的表达与食道癌临床病理特征的关系比较,有淋巴结转移者ASPP2表达较其它两组明显下降、P53表达明显高其它两组;随着TNM分期及肿瘤大小的升高ASPP2显著下降、P53表达明显增加(P<0.05),ASPP2、P53与年龄无关(P>0.05),见表2
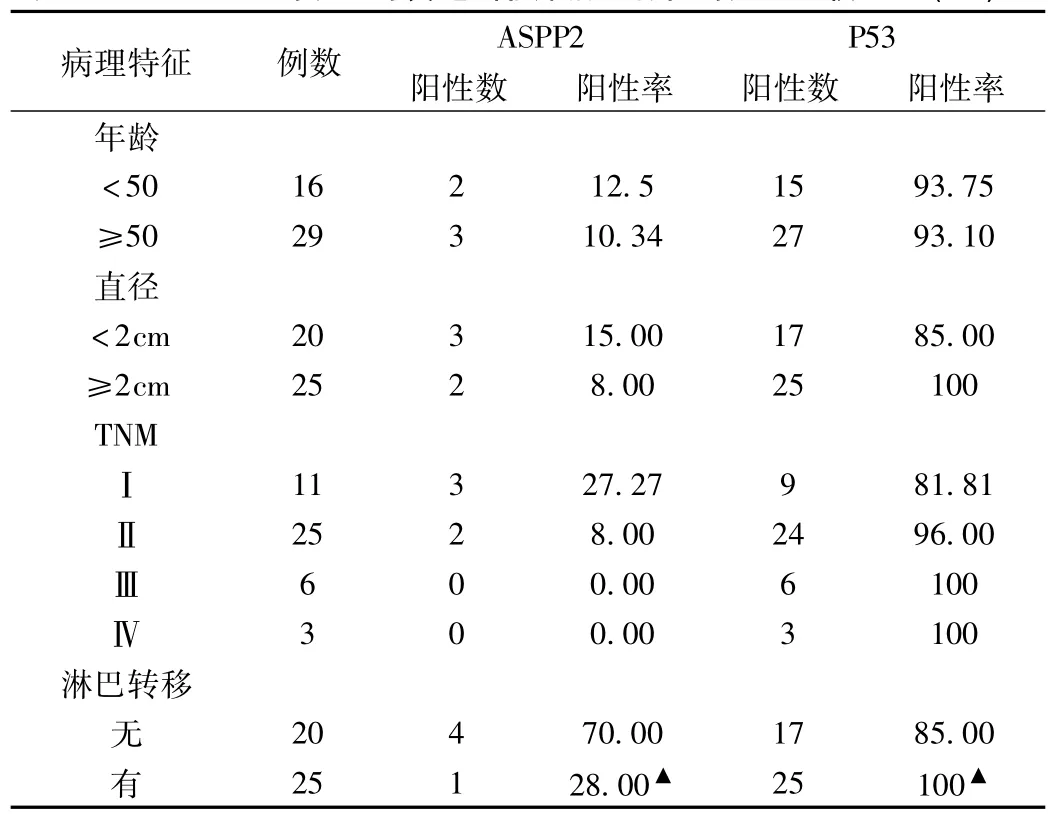
表2 ASPP2、P53的表达与食道癌临床病理特征的关系比较[n,(%)]
3.3 ASPP2、P53在食管癌组织中的表达水平呈明显负相关。见图1

图1 ASPP2、P53在食管癌组织中的表达水平呈明显负相关
4.讨论
食管恶性肿瘤的发生与发展存在着复杂多阶段、多步骤的生物学变化的过程,与细胞的增殖、基因改变和凋亡调节等有着密切相关性[5]。随着分子生物学技术的发展及在各系统肿瘤研究领域中的广泛应用,很多学者从基因水平对食管癌的评价进行了广泛而深入的研究,而且发现了许多意义较大的基因,P53就是目前已被明确确定的基因[6]。尽管随着医学科技的进步,肿瘤的治疗手段日益丰富,然而令人失望的是,食管癌总体五年生存率仍然很低,预后较差,死亡率很高[7]。ASPP2作为一个肿瘤抑制基因,已成为肿瘤领域研究的热点,前期研究发现ASPP2作为抑癌基因,在肝癌、肺癌、白血病等恶性肿瘤中发挥抑制肿瘤生长和转移的作用,国外学者在食管癌细胞株研究中ASPP2也具有明显表达[8],因此本研究对三组组织进行研究对比来证实其在食管癌中的表达,从而来分析其对食管癌患者术后疗效评价的作用及机制。研究显示[9]ASPP2 是p53凋亡刺激蛋白家族是一个新的蛋白家族,ASPP2能与p53蛋白的核心区域结合,增强p53促进凋亡基因转录的能力,发挥抑制肿瘤的作用。ASPP2是由1128个氨基酸组成的蛋白质,能促进p53结合DNA,增强p53的促细胞凋亡功能。学者们还发现ASPP2与p53相互作用,通过调控p53的凋亡功能对抑制肿瘤生长起到重要作用[10]。ASPP2促凋亡机制是通过刺激p53家族(包括p53,p63,p73)的启动子,增强特异启动子的绑定与转活目的基因的功能来完成的。染色质免疫沉淀分析显示,在体内ASPP2的表达选择性的提高了启动子结合目的基因p53的活性,启动这一抑癌基因发挥作用,促进细胞凋亡[11]。APPS2不仅能增强正常启动因子结合目的基因,而且ASPP2的表达还能选择性刺激p53对异位表达启动子的转活性[12]。最近研究表明[13],ASPP2的一段主干序列由氨基酸序列N端截断的一段功能单位,同样具有调节细胞周期的能力,但是其调节转录和p53蛋白凋亡功能的能力较强,在一些资料中体外肿瘤细胞培养的研究中发现ASPP2可以诱导肿瘤细胞的线粒体死亡途径,导致细胞凋亡的发生,揭示了ASPP2通过调节转录和p53蛋白凋亡功能活性抑制食管癌生长这一分子机制[14]。但是当食管肿瘤发生后iASPP可与ASPP2竞争性地与p53结合,抑制ASPP2的促凋亡能力及表达,从而减低P53的抑制性来促进肿瘤的发生。从本研究可以看出三组标本组织中ASPP2、P53在食管癌组织中的的表达分别是11.11%(5/45);93.7% (42/45)在食管良性肿瘤中表达;65%(13/20);10.0%(2/20)在正常食管组织中的表达75.0%(15/20);5.0%(1/20)三组食管组织中ASPP2、P53表达差异有显著性(P<0.01),这也说明国外研究结果与本研究相符ASPP2、P53在食管癌组织中表达具有相关性。同时本研究进一步进行ASPP2、P53的表达与食管癌临床病理特征的关系比较,有淋巴结转移者ASPP2表达较其它两组明显下降、P53表达明显高其它两组;随着TNM分期及肿瘤大小的增长ASPP2显著下降、P53表达明显增加(P<0.05),ASPP2、P53与年龄无关(P>0.05),更进一步证实随着食管癌患者病情加重及治疗结果ASPP2的表达明细显降低。综上所述,ASPP2在食管癌组织中表达明显降低,与食管癌的侵袭和淋巴结转移有关。是食管癌发病和进展的重要因素。APSPP与p53的表达是食管癌发生和进展的相关因素,ASPP2通过p53的相互作用,调控食管癌的发病、侵袭和转移共同发挥着重要作用。由此可见,ASPP2在食管癌中的表达足以反应其转移、分期缓解程度,与传统标记物P53共同反应食管癌的预后,因此完全可以将ASPP2作为食管癌术后疗效的评估指标,但是ASPP2在外周血中的表达准确性还有待进一步的研究。
[1]Lossos IS,Natkunam Y,Levy R,et al.Apoptosis stimulating protein of p53(ASPP2)expression differs in diffuse large B-cell and follicular center lymphoma:correlation with clinical outcome[J].Leuk Lymphoma,2002,43(12):2309-2317.
[2]Zhao J,Wu G,Bu F,et al.Epigenetic silence of ankyrin-repeat-containing,SH3-domain-containing,andproline-rich-region-containing protein1(ASPP1)and ASPP2 55 genes promotes tumor growth in hepatitis B virus-positive hepatocellular carcinoma[J].Hepatology,2010,51(1):142-153.
[3]Sottocornola R,Royer C,Vives V,et al.ASPP2 binds Par-3 and controls the polarity and proliferation of neural progenitors during CNS development[J].Dev Cell,2010,19(1):126-137.
[4]Cobleigh MA,Tabesh B,Bitterman P,et al.Tumor gene expression and prognosis in breast cancer patients with 10 or more positive lymph nodes [J].Clin Cancer Res,2005,11(24 Pt 1):8623-8631.
[5]Camatgo FD,Gokhale S,Johnnidis JB,et a1.YAP1 increases organ size and expands undiferentiated progenitor cells[J].Curr Biol,2007,17 (23):2054-2060.
[6]Lam-Himlin DM,Daniels JA,Gayyed MF,et al.The hippo pathway in human upper genes promotes tumor growth in hepatitis B virus-positive hepatocellular carcinoma[J].Hepatology,2010,51(1):142-153.
[7]Sottocornola R,Royer C,Vives V,et al.ASPP2 binds Par-3 and controls the polarity and proliferationof neural progenitors during CNS development[J].Dev Cell,2010,19(1):126-137.
[8]Cong W,Hirose T,Harita,Y,et al.ASPP2 regulates epithelial cell polarity through the PAR complex[J].CurrBiol,2010,20(15):1408-1414.
[9]Zhao B,Lei QY,Guan KL.The Hippo-YAP pathway:new connections between regulation of organ size and cancer[J].Curr Opin Cell Biol,2008,20(6):638-646.
[10]Pan D.Hippo signaling in organ size control[J].Genes Dev,2007,21 (8):886-897.
[11]Buttitta LA,Edgar BA.How size is controlled:from Hippos to Yorkies [J].Nat Cell Biol,2007,9(11):1225-1227.
[12]Varelas X,Sakuma R,Samavarchi-Tehrani P,et al.TAZ controls Smad nucleocyto-plasmic shuttling and regulates human embryonic stem-cell self-renewal[J].Nat Cell Biol,2008,10(7):837-848.
[13]Alarcon C,Zaromytidou AI,Xi Q,et al.Nuclear CDKs drive Smad transcriptional activation and turnover in BMP and TGF-b pathways[J].Cell,2009,139(4):757-769.
[14]FerlayJ,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
ASPP2 expression studies on the efficacy of postoperative evaluation of the significance
Li Dong Tian HongChao LiShuChen NiuFengYeng YinPeiWei
Objective:To investigate the expression and significance ASPP2 in postoperative patients,demonstrated the feasibility of ASPP2 efficacy of postoperative evaluation.ASPP2 investigate the molecular mechanism of esophageal carcinoma during the transition,the relationship ASPP2 expression and efficacy in postoperative patients.Methods:Immunohistochemical staining was detected 45 cases of esophageal cancer,20 cases of benign esophageal tumors and 20 cases of normal esophageal tissues ASPP2,the expression level of P53.Further analysis of the relationship between expression and clinicopathological features of esophageal ASPP2,P53's.Using Spearman rank correlation method,the ASPP2,P53 expression level correlation analysis.Results:The three groups of tissue samples ASPP2,P53 expression level was P<0.05,significant difference.Conclusion:esophageal carcinoma ASPP2 expression was significantly decreased,P53 levels were significantly increased in diameter invasion ASPP2,P53 expression and lymph node metastasis of esophageal cancer,ASPP2,abnormal expression of P53 is an important factor in the occurrence and development of esophageal cancer,ASPP2 is a good indicator to judge the efficacy of postoperative.
Esophageal cancer;ASPP2;P53;Gene;Efficacy
R735.1
B
1009-6019(2015)02-0007-03
李东,大学学历,主任医生,研究方向胸外疾病的诊断与治疗
