氯胺酮联合氟西汀对抑郁大鼠前额叶nNOS及其配体CAPON表达的影响
2015-06-09沈一维
沈一维,律 峰,黎 平,罗 洁,谢 飞,闵 苏
(重庆医科大学附属第一医院麻醉科, 重庆 400016)
氯胺酮联合氟西汀对抑郁大鼠前额叶nNOS及其配体CAPON表达的影响
沈一维,律 峰,黎 平,罗 洁,谢 飞,闵 苏
(重庆医科大学附属第一医院麻醉科, 重庆 400016)
目的 探讨氯胺酮联合氟西汀对抑郁大鼠行为学以及对大鼠脑内前额叶神经型一氧化氮合酶(nNOS)羧基末端PDZ配体(CAPON)的影响。 方法 健康成年♂ SPF级SD大鼠,体质量220~270 g,2.5~3月龄,采用慢性轻度不可预见性应激法建立抑郁模型。选建模成功的大鼠96只,采用随机数字表法,将其随机分为4组(n=24):抑郁对照组(D组)、氯胺酮组(K组)、氟西汀组(F组)及氯胺酮联合氟西汀组(KF组)。再根据给予药物处理时间的不同,各组随机分为2个亚组(n=12):处理3 d组(D3、K3、F3、KF3)和处理7 d组(D7、K7、F7、KF7)。D组行空白对照处理,K组给予氯胺酮10 mg·kg-1腹腔注射;F组给予氟西汀1.8 mg·kg-1灌胃;KF组氯胺酮10 mg·kg-1腹腔注射后,即刻给予氟西汀1.8 mg·kg-1灌胃。根据所在亚组分别给予各组连续3 d或7 d处理,每天1次。于建模前1 d,建模后1 d及药物处理结束后1 d采用旷场实验和糖水偏好实验评价其抑郁状态。所有行为学检测完成后1 d处死大鼠,分别采用免疫组织化学法和RT-PCR法检测前额叶nNOS、CAPON蛋白及其mRNA的表达。结果 与建模前比较,各组大鼠建模后水平运动距离、直立次数减少,糖水偏好比下降(P<0.05),且各组间差异无统计学意义(P>0.05)。在药物处理3 d后,与D3组比较,K3组和KF3组水平运动距离、直立次数增多,糖水偏好比升高,nNOS及其mRNA表达下调,CAPON蛋白及其mRNA表达上调(P<0.05)。在药物处理7 d后,与D7组比较,K7组,F7组和KF7组水平运动距离、直立次数增多,糖水偏好比升高,nNOS及其mRNA表达下调,CAPON蛋白及其mRNA表达上调(P<0.05);与F7组比较,KF7组水平运动距离、直立次数增多,糖水偏好比升高,nNOS及其mRNA表达下调,CAPON蛋白及其mRNA表达上调(P<0.05)。结论 氯胺酮联合氟西汀较单独使用氟西汀对抑郁大鼠的抗抑郁作用更强,且抗抑郁起效时间缩短,其机制可能与氯胺酮联合氟西汀可降低大鼠脑内前额叶nNOS表达及升高其配体CAPON的表达有关。
氯胺酮;氟西汀;抑郁;前额叶;神经型一氧化氮合酶;神经型一氧化氮合酶羧基末端PDZ配体
抑郁症是一种高患病率、高致残率及高自杀率的慢性精神障碍性疾病。据世界卫生组织统计,抑郁症已成为世界第四大疾患,预计到2020年,可能成为仅次于冠心病的第二大疾病[1]。抑郁症的发病机制至今仍未完全清楚,而传统的抗抑郁药物起效慢且缓解率低[2],大样本临床研究统计发现,要表现出显著有效的治疗效果常需数周乃至数月,且通常仅1/3的病人对单次给药有效[3],临床迫切需要一种起效更迅速,缓解率更高的治疗方案。
近年来,N-甲基-D-天冬氨酸(NMDA)受体拮抗剂氯胺酮被发现具有快速抗抑郁作用[4],但机制仍不明确。其传统的抗NMDA效应并不能完全地解释相关机制。而选择性5-羟色胺(5-HT)再摄取抑制剂氟西汀是临床最常用的抗抑郁药物。神经型一氧化氮合酶(nNOS)通过催化产生一氧化氮(NO)在抑郁症的发生发展中起着重要作用[5],nNOS的活性与其羧基末端PDZ配体(CAPON)密切相关,CAPON可减少NMDA受体介导的Ca2+内流,限制NO的产生,参与了nNOS引起的病理生理改变[6]。故本研究拟通过观测氯胺酮联合氟西汀对抑郁大鼠的抗抑郁作用,探讨其对抑郁大鼠前额叶nNOS及其配体CAPON表达的影响。
1 材料
1.1 动物SPF级成年♂Sprague-Dawley(SD)大鼠,购自重庆医科大学实验动物中心,批号SYXK(渝)2010-0002。
1.2 主要材料与试剂氯胺酮(批号101221,福建古田制药厂);氟西汀(批号:7052069,礼来苏州制药);过氧化物酶标记的链霉卵白素染色试剂盒(SP-9001,美国ZYMED公司);DAB显色剂(ZLI-9018,北京中杉金桥);抗nNOS抗体(美国Cell Si gnaling Technology公司);抗CAPON抗体(美国Santa Cruz公司);TRIzol试剂盒(北京鼎国生物技术有限公司)。
1.3 主要仪器旷场行为追踪系统(ZH-ZFT型,淮北正华生物仪器设备有限公司);显微镜(BX51型,日本Olympus公司);图像分析系统(Image Pro Plus 6.0,美国Media Cybernetics公司)。
2 方法
2.1 伦理学本实验获得了重庆医科大学动物实验伦理委员会的批准。
2.2 实验分组及处理健康成年♂SPF级SD大鼠,体质量220~270 g,2.5~3月龄。实验前全部动物均进行1周适应性饲养,自由摄食、饮水,并保持饲养室内安静,温度22℃左右,湿度55%~65%和12 h/12 h明暗交替。参照文献[7]制备慢性轻度不可预见性应激(CUMS)模型。每天随机给予一种刺激(连续束缚2 h;明暗颠倒24 h;鼠笼倾斜24 h;潮湿垫料24 h;禁饮24 h;禁食24 h;4 ℃冰水游泳5 min;45热应激5 min;每分钟摇晃1次,持续15 min;夹尾1 min),同种刺激不连续出现,持续28 d。建模后经行为学测试(旷场实验及糖水偏好实验)评估,较建模前下降30%以上的大鼠选为抑郁大鼠模型。
取抑郁模型建立成功的大鼠96只,采用随机数字表法,将其随机分为4组(n=24):抑郁对照组(D组)、氯胺酮组(K组)、氟西汀组(F组)及氯胺酮联合氟西汀组(KF组)。再根据给予药物处理时间的不同,各组随机分为2亚组(n=12):处理3 d组(D3、K3、F3、KF3)和处理7 d组(D7、K7、F7、KF7)。K组氯胺酮10 mg·kg-1腹腔注射后,即刻给予生理盐水10 ml·kg-1灌胃;F组生理盐水10 ml·kg-1腹腔注射后,即刻给予氟西汀1.8 mg·kg-1配制生理盐水混悬液10 ml·kg-1灌胃后;KF组氯胺酮10 mg·kg-1腹腔注射后,即刻给予氟西汀1.8 mg·kg-1配制生理盐水混悬液10 ml·kg-1灌胃;D组生理盐水10 ml·kg-1腹腔注射,即刻给予生理盐水10 ml·kg-1灌胃。各组每天处理1次,根据所在亚组组别连续3 d或7 d。
2.3 行为学测试采用旷场测试和糖水偏好实验评价其抑郁状态。 分别于建模前1 d,建模后1 d及处理结束后1 d,参照文献[8]的方法进行旷场测试和糖水偏好实验。选择上午9 ∶00~12 ∶00于安静的房间内进行观察。旷场测试:使用旷场行为追踪系统进行测试,将大鼠放于旷场箱中央,计算3 min内大鼠水平运动距离及直立次数。每只大鼠测试完毕均彻底清洁,用酒精擦拭旷场箱后再进行下一只的测试。糖水偏好实验前先训练大鼠适应糖水(24 h内同时给予两瓶1%蔗糖水,500 ml/瓶),测试前禁食禁水23 h,随后每笼放入纯水和1%蔗糖水各1瓶(500 ml/瓶),1 h后分别测量糖水和纯水的消耗量,计算糖水偏好比(糖水偏好比/%=糖水消耗量÷总液体消耗量×100%)。
2.4 免疫组织化学检测nNOS蛋白及其配体CAPON蛋白的表达于所有行为学检测完成后1 d,各组随机选择6只大鼠,腹腔注射0.5%戊巴比妥钠50 mg·kg-1麻醉,以4%多聚甲醛经升主动脉灌注内固定,断头取脑,切取大鼠前额叶脑组织。常规石蜡包埋、切片、片厚5 μm。nNOS蛋白的检测:使用SP-9001过氧化物酶标记的链霉卵白素染色试剂盒进行免疫组织化学检测。常规二甲苯及梯度酒精脱蜡至水,热抗原修复20 min,3%H2O2去离子水室温孵育15 min,山羊封闭血清,室温孵育30 min后滴加一抗nNOS(1 ∶50),4℃冰箱中保存过夜,滴加生物素标记的山羊抗兔IgG二抗工作液,37℃孵育30 min,加入辣根酶标记链霉卵白素工作液,37℃孵育30 min,以DAB显色(除滴加山羊血清封闭液外,每步反应前均用PBS冲洗3次×5 min)。阴性对照组用PBS液代替一抗孵育,其余步骤相同。显色后烘干,二甲苯透明后封片。CAPON蛋白的检测方法同nNOS蛋白,不同点在于一抗选用CAPON(1 ∶100),每步反应前的冲洗使用TBS代替PBS。每组大鼠随机选择5张切片,每张选取5个视野,显微镜下观察,以Image Pro Plus 6.0图像分析系统分析前额叶阳性表达区的光密度值,以反映nNOS蛋白及其配体CAPON蛋白表达。
2.5 RT-PCR检测nNOS mRNA及其配体CAPON mRNA的表达各组剩余的6只大鼠,麻醉下快速断头,在去焦碳酸二乙醋水成的冰面上利用灭酶器械迅速分离前额叶,液氮冻存。总RNA按TRIzol试剂盒说明书的步骤提取。每组取4 μg总RNA采用二步法进行反应。第1步为cDNA的合成,参照逆转录酶M-Mulv Reverse Transciptase使用说明书的步骤进行,第2步为PCR扩增。参照GenBank 公布的nNOS、CAPON及内参β-actin序列,设计nNOS上游引物为5′-TGAAAGCACCAGCACCTACCAG-3′,下游引物5′-GGCACAATCCACACCCAGTC-3′ (扩增产物879 bp);CAPON上游引物为5′-GATGCCTGACTCTCGGAACTT-3′,下游引物5′-CAGCCGAGGATAACCAGCCGAT-3′(扩增产物144 bp);内参β-actin上游引物为5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物5′-CTCCTTAATGTCACGCACGATTTC-3′(扩增产物540 bp)。扩增条件:95℃预变性2 min,95℃变性45 s,退火45 s,72℃延伸1 min,30个循环后,72℃补充延伸5 min。取4 μl产物在1.5%琼脂糖凝胶中,90 V电泳30 min,紫外灯下观察结果,拍照并保存。通过Quantity One图像分析软件对电泳条带进行半定量分析,nNOS mRNA 及其配体CAPON mRNA分别和β-actin mRNA的光密度比值代表其各自的相对表达水平,重复3次,取平均值作为结果。

3 结果
3.1 各组大鼠旷场试验结果与建模前比较,建模后大鼠水平运动距离及直立次数减少(P<0.05)。各组大鼠建模后水平运动距离和直立次数的差异无统计学意义(P>0.05)。在给予药物干预3 d后,与D3组比较,K3组及KF3组水平运动距离及直立次数增多(P<0.05)。在给予药物干预7 d后,与D7组比较,K7组、F7组及KF7组水平运动距离及直立次数增多(P<0.05);与F7组比较,KF7组水平运动距离及直立次数增多(P<0.05)。见Tab 1、2。

Tab 1 Comparison of distance and rearing number before andafter model in CUMS depressed ±s,n=96)
*P<0.05vspre-model

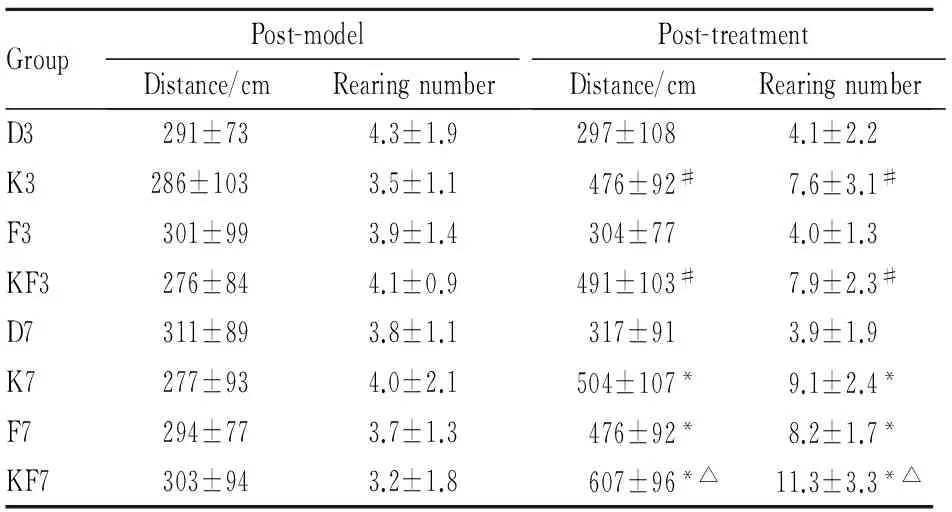
GroupPost-modelDistance/cmRearingnumberPost-treatmentDistance/cmRearingnumberD3291±734.3±1.9297±1084.1±2.2K3286±1033.5±1.1476±92#7.6±3.1#F3301±993.9±1.4304±774.0±1.3KF3276±844.1±0.9491±103#7.9±2.3#D7311±893.8±1.1317±913.9±1.9K7277±934.0±2.1504±107*9.1±2.4*F7294±773.7±1.3476±92*8.2±1.7*KF7303±943.2±1.8607±96*△11.3±3.3*△
#P<0.05vsgroup D3;*P<0.05vsgroup D7;△P<0.05vsgroup F7
3.2 各组大鼠糖水消耗实验的结果与建模前比较,建模后大鼠糖水偏好比降低(P<0.05)。各组建模前糖水偏好比的差异无统计学意义(P>0.05)。在给予药物干预3 d后,与D3组比较,K3组及KF3组糖水偏好比升高(P<0.05)。在给予药物干预7 d后,与D7组比较,K7组、F7组及KF7组糖水偏好比升高(P<0.05);与F7组比较,KF7组糖水偏好比升高(P<0.05)。见Tab 3、4。


Pre-modelPost-modelSPP83.9±2.253.4±1.7*
*P<0.05vspre-model
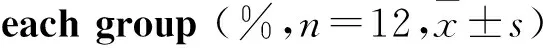

GroupPost-modelPost-treatmentD354.5±2.757.3±2.9K352.7±2.670.9±2.3#F353.9±1.859.2±2.4KF351.3±2.169.9±1.8#D753.9±1.956.4±1.9K749.5±1.173.6±2.2*F748.8±2.469.3±2.9*KF751.7±3.179.6±2.0*△
#P<0.05vsgroup D3;*P<0.05vsgroup D7;△P<0.05vsgroup F7
3.3 各组大鼠前额叶nNOS蛋白、CAPON蛋白及其mRNA表达的比较在给予药物干预3 d后,与D3组比较,K3组及KF3组CAPON 蛋白及其mRNA表达增加,nNOS蛋白及其mRNA表达下降,差异有统计学意义(P<0.05)。在给予药物干预7 d后,与D7组比较,K7组、F7组及KF7组CAPON蛋白及其 mRNA表达增加,nNOS蛋白及其mRNA表达下降,差异有统计学意义(P<0.05);与F7组比较,KF7组CAPON蛋白及其mRNA表达增加,nNOS 蛋白及其mRNA表达下降,差异有统计学意义(P<0.05),见Tab 5,Fig 1、2、3。

Fig 1 Expressions of nNOS and CAPON mRNA in prefrontal lobe of rats in each group (RT-PCR)

Fig 2 Expression of nNOS in prefrontal lobe of rats (SP×400). The nNOS protein is mainly expressed in cytoplasm, marrow position is target protein. The nucleus for hematoxylin staining appear blue.

Fig 3 Expression of CAPON in prefrontal lobe of rats (SP×400). The CAPON protein is mainly expressed in cytoplasm, marrow position is target protein. The nucleus for hematoxylin staining appear blue.

Tab 5 Expressions of nNOS, CAPON protein and mRNA inprefrontal lobe of rats in each ±s,n=6)
#P<0.05vsgroup D3;*P<0.05vsgroup D7;△P<0.05vsgroup F7
4 讨论
CUMS是目前抑郁症机制研究中应用最广泛的抑郁模型,能够有效的模拟人类环境应激所导致的抑郁症状[7,9],并已成功应用于本课题组前期研究中[10-11]。本研究发现CUMS方法建模后抑郁大鼠的行为学指标均低于建模前,表明建模后大鼠快感缺失,对新环境探索能力和兴奋程度下降,这与临床上抑郁症状精神运动抑制、快感缺失等相符合,说明抑郁模型的建立是成功的。
本研究参照文献[12],腹腔注射10 mg·kg-1氯胺酮,结果表明,与建模前及抑郁组比较,K组大鼠快感消失、对新环境探索能力和兴奋程度的表现得到改善,提示氯胺酮具有明显的抗抑郁作用,这与既往研究结果一致[3-4]。研究中为保证给药量的准确,将氟西汀在生理盐水中加热溶解,按比例(1.8 mg氟西汀 ∶10 ml生理盐水)配制成混悬液,参照既往研究以1.8 mg·kg-1进行灌胃[13]。
本研究发现对于CUMS抑郁模型建立成功的大鼠,经氯胺酮联合氟西汀处理3 d后,其旷场实验评分、糖水偏好比相对于抑郁模型组及单纯使用氟西汀组明显增加。而此时使用了氟西汀的大鼠与抑郁组大鼠相比无明显差异。前期动物实验显示,氟西汀需5~7 d方能起效,这与本研究结果一致。在给药7 d后,氯胺酮联合氟西汀组,其旷场实验评分、糖水偏好比相对于单纯使用氟西汀组明显增加,提示氯胺酮联合氟西汀较单独使用氟西汀对抑郁大鼠的抗抑郁作用更强,抗抑郁起效时间缩短。
本实验取材选取与抑郁症关系最为密切的大脑前额叶进行分析,研究结果发现,对于CUMS抑郁模型建立成功的大鼠,经氯胺酮联合氟西汀处理后,相对于抑郁模型组及单纯使用氟西汀组,抑郁行为得到改善,前额叶nNOS蛋白及mRNA水平明显降低,其配体CAPON蛋白及mRNA水平明显升高。提示氯胺酮联合氟西汀可能通过促进抑郁大鼠前额叶神经元CAPON的表达,进而抑制nNOS活性来改善大鼠的抑郁状态。nNOS是一种主要表达于神经细胞胞质的酶类,可以催化L-精氨酸形成NO,而NO作为神经系统重要的信使分子和神经递质在抑郁症的发病中起着重要作用。生理量的NO对神经系统有保护作用,但过量的NO却会引起神经毒性作用[7]。当 NO过度增加可诱发其生成的正反馈环路激活,进而线粒体损伤,ATP等能量生成减少,随之出现细胞的损伤及凋亡,严重影响细胞的功能。前期多项研究已经证实,NO的神经毒性作用参与了抑郁症、阿尔茨海默病、帕金森病以及亨廷症的病理生理过程。既往研究发现[14],抑郁症患者血清中存在NO水平升高及NOS活力升高。
NO属于气体分子,在细胞中存留时间短(仅2~5 s),不易准确检测,故本次研究选用神经型一氧化氮合酶(nNOS)进行检测,从而反映细胞内NO的浓度。本次研究发现,抑郁大鼠在经氯胺酮及氟西汀治疗后,抑郁行为明显改善,大鼠脑内前额叶nNOS蛋白及mRNA表达明显减低,提示大鼠抑郁时所出现的NO合成过量受到了抑制。CAPON是nNOS的一种接头调控蛋白,可与PSD95竞争性结合nNOS,抑制NMDAR对nNOS的激活,减少NO的合成和释放,从而减少nNOS过度激活产生大量NO而引起的生理或病理作用[15]。
综上所述,氯胺酮联合氟西汀较单独使用氟西汀对抑郁大鼠的抗抑郁作用更强,且抗抑郁起效时间缩短。其机制可能与氯胺酮联合氟西汀能通过促进抑郁大鼠前额叶神经元CAPON的表达,进而抑制nNOS活性来改善大鼠的抑郁状态。本研究发现为临床抑郁症急性发作的治疗提供方向。
[1] 刘佳莉, 苑玉和, 陈乃宏, 等. 抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-6.
[1] Liu J L, Wan Y H, Chen N H, et al. Research progress in treatment of depression[J].ChinPharmacolBull,2011,27(9):1193-6.
[2] 薛 瑞, 张有志, 邹莉波. 快速起效抗抑郁药物的研究进展[J].中国药理学通报,2008,24(12):1558-61.
[2] Xue R,Zhang Y Z,Zou L B. Progress in the development of early-onset antidepressants[J].ChinPharmacolBull,2008,24(12):1558-61.
[3] Ibrahim L, Diazgranados N, Luckenbaugh D A, et al. Rapid decrease in depressive symptoms with an N-methyl-d-aspartate antagonist in ECT-resistant major depression[J].ProgNeuropsychopharmacolBiolPsychiatry, 2011,35(4): 1155-9.
[4] Murrough J W, Charney D S. Cracking the moody brain: lifting the mood with ketamine[J].NatMed, 2010,16(12): 1384-5.
[5] Keilhoff G, Fansa H, Wolf G. Nitric oxide synthase, an essential factor in peripheral nerve regeneration[J].CellMolBiol, 2003,49(6):885-97.
[6] Jaffrey S R, Snowman A M, Eliasson M J, et al. CAPON:a protein associated with neuronal nitric oxide synthase that regulates its interactions with PSD95[J].Neuron, 1998,20(1):115-24.
[7] Banasr M, Valentine G W, Li X Y, et al. Chronic unpredictable stress decreases cell proliferation in the cerebral cortex of the adult rat[J].BiolPsychiatry,2007,62(5):496-504.
[8] Luo K R, Hong C J, Liou Y J, et al. Differrent regulation of neurotrophin S100B and BDNF in two rat models of depression[J].ProgNeuropsrchopharmacolBiolPsychiatry, 2010,34(8):1433-9.
[9] Banasr M, Chowdhury G M, Terwilliger R, et al. Glial pathology in an animal model of depression: reversal of stress-induced cellular, metabolic and behavioral deficits by the glutamate-modulating drug riluzole[J].MolPsychiatry, 2010,15(5):501-11.
[10] Li W, Liu L, Liu Y Y, et al. Effects of electroconvulsive stimulation on long-term potentiation and synaptophysin in the hippocampus of rats with depressive behaxior[J].JECT,2012,28(2):111-7.
[11] 李 炜, 闵 苏, 李 晓, 等. 小剂量氯胺酮对抑郁大鼠异丙酚麻醉下电休克疗效的影响[J].中华麻醉学杂志,2011,31(6):680-3.
[11] Li W, Min S,Li X, et al.Effect of low-dose ketamine on efficacy of electroconvulsive therapy under propofol anesthesia in depressed rats[J].ChinJAnesthesiol, 2011,31(6):680-3.
[12] 杨 春, 李文媛, 张广芬, 等. 不同剂量氯胺酮对抑郁大鼠海马脑源性神经营养因子和酪氨酸受体激酶B的影响[J].中华麻醉学杂志, 2011,31(4):460-2.
[12] Yang C, Li W Y, Zhang G F, et al.Effects of different doses of ketamine on brain-derived neurotrophic factor and tyrosine receptor kinase B in hippocampus in mentally depressed rats[J].ChinJAnesthesiol, 2011,31(4):460-2.
[13] 李卫东,吴元坪,韩止荣,等.电针及氟西汀对抑郁大鼠行为学及海马神经元凋亡的影响[J].中华精神科杂志,2008,41(4):237-40.
[13] Li W D, Wu Y P, Han Z R, et al.Effects of electroacupuncture and fluoxitine on behavior and apoptosis of hippocampal cells in chronic stress rat[J].ChinJPsychiatry, 2008,41(4):237-40.
[14] Zhang J, Xu H M, Zhang C Y, et al.The relationship between nitric oxide synthase activity and depression[J].NeurosciBull,2005,21(6):404-7.
[15] Cui Z M, Lü Q S, Yan M J, et al. Elevated expression of CAPON and neuronal nitric oxide synthase in the sciatic nerve of rats following constriction injury[J].VeterinaryJ,2011,187:374-80.
Effects of ketamine plus fluoxetine on nNOS and CAPON expression in the prefrontal lobe of mentally depressed rats
SHEN Yi-wei, LYu Feng, LI Ping, LUO Jie, XIE Fei, MIN Su
(DeptofAnesthesiology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the effect of ketamine plus fluoxetine on depressed behavior and the expression of neuronal nitric oxide synthase (nNOS) and CAPON in prefrontal lobe of mentally depressed rats at different time points,so as to study the possible mechanism of ketamine plus fluoxetine inducing antidepressant behavior. Methods Healthy adult male Sprague-Dawley rats, aged 2.5~3 months, weighing 220~270 g, were induced as the rodent model of depression by chronic unpredictable mild stress (CUMS). After the models of depression were established, 96 of CUMS modeling successfully depressed rats were selected. Then they were randomly divided into four groups (n=24 each): the depressed group (group D, untreated group), ketamine group (group K, treated with intraperitoneal injection of ketamine 10 mg·kg-1once a day for 3 days or 7 days), fluoxetine group (group F, treated with gavage of fluoxetine 1.8 mg·kg-1once a day for 3 days or 7 days), or ketamine plus fluoxetine group (group KF, treated with intraperitoneal injection of ketamine 10 mg·kg-1plus gavage of fluoxetine 1.8 mg·kg-1once a day for 3 days or 7 days). Open field test and sucrose preference test were performed 1 day before depression model was established, and 1 day before and after treatment. The rats were sacrificed 1 day after the last test for determination of the expression of nNOS and CAPON protein (using immuno-histochemisity) and mRNA (by RT-PCR) in the prefrontal lobe. Results After the models of depression were established, the total distance, rearing number and the sucrose preference percentage (SPP) were decreased significantly compared with those before (P<0.05).There was no significant difference among all groups in the total distance, rearing number and the SPP before treatment (P>0.05). Compared with groups D and F, the total distance was prolonged, the number of rearing and SPP were significantly increased, the expression of nNOS protein and mRNA was down-regulated and the expression of CAPON protein and mRNA was up-regulated in groups K and KF, with 3 days’ treatment (P<0.05). Compared with group D, the total distance was prolonged, the number of rearing and SPP were significantly increased, the expression of nNOS protein and mRNA was down-regulated and the expression of CAPON protein and mRNA was up-regulated in groups K,F and KF with 7 days’ treatment (P<0.05). Compared with group F, the total distance was prolonged, the number of rearing and SPP were significantly increased, the expression of nNOS protein and mRNA was down-regulated and the expression of CAPON protein and mRNA was up-regulated in group KF with 7 days’ treatment (P<0.05). Conclusion Co-administration of antidepressant fluoxetine with ketamine may induce a more pronounced antidepressant activity than treatment with each antidepressant alone and it can shorten the time to improve the depressive state through promoting the expression of CAPON and inhibiting nNOS activity in the prefrontal lobe of mentally depressed rats.
ketamine; fluoxetine; depression; prefrontal lobe; nitirc oxide synthase; CAPON
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.018.html
2014-12-06,
2015-02-19
国家自然科学基金面上资助项目(No 30972831, 81271501);重庆市教育委员会科学技术研究项目(No KJ090309);重庆市医学重点学科资助项目(No 2007-02);卫生部国家临床重点学科(No 2011-170)
沈一维(1985-) 女,硕士,医师,研究方向:抑郁症与认知功能,E-mail:yiwei1928@126.com; 闵 苏(1960-) 女,教授,主任医师,博士生导师,研究方向:抑郁症与认知功能、围术期内重要脏器保护,通讯作者,Tel:023-89011068,E-mail: ms89011068@163.com
10.3969/j.issn.1001-1978.2015.04.010
A
1001-1978(2015)04-0487-06
R-332;R322.81; R749.42;R971.2;R971.4;R977.3
