大鼠佐剂性关节炎病程不同阶段T细胞亚群及重要器官的病理学变化
2015-06-09孙晓静贾晓益杨雪枝
孙晓静,徐 澍,贾晓益,魏 芳,杨雪枝,常 艳,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽 合肥 230032)
大鼠佐剂性关节炎病程不同阶段T细胞亚群及重要器官的病理学变化
孙晓静,徐 澍,贾晓益,魏 芳,杨雪枝,常 艳,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽 合肥 230032)
目的 观察大鼠佐剂性关节炎(adjuvant rheumatoid arthritis, AA)病程不同阶段的脾脏T细胞亚群及其重要器官的病理学变化,探讨病程不同的阶段AA大鼠T细胞亚群变化的规律及局部组织和全身重要器官的病理学变化特点。方法 选用20只♂ Lewis大鼠,完全弗氏佐剂(CFA)诱导AA模型,造模后d 7、d 10、d 13、d 16、d 19、d 22进行全身评分和关节炎指数评分,计算关节肿胀数。造模后d 14(炎症初期)、d 22(炎症高峰期)处死大鼠,流式细胞仪检测炎症初期和炎症高峰期脾脏总T细胞(CD3+CD4+)、记忆T细胞(CD4+CD44+)、未致敏T细胞(CD4+CD62L+)的细胞亚群和Th17(CD4+IL-17+)细胞亚群比例。d 22取心、肝、脾、肺、肾、踝关节、肠系膜淋巴结组织,光镜观察各组织的病理学改变。结果 大鼠免疫后10 d出现继发侧足爪红肿,炎症初期(d 10~d 14)和炎症高峰期(d 19~d 22)AA大鼠的全身评分、关节炎指数评分和关节肿胀数有不同程度的增加。踝关节病理见滑膜组织增生、炎细胞浸润,血管翳出现等,且心、肝、脾、肺、肾、肠系膜淋巴结组织的病理也有不同程度的炎性变化。与正常组比较,炎症初期AA大鼠脾脏总T细胞、记忆T细胞和未致敏T细胞亚群比例都无明显变化、炎症高峰期AA大鼠脾脏总T细胞、记忆T细胞和未致敏T细胞亚群比例明显升高;Th17细胞亚群比例在炎症初期和高峰期都明显升高。结论 AA大鼠的T细胞亚群在炎症初期和高峰期出现不同的变化特点;在大鼠AA不仅有关节局部的病理表现,且全身主要脏器组织均有受累。
佐剂性关节炎;类风湿关节炎;Th17;病理学;T细胞亚群;病程
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性的表现为滑膜炎症并导致关节软骨和骨损害的全身炎症免疫性疾病[1]。除了对关节软骨滑膜造成损害以外,RA的关节外临床表现和并发症也有很多,比如心包炎、心肌炎、肾小球肾炎等等[2]。CD4+T细胞是浸润RA滑膜关节的主要免疫细胞,多年来,RA一直被认为是一种T细胞驱动的疾病[3]。根据细胞的功能,通常将CD4+T细胞分为Th1、Th2辅助细胞以及T调节细胞三个亚群,Th17 细胞是近年来研究发现的一种CD4+T细胞新亚型,高分泌IL-17,与许多炎症反应和自身免疫病的发生和发展有关[4]。RA患者的血清和关节滑液中Th17细胞数量和IL-17的表达都明显升高[5]。
大鼠佐剂性关节炎(adjuvant arthritis, AA)模型是一种T细胞依赖、细胞免疫介导的炎症性免疫动物模型,在临床表现和病理机制等方面与人RA有许多相似特征,是研究RA病理机制的较理想动物模型[6]。本文成功建立了大鼠AA模型,进行全身评分、关节炎指数,关节肿胀数的测定,检测了炎症初期和高峰期T细胞亚群的变化,总T细胞(CD3+CD4+)、未致敏T细胞(CD4+CD62L+)和记忆T细胞(CD4+CD44+)在炎症初期没有明显变化,但在炎症高峰期均明显升高;Th17细胞亚群比例在炎症初期就有明显升高。为以病程不同阶段的T细胞亚群调控为策略或以Th17细胞为靶标的RA早期诊断、早期治疗及预后判断研究,提供了实验依据。观察AA大鼠踝关节、心、肝、脾、肺、肾、肠系膜淋巴结组织病理形态的变化,结果显示多种重要组织都有不同程度的炎性改变。为综合探讨和分析关节局部和全身重要脏器的炎症性反应提供了实验依据。
1 材料与方法
1.1 动物Lewis 大鼠,♂,清洁级,体质量160~180 g,购自北京维通利华实验动物技术有限公司,许可证号码: SCXK(京)2012-0001,在恒温(24±2) ℃、光照周期12 h环境中,饲养1周后实验。
1.2 试剂卡介苗(bacillus calmette-guerin, BCG):成都生物制品研究所有限责任公司产品,生产批号:20123007。
1.3 方法
1.3.1 大鼠AA模型的制备 将BCG 80℃水浴灭活1 h,与高压灭菌的石蜡充分研磨混匀,制成10 g·L-1完全弗氏佐剂(complete freund adjuvant, CFA),于每只Lewis大鼠右后足跖皮内注射CFA 0.1 mL致炎[6],造模当天设为d 0。
1.4 检测指标
1.4.1 全身评分 从致炎后d 7,每隔3 d(d 7、d 10、d 13、d 16、d 19、d 22)进行全身表现评分,评分标准包括:耳:0=无结节和发红症状,1=一只耳朵结节和发红症状,2=两只耳朵结节和发红症状;鼻:0=无结缔组织肿胀,1=明显结缔组织肿胀;尾:0=无结节,1=有结节;前足爪:0=无肿胀,1=一个前足爪肿胀,2=两个前足爪肿胀;后足爪:0=无肿胀,1=一个后足爪肿胀,2=两个后足爪肿胀,每只大鼠最多评8分[7]。
1.4.2 关节炎指数 从致炎后d 7,每隔3 d(d 7、d 10、d 13、d 16、d 19、d 22)进行关节炎指数评分,观察每组大鼠的继发病变。每只足爪的关节炎指数评分标准:0=正常;1=踝关节出现红斑和轻微肿胀;2=踝关节到跖关节或掌关节红斑和轻微肿胀;3=踝关节到跖趾关节或掌关节出现红斑和中度肿胀;4=踝关节到趾关节出现红斑和重度肿胀 每只大鼠最多评12分[6]。
1.4.3 关节肿胀数 从致炎后d 7,每隔3 d(d 7、d 10、d 13、d 16、d 19、d 22)计算关节肿胀数。每只足爪计1个踝关节(或腕关节)和5个指(趾)关节,每只大鼠最多24个关节肿胀[7]。
1.4.4 病理学观察 造模后d 22,分别将正常对照组和模型组大鼠麻醉后颈部脱臼处死,迅速剪开大鼠腹部缝线,分离各脏器组织,留取心、肝、脾、肺、肾、踝关节、肠系膜淋巴结组织,置于含体积分数10%甲醛溶液的玻璃瓶中固定,5%HNO3(踝关节),选块,不同浓度梯度乙醇逐级脱水,石蜡包埋,制作病理切片(厚约5 μm),经苏木精-伊红(HE)染色后,Olympus光镜观察各组织病理学变化。
1.4.5 脾脏CD4+T细胞数量及特征性表面抗原测定 造模后d 14和d 22,麻醉后颈椎脱臼处死大鼠,无菌分离大鼠脾脏,制备脾细胞悬液,分别加入CD3-APC/CD4-FITC一抗,CD62L-APC/CD4- FITC一抗,CD44-PE/CD4-FITC一抗;检测总(CD3+CD4+)、未致敏(CD4+CD62L+)和记忆(CD4+CD44+)T细胞,4℃避光放置30 min后上机检测。Th17细胞的检测:100 μL的脾细胞悬液中先加入CD4-FITC,4℃避光孵育30 min后,300 g离心5 min,弃上清,加入Fixation/permeabilization穿膜60 min,用洗液洗涤后,加入IL-17-PE 4℃避光孵育45 min后,对胞内细胞因子IL-17进行染色,洗液洗涤后,500 μl PBS重悬细胞后上机检测。

2 结果
2.1 AA大鼠体征观察情况大鼠AA原发病变主要表现为早期致炎部位的局部炎症反应,在发病过程中,大鼠精神萎靡、毛发失去光泽,多发性关节肿胀和活动障碍等。免疫后18 h,右后肢(原发侧)肿胀达高峰,持续3 d后逐渐减轻;免疫后d 8再度肿胀;免疫后d 10~14 AA大鼠普遍出现全身病变和继发性炎症表现,d 19~22达高峰,发病率达95%以上,表现为左后肢(继发侧)和前肢的肿胀,耳朵、鼻和尾部出现关节炎结节等(Fig 1)。

Fig 1 Sign of AA rats
A: Hind limbs of normal rats; B: Hind limbs of AA rats; C: Fore limbs of normal rats; D: Fore limbs of AA rats; E: Tail of AA rats; F: Ocular region of AA rats.
2.2 AA大鼠整体指标观察造模后d 7、d 10、d 13、d 16、d 19、d 22进行全身评分和关节炎指数评分,计算关节肿胀数。结果显示:AA大鼠在d 13全身评分(Fig 2-1)、关节炎指数(Fig 2-2)和关节肿胀数(Fig 2-3)开始升高,d 19到达高峰,与体征观察一致。
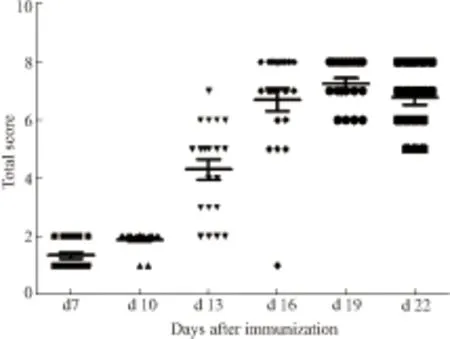
Fig 2-1 Total score of AA rats (n=20)

Fig 2-2 Arthritis index of AA rats (n=20)

Fig 2-3 Paw swelling number (n=20)
2.3 AA大鼠脾脏CD4+ T细胞亚群比例的变化与正常组比较,炎症初期模型组脾脏总T细胞(CD3+CD4+)、记忆T细胞(CD4+CD44+)、未致敏T细胞(CD4+CD62L+)的细胞亚群比例无明显变化;炎症高峰期模型组脾脏总T细胞、记忆T细胞、未致敏T细胞的细胞亚群比例明显升高(Fig 3-1)。
与正常组比较,炎症初期和炎症高峰期模型组脾脏Th17(CD4+IL-17+)细胞亚群比例均明显升高(Fig 3-2)。
2.4 AA大鼠踝关节、心、肝、脾、肺、肾、肠系膜淋巴结组织HE染色病理学变化
2.4.1 AA大鼠踝关节病理学表现 结果显示:正常大鼠踝关节结构完整,关节腔内干净,关节表面光滑平整,关节囊由结缔组织构成,囊腔光滑,有1~2层滑膜细胞覆盖。AA大鼠踝关节间隙明显变窄,可见关节腔积液,炎性渗出,表面有纤维结缔组织增生,滑膜细胞增生水肿,血管翳形成,滑膜组织内小血管增生,扩张充血,大量炎细胞浸润,以淋巴细胞、单核巨噬细胞和浆细胞慢性炎细胞浸润为主(Fig 4-1)。

Fig 3-1 Variation of T-cell subsets in AA spleen in different courses ±s,n=3~4) (Molecule expressions on T cell surface were detected using a flow cytometer)A: Total (CD3+CD4+) T cells; B: Naive (CD4+CD62L+) T cells; C: Memory (CD4+CD44+) T cells. *P<0.05 vs normal group

Fig 3-2 Variation of Th17 subsets in AA spleen in different courses ±s,n=3~4)
**P<0.01vsnormal group;#P<0.05vsd 22 group

Fig 4-1 HE staining of ankle joints of rats(×100)
A: Normal group; B: AA group
2.4.2 AA大鼠心脏病理学表现 结果显示:正常对照组心肌呈粉红色,胞质胞核及组织结构清晰,心肌纤维细长,呈圆柱形,分支并互连成网,心肌纤维间有少量结缔组织;模型组心肌纤维浊肿,肌原纤维不清,横纹消失,局灶性肌浆凝聚,呈波浪状改变或形状不规则的颗粒、团块和收缩带,间质可见明显水肿(Fig 4-2)。

Fig 4-2 HE staining of heart of rats (×200)
A: Normal group; B: AA group
2.4.3 AA大鼠肝脏病理学表现 结果显示:正常对照组肝小叶结构完整,肝细胞形态结构正常围绕中央静脉呈放射状排列。模型组肝索紊乱,肝细胞呈轻度或中度水肿,胞质疏松,肝小叶紊乱,有细小的、无规律性散布于肝小叶中的淋巴组织细胞呈局灶性细胞聚集,为肝细胞点状坏死(Fig 4-3)。

Fig 4-3 HE staining of liver of rats (×200)
A: Normal group; B: AA group
2.4.4 AA大鼠脾脏病理学表现 结果显示:脾脏由脾白髓和红髓组成,白髓包括三个结构:淋巴小结、动脉周围淋巴鞘和边缘区,红髓由脾索和脾血窦组成。正常对照组脾脏结构清晰明显,白髓与红髓界限较明显,淋巴小结中央动脉和动脉周围淋巴鞘清晰可见,淋巴细胞密集;模型组白髓与红髓界限模糊,可见明显的白髓增生,出现生发中心,红髓增生,淤血增多,脾窦和红髓的外套丛充血,有粒细胞浸润(Fig 4-4)。

Fig 4-4 HE staining of spleen of rats (×200)
A: Normal group; B: AA group
2.4.5 AA大鼠肺脏病理学表现 结果显示:正常对照组肺组织中肺泡结构清晰,肺泡腔及支气管腔有少量红细胞。 模型组大部分肺泡结构显正常,少数肺泡间隙轻度增宽,未见明显炎症细胞及浸出物,偶见少量炎性细胞(Fig 4-5)。

Fig 4-5 HE staining of lungs of rats (×200)
A: Normal group; B: AA group
2.4.6 AA大鼠肾脏病理学表现 结果显示:正常对照组肾脏结构正常,包括皮质和髓质,含大量泌尿小管,其间有少量结缔组织、血管、神经等构成的肾间质,肾小管上皮细胞完好。模型组可见肾小球数量减少、体积增大,肾小管上皮细胞有水肿,有炎性细胞浸润(Fig 4-6)。

Fig 4-6 HE staining of kidney of rats (×200)
A: Normal group; B: AA group
2.4.7 AA大鼠肠系膜淋巴结病理学表现 结果显示:正常淋巴结表面有薄层结缔组织构成的被膜,有时可见穿通的输入淋巴管,被膜的结缔组织深入实质中,形成小梁。皮质由浅层皮质、副皮质区和皮质淋巴窦组成,髓质由髓索和髓窦组成;淋巴细胞呈圆形或椭圆形,边缘整齐。模型组肠系膜淋巴结髓质里的髓索中大量浆细胞浸润(Fig 4-7)。

Fig 4-7 HE staining of mesenteric lymph node of rats (×400)
A: Normal group; B: AA group
3 讨论
RA是一种系统性炎症免疫性疾病,以外周滑膜关节慢性炎性病变为主,并可累及其他组织和器官[2]。我们采用完全弗氏佐剂诱导Lewis大鼠,成功建立了AA模型,结果显示,AA大鼠原发侧和继发侧足爪及踝关节肿胀,活动障碍,全身评分、关节炎指数和足爪肿胀数都明显升高,发病率高达95%以上。RA的主要病理特点为大量浆细胞、巨噬细胞和淋巴细胞在滑膜中浸润,以及滑膜组织对软骨、肌腱、骨的侵蚀和损坏[8]。本研究显示,AA模型大鼠的踝关节病理见滑膜组织增生,炎细胞浸润,血管翳出现和骨破坏等,与RA具有类似的病理学表现。研究也表明,AA大鼠的主要组织器官出现明显病理学变化,如心脏心肌纤维丝束排列紊乱,间质可见明显水肿;肝脏肝索紊乱,肝细胞呈轻度或中度水肿;脾脏白髓与红髓界限模糊,可见明显的白髓增生,出现生发中心、红髓增生,淤血增多;肾脏肾小球数量减少、体积增大;肠系膜淋巴结髓质中大量浆细胞浸润;未见肺脏出现病理变化。
大鼠AA模型作为一种T细胞介导的免疫性炎症动物模型,免疫调节异常是其关键病理机制,与人的RA相似。RA滑膜中以处于激活状态的T淋巴细胞浸润为主,尤其是CD4+T 细胞[9]。CD4+T辅助细胞产生前炎症细胞因子,并释放大量炎性介质,可引起全身各系统、器官的广泛损伤。T细胞的活化在RA发病机制中至关重要[10-11]。我们的研究结果表明,与正常组比较,AA大鼠在炎症初期脾脏总T细胞(CD3+CD4+)、未致敏T细胞(CD4+CD62L+)、记忆T细胞(CD4+CD44+)细胞亚群比例都无明显变化,炎症高峰期总T细胞(CD3+CD4+)、未致敏T细胞(CD4+CD62L+)、记忆T细胞(CD4+CD44+)细胞亚群比例明显升高。提示AA模型CD4+T细胞亚群严重失衡,与AA大鼠的病理损伤密切相关。
根据其产生的细胞因子及其与之相关的活性功能的不同,将CD4+T细胞分为Th1、Th2、Treg和Th17四大亚群[12-13]。Th17 细胞是近年来研究发现的一种CD4+T细胞新亚型,可表达IL-17A、IL-17F、IL-6和TNF-α等炎性细胞因子,与许多炎症反应和自身免疫病的发生和发展有关,RA患者的血清和关节滑液中Th17细胞数量和IL-17的表达都明显升高[5,14]。有文献研究表明,用携带IL-17靶基因的病毒载体对小鼠进行免疫,在不使用佐剂的情况下就可以在小鼠体内诱生抗自身IL-17的抗体,并且产生自身IL-17抗体的小鼠与正常的小鼠相比,CIA的发病率明显降低[15]。本实验在AA模型上首次进行了疾病病程不同阶段(炎症早期和炎症高峰期)T细胞亚群的研究,结果显示:Th17亚群在炎症初期即明显升高,比炎症高峰期升高明显。
本实验对大鼠AA模型的多个重要脏器做了病理学观察,发现这些脏器都有明显的炎症反应,为综合探讨和分析关节局部和全身重要脏器的炎症性反应提供了实验依据。本实验还在AA模型上进行了疾病病程不同阶段(炎症早期和炎症高峰期)T细胞亚群的研究,结果表明,T细胞总(CD3+CD4+)、未致敏T细胞(CD4+CD62L+)和记忆T细胞(CD4+CD44+)在炎症初期没有明显变化,但在炎症高峰期均明显升高;Th17亚群在炎症初期即明显升高,比炎症高峰期升高明显,此为以病程不同阶段的T细胞亚群调控为策略或以Th17细胞为靶标的RA早期诊断和早期治疗及预后判断研究提供了实验依据。
[1] Pope R M. Apoptosis as a therapeutic tool in rheumatoid arthritis[J].NatRevImmunol, 2002, 2(7): 527-35.
[2] Young A, Koduri G. Extra-articular manifestations and complications of rheumatoid arthritis[J].BestPractResClinRheumatol, 2007, 21(5): 907-27.
[3] Firestein G S.Evolving concepts of rheumatoid arthritis[J].Nature, 2003, 423(6937): 356-61.
[4] Mu L, Sun B, Kong Q, et al. Disequilibrium of T helper type 1, 2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis[J].Immunology, 2009, 128(1 Suppl): e826-36.
[5] Sarkar S, Fox D A. Targeting IL-17 and Th17 cells in rheumatoid arthritis[J].RheumDisClinNorthAm, 2010, 36(2): 345-66.
[6] 宋姗姗,张玲玲,魏 伟. 实验性关节炎动物模型建立及病理机制研究进展[J]. 中国药理学通报,2011,27(12):1648-52.
[6] Song S S, Zhang L L, Wei W. Progress in animal models and their pathogenesis of experimental arthritis[J].ChinPharmacolBull, 2011, 27(12): 1648-52.
[7] Wang D, Chang Y, Wu Y, et al. Therapeutic effects of TACI-Ig on rat with adjuvant arthritis[J].ClinExpImmunol, 2011, 163(2): 225-34.
[8] Chang Y, Wu Y, Wang D, et al. Therapeutic effects of TACI-Ig on rats with adjuvant-induced arthritis via attenuating inflammatory responses[J].Rheumatology(Oxford), 2011, 50(5): 862-70.
[9] Zwerina J, Redlich K, Schett G, et al. Pathogenesis of rheumatoid arthritis: targeting cytokines[J].AnnNYAcadSci, 2005, 1051: 716-29.
[10] Zhang X, Nakajima T, Goronzy J J, et al. Tissue trafficking patterns of effector memory CD4+T cells in rheumatoid arthritis[J].ArthritisRheum, 2005, 52(12): 3839-49.
[11] 黄 蓓,汪庆童,刘亢亢,等. 类风湿关节炎发生发展中TNF-α信号通路与CD4+T细胞的关系[J]. 中国药理学通报,2013,29(7):900-3.
[11] Huang B, Wang Q T, Liu K K, et al. Relationship between TNF-signaling pathway and the function of CD4+T cell subsets in rheumatoid arthritis[J].ChinPharmacolBull, 2013,29(7):900-3.
[12] Firestein G S, Zvaifler N J. How important are T cells in chronic rheumatoid synovitis: II. T cell-independent mechanisms from beginning to end[J].ArthritisRheum, 2002, 46(2): 298-308.
[13] Romagnani S. Regulation of the T cell response[J].ClinExpAllergy, 2006, 36(11): 1357-66.
[14] Segal B M. Th17 cells in autoimmune demyelinating disease[J].SeminImmunopathol, 2010, 32(1): 71-7.
[15] Rohn T A, Jennings G T, Hernandez M,et al. Vaccination against IL-17 suppresses autoimmune arthritis and encephalomyelitis[J].EurJImmunol, 2006, 36(11): 2857-67.
Variation of T-cell subsets in spleen and tissue histopathological changes in rats with adjuvant arthritis
SUN Xiao-jing, XU Shu, JIA Xiao-yi, WEI Fang, YANG Xue-zhi, CHANG Yan, WEI Wei
(InstituteofClinicalPharmacology,AnhuiMedicalUniversity,KeyLaboratoryofAnti-inflammatoryandImmuneMedicineofEducationMinistryofChina,Hefei230032,China)
Aim To observe the variation of T-cell subsets in spleen in different courses of disease and tissue histopathological changes in rats with adjuvant arthritis (AA). Methods The model of rat AA was induced by complete Freund’s adjuvant into the right hind metatarsal footpad of 20 male Lewis rats. Arthritis was evaluated by total score, arthritis index and paw swelling number. The percentage of total (CD3+CD4+), memory (CD4+CD44+), no-sensitizated (CD4+CD62L+) and Th17 (CD4+IL-17+) on CD4+T cells in spleen were detected by flow cytometry on days 14 and 22 after immuniozation. The histopathological evaluation of heart, liver, spleen, lung, kidney, ankle joints and mesenteric lymph nodes were examined by hematoxylin and eosin (HE) stain. Results The onset of secondary arthritis appeared on about day 10 after immunization, with a peak onset on day 19. Systematic arthritis symptoms included front and hind paw swelling and redness (swelling was more apparent in the front rather than hind paws), nodule formation and redness on the ears, connective tissue swelling and redness of the nose and evident nodules and redness on the tail. Total score, arthritis index and the paw swelling numbers were enhanced in AA rats.Pathohistology of ankles joints showed hyperplasia, pannus formation, and inflammatory cells infiltration in AA rats. And pathohistology of heart, liver, spleen, kidney and mesenteric lymph nodes showed inflammatory changes. Compared with normal group, there was no change in the percentage of total, memory and no-sensitizated CD4+T cell in the early stage inflammation but they were significantly enhanced in the peak of inflammation. Th17 cell subsets were significantly enhanced in both of the early and peak of inflammation. Conclusion These findings suggest that abnormal T cell responses and tissue histopathological changes are important features of AA rats.
adjuvant arthritis; rheumatoid arthritis; Th17; histopathology; T cell subsets; disease course
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.016.html
2014-10-12,
2015-02-13
国家自然科学基金资助项目(No 81330081,81173075,31200675);安徽省科技攻关项目(No 1301042098)
孙晓静(1989-),女,硕士生,研究方向: 抗炎免疫药理学,E-mail :291921552@qq.com; 常 艳(1981-),女,博士,副教授,硕士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:changyan318@126.com; 魏 伟(1960-),男,博士,教授,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:wwei@ahmu.edu.cn
10.3969/j.issn.1001-1978.2015.04.008
A
1001-1978(2015)04-0475-07
R-332;R331.125;R392.12;R593.22;R684.3
