一种简便、可靠的免疫组化双重标记新方法
2015-06-09崔白苹高璀乡熊存全孙安阳
崔白苹,高璀乡,熊存全,孙安阳
(盐城卫生职业技术学院神经退行性疾病与修复实验室,江苏 盐城 224005)
◇实验方法学◇
一种简便、可靠的免疫组化双重标记新方法
崔白苹,高璀乡,熊存全,孙安阳*
(盐城卫生职业技术学院神经退行性疾病与修复实验室,江苏 盐城 224005)
目的 探索一种简便可靠、清晰的免疫组化双重标记方法,可用普通光学显微镜观察,并能长期保存染色结果。方法 免疫组化双标中,均使用辣根过氧化物酶(HRP)连接的二抗,底物分别选用二氨基联苯胺(3,3′-diaminobenzidine, DAB)和镍增强DAB。第一标DAB染色完成后切片煮沸4~5 min以灭活HRP,完全阻断交叉反应,然后进行第二标镍增强DAB染色。结果 ① 切片煮沸5 min,可完全灭活残余的HRP酶活性,防止染色反应交叉;5%的H2O2灭活HRP酶不完全,易产生交叉反应;短暂高温灭活HRP不损坏之前的特异性DAB染色或造成组织损伤。② 第一标DAB的棕黄色与第二标镍增强DAB的紫蓝色反差大、背景低;颠倒底物使用次序将损害双标质量。此外,双标切片可采用传统的中性树胶封片,染色结果能恒久保存。结论 采用同一种酶标记系统建立了简便、可靠的免疫组化双标新方法。该方法标记结果清晰、操作简便、试剂易得,有较大应用价值。
免疫组化;辣根过氧化物酶;二氨基联苯胺;镍;方法;双重标记;交叉反应
在基础和临床病理形态学研究中,免疫组织化学染色是一种很常用的技术。在同一张组织切片上免疫组织化学双重标记(免疫组化双标)可以了解两种抗原分子之间不同的组织细胞分布,以分析两者相互关系[1]; 其结果对比直观,信息量远比传统单染高,并可克服由于切片间各种差异而引起的时间或空间的样本误差,对标本量少的病理组织更具有显著优势,给科研人员和病理科医师带来极大便利。免疫组化双标有荧光双标和白光(明场)双标。目前常用的荧光双标[2]虽然操作较简便,但也有染色原始结果难以长期保存、拍摄过程中荧光容易淬灭等局限。明场双标的染色结果如果能采用树脂封片,便能长期保存,对临床病理科,特别是肿瘤诊断[3]以及研究原始结果的保存非常有价值。
文献报道的明场双标许多采用碱性磷酸酶和辣根过氧化物酶(horseradish peroxidase, HRP)双酶显色系统[4-7],碱性磷酸酶的底物多选用5-溴-4-氯-3-吲哚-磷酸盐/硝基四唑氮蓝(BCIP/NBT),HRP的底物多选用3-氨基-9-乙基咔唑 (3-amino-9-ethylcarbazole, AEC)或二氨基联苯胺(3,3′-diaminobenzidine, DAB)。上述双标方法中,底物BCIP/NBT与AEC的呈色反应存在一定程度的相互干扰[6],使染色结果反差变小;由于AEC等底物的反应产物[8]在二甲苯中可溶,故只能采用水性封片,加之BCIP/NBT和AEC的反应产物容易扩散,使染色结果也不能长期保存。另一方面,早期文献中有将金属离子增强DAB与DAB试用于免疫组化双标的报道[9],而后又有研究者将DAB和镍增强DAB方法加以改变或发展,用于特定的实验目的,如免疫组化与原位杂交杂合双标[10]、免疫电镜双标[11]。然而,已报道的DAB与金属离子增强DAB明场双标方法存在一个共同的缺点,即未设计有效的处理以阻断双标之间潜在的交叉反应,进而使双标信号的颜色反差有所下降。另外,已有的明场双标方法所用的试剂和操作步骤常较复杂。实际上,由于方法学的限制,发表文献中很难见到清晰、高反差的明场双标结果。因此,建立一种简单可靠的明场免疫组化双标记方法,并产生高质量的双标染色结果,将有十分重要的应用价值。
本文将介绍一种简便的免疫组化双重标记方法,其特点是:(1)采用单一的HRP酶系统;(2)第一次免疫组化标记后,通过短暂煮沸完全灭活第一标残余的HRP酶活性,阻断其与第二次免疫组化染色产生交叉反应;(3)底物依次使用DAB和镍增强DAB,次序不宜颠倒;(4)双标信号棕黄色与紫蓝色对比鲜明,背景清晰。此外,可采用常规的二甲苯和中性树胶封片,染色结果可以长期保存;染色时间较同类方法短,连接HRP的二抗可以与免疫印迹实验通用,经济实用。
1 材料与方法
1.1 试剂和实验动物抗体:见Tab 1。
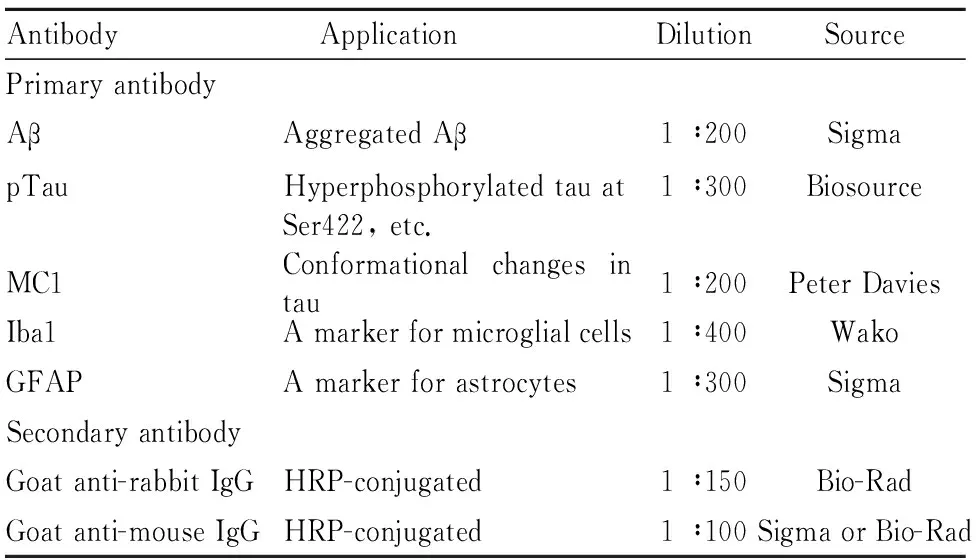
Tab 1 Antibodies used in this study
试剂:DAB、Trizma和Imidazole购自Sigma。其他化学试剂除特别说明外,均购自生工生物工程(上海)股份有限公司。牛血清白蛋白和山羊血清购自Life Technologies(Gibco)。
动物:阿尔茨海默病(Alzheimer’s disease, AD)三转基因小鼠的建立与基因鉴定参见本研究组之前发表的文献[12-14]。实验动物的使用遵守美国国家卫生机构发布的《实验动物保护和使用指南》(NIH,Publication No.85-23,1996修订版)相关规定。实验小鼠在温度22 ℃、湿度30%~40%的环境中饲养,12 h明暗周期,自由饮水和摄食。体质量20~30 g。
1.2 免疫双标染色
1.2.1 组织切片 AD三转基因小鼠和对照小鼠以8%的水合氯醛(380 mg·kg-1)腹腔注射麻醉,常规的磷酸盐缓冲液(PBS:NaCl 137 mmol·L-1, Na2HPO44.3 mmol·L-1, KH2PO41.4 mmol·L-1, KCl 2.7 mmol·L-1, pH 7.4)和4%~8%福尔马林缓冲液自心脏灌流固定,小鼠脑经Mouse Brain Matrix辅助切块,再后固定12~24 h。冰冻切片(漂片法或贴片法)和石蜡切片(贴片法)均可以采用此双标方法。冰冻切片的组织块分别经20%~30%的蔗糖梯度处理。以小鼠脑组织为例,连续冰冻切片厚度可以选择14 μm。小鼠脑组织石蜡切片,厚度通常为5~8 μm。经过二甲苯脱蜡和酒精梯度浸水后PBS漂洗。
1.2.2 非特异性阻断 组织切片在阻断缓冲液中孵育1~3 h。阻断缓冲液的基础成分为磷酸盐缓冲液,其中含 0.4% Triton-X 100、1%牛血清白蛋白、5%山羊血清。
1.2.3 第一标抗体孵育 抗体孵育可采用漂片试管法(切片置于加抗体液的eppendorf管中)或贴片滴片法(抗体液滴于切片上)。一抗在4℃环境中孵育过夜或6 h,PBS漂洗3×10 min或更长时间,再与一抗种属相匹配的二抗孵育约2 h,然后用PBS漂洗3×10 min。如果第一标的信号很弱,选项之一是改用亲和素-生物素-过氧化物酶复合物法(ABC法)以放大第一标的抗原信号。第一标改用ABC法与之后的第二标方法无冲突,但同一实验不可将第二标也改为ABC方法,否则会发生新的交叉反应。贴片法通常需要适当提高抗体浓度。
1.2.4 第一标呈色反应 完成抗体孵育的切片依次用PBS和含0.8% NaCl的Trizma-Imidazole (TI) 缓冲液(50 mM Trizma, 10 mM Imidazole)漂洗,再进行DAB呈色反应,然后转移至TI 缓冲液中止呈色反应。DAB反应液的基础成分为TI 缓冲液,含0.05% DAB、0.01% H2O2。DAB呈色反应通常需30 s至3 min,冰冻切片所需反应时间一般较石蜡切片短。不同的实验尚可根据一抗与二抗的具体情况适当调整反应液的DAB浓度,以达到理想的呈色效果。另外,由于本方法在一抗与二抗充分漂洗以及HRP活性好的情况下背景很低,如果遇到第一标的抗原较弱时也可将呈色反应时间延长至5~10 min,以提高检测灵敏度。
1.2.5 残余过氧化物酶灭活 完成第一标染色的切片转移至加PBS缓冲液的eppendorf管中,在沸水浴上热处理4~5 min以灭活残余的过氧化物酶活性。水浴仅维持轻度沸腾,煮沸时间通常不超过6 min。漂片法加热灭活过程中如果组织切片逐渐上浮至PBS液面,要及时将eppendorf管取离,冷却数秒后轻摇试管便可使切片沉降,而后重新置于沸水浴上。加热处理结束后立即插于冰上冷却。贴片法选用可插玻片或可放小玻片架的组织缸进行酶灭活处理。盛适量PBS液的组织缸在轻沸水浴上预热至近100 ℃;完成第一标的玻片(或连带小玻片架)快速插入预热的PBS液中,维持热处理4~5 min;操作过程中注意避免切片干燥。为选择合适的灭活过氧化物酶方法,我们还进行了多种尝试,包括不同浓度的H2O2处理、不同灭活温度或不同灭活时间以及两者组合。其他灭活方法与煮沸灭活的效果进行了比较,煮沸灭活的方法由于操作简便、效果可靠而被选用。
1.2.6 第二标抗体孵育 第一标灭活完成后的组织切片仅需短时阻断10 min(可省),第二标一抗在4 ℃孵育过夜或缩短至6 h,再与第二标一抗相匹配的二抗孵育1~2 h,漂洗方法与第一标相似。
1.2.7 第二标呈色反应 第二标的一抗和二抗孵育完成后呈色反应同前,不同之处在于采用镍增强型DAB反应液。镍增强型DAB反应液是在之前的DAB反应液中加入0.02% 硫酸镍(无水或六水物)。镍增强DAB呈色反应通常需20 s至2 min。
1.2.8 封片 漂片法的组织切片进PBS漂洗干净后贴片。室温干燥后二甲苯透明、中性树胶封片。染色后切片用连接数码相机的显微镜(Olympus, BX51 或BX63)成像。
1.2.9 对照试验 (1)不同方法灭活HRP酶的效果比较:平行处理的相邻切片在第一标(如Aβ)结束后,分别用以下方法灭活残余的过氧化物酶活性:① 切片加入含PBS试管,沸水浴上煮沸5 min;② 5% H2O2处理组织切片5 min;③ 金属恒温浴不同温度60℃、75℃、90℃,10~15 min;④ 1 mol·L-1HCl 处理 10 min。灭活处理结束后,上述切片平行标记第二标。(2)DAB和镍增强DAB使用次序对双标结果的影响:在平行操作的双标实验中,一部分切片用之前的常规次序,另一部分切片颠倒底物使用次序,即第一标用镍增强DAB,第二标用DAB。比较底物使用次序不同对双标结果的影响。
2 结果与分析
2.1 本免疫双标方法能产生清晰、高反差的双标结果本工作起始于已发表文献中尚缺乏理想的明场双标方法,不能产生高质量的双标结果。我们经过探索,建立一种清晰、高反差的明场双标方法,以满足基础研究和临床病理诊断的需求。按照上述方法部分的步骤正确操作,本方法通常可以产生清晰、高反差的双标结果。以检测AD三转基因小鼠脑内病理为例,DAB标记的Aβ斑块与镍增强DAB标记的磷酸化Tau病理色彩对比鲜明,两信号之间无交叉染色(Fig 1 A~C)。另外,染色背景较浅,如无弥散的特异性信号,背景呈灰白色。
2.2 底物使用次序明显影响双标结果通常情况下,该免疫双标方法第一标使用DAB,第二标使用镍增强DAB, 双标结果清晰(Fig 2A)。若在平行情况下仅仅将底物的使用次序颠倒,如第一标使用镍增强DAB标记Aβ,第二标使用DAB标记pTau,即会出现第二标背景较深,而且标记信号变浅,使第二标信号与背景对比度显著下降(Fig 2B)。
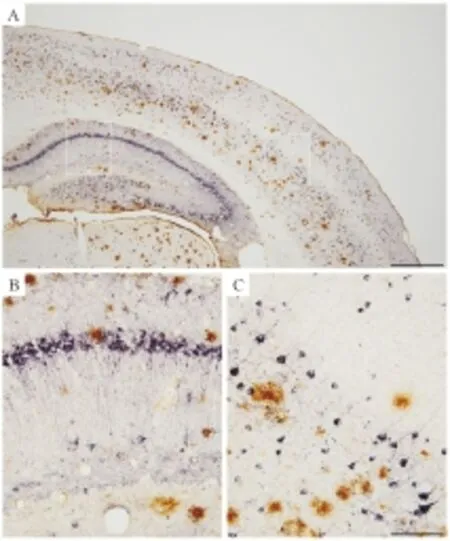
Fig 1 A novel method produces high-quality immunohistochemical double labeling
A:A double labeling of amyloid plaques (brown) and hyperphosphorated tau pathology (purple) in an Alzheimer’s disease transgenic mouse model by using DAB firstly and Nickel enhanced DAB (Ni) secondly; B and C: The images in high magnification from the frames in panel A. Scale bar=500 μm in A, 100 μm in B, C.
为检验改变底物使用次序将影响双标结果这一现象是否具有普适性,我们试验了不同类型的抗原或不同丰度的抗原加以验证。如双标的第一标使用DAB标记Tau病理构象(MC1),第二标使用镍增强DAB标记小胶质细胞(Iba-1),仍然能获得背景较浅的正常染色结果(Fig 2C)。在病理抗原丰度很低的情况下,如果改变底物使用次序(先使用镍增强DAB,再用DAB),仍然产生较深的染色背景(Fig 2D)。因而,在本方法中颠倒底物使用次序将影响双标结果对于不同情况具有一定普适性。
2.3 煮沸法灭活HRP较传统H2O2方法可靠在实验中,我们试验了多种不同方法灭活HRP酶的效果。以煮沸法与传统H2O2方法进行比较为例:第一标Aβ(内嗅皮层和杏仁核)结束后用5% H2O2处理组织切片,第一标残余的HRP酶活性未被完全灭活,在第二标pTau时出现与第一标染色反应交叉,第一标Aβ信号颜色变深,与第二标pTau反差下降,背景染色叠加(Fig 3A, C)。如果第一次染色后,用煮沸法灭活HRP酶活性(Fig 3B,D),则不出现染色反应交叉,背景较浅。煮沸灭活时间以4~5 min较适宜,通常不超过6 min;煮沸时间过长(如>10 min)将逐步减弱一标DAB信号强度。其他灭活HRP酶的试验方法(如60℃或75℃)因为在标记抗原不同的实验中效果不恒定而被弃用。
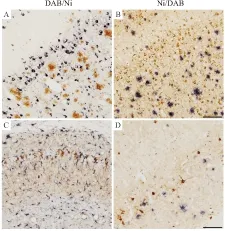
Fig 2 Effects of substrate application orders on the quality of immunohistochemical double labeling in different conditions
A and B: In Alzheimer’s disease transgenic mice with abundant pathology, a double labeling of amyloid plaques and hyperphosphorated tau pathology by using DAB firstly and Nickel enhanced DAB (Ni) secondly (DAB/Ni), or reversely using Nickel enhanced DAB firstly and DAB secondly (Ni/DAB). The labeling quality was ruined with reversely applying substrates of DAB and Nickel enhanced DAB; C: A double labeling using different antibodies for tau pathology (MC1) with DAB (brown) firstly, followed by microglial cells (Iba1) with Nickel enhanced DAB (purple); D: In low density of Alzheimer's pathology, labeling amyloid pathology (Aβ) with Nickel enhanced DAB (purple) firstly, followed by tau pathology (pTau) with DAB (brown). In the conditions of either different antibodies or low antigen levels, applying Nickel enhanced DAB firstly still generated higher background staining. Scale bar=100 μm.
2.4 免疫组化双标染色的常见失误分析按照上述方法部分正确操作,通常情况下可获得高质量双标结果。但是,任何一个或多个关键错误都可能使结果质量下降甚至双标染色失败。常见的失误包括:第一标残余HRP酶活性灭活不完全导致交叉反应(Fig 4A);高丰度抗原使用过高浓度抗体、过长的孵育时间或反应时间,原始或交叉反应均可导致抗原集中部位出现组织损伤(Fig 4B);两次标记强度未大致平衡,高丰度第一标反应过度,导致较低丰度的第二次标记失败(Fig 4C)。免疫组化双标常见问题及处理办法见Tab 2。
3 讨论
本文采用同一种酶标记系统建立了简便、可靠、清晰的免疫组化双标方法。该方法试剂易得、操作简便、如正确操作染色结果质量高、稳定可靠。由于本方法不需要特殊的试剂与设备,将可广泛地应用于临床和实验室研究。
早期文献中已有将金属离子增强DAB和DAB试用于免疫组化双标的报道,但该文介绍的双标方法[9]存在若干缺陷:(1)未做阻断交叉反应的处理,仅通过呈色反应先深色,后浅色,以忽略交叉反应。(2)底物使用次序是先采用金属钴(Co)加强DAB,而后使用DAB,可能导致第二标抗原性明显下降,同时产生较深的染色背景。(3)采用两种较为复杂的酶显色系统(ABC与PAP法)。近期报道的硫化物-银-金加强法[11]用于免疫电镜双标具有明显优点,但用于光镜水平的免疫组化双标并无优势,因为该方法不仅步骤繁琐、需要使用贵金属试剂,而且一标颜色转换后还遗留少量致密的杂色信号,易与二标信号相混淆,使双标颜色反差变小。实际上,由于目前文献中尚缺乏简便和反差大的明场双标方法,需要长久保存结果的免疫组化染色还是大量采用单标记方法,需要标记不同抗原时通常标记在不同的或者相邻的组织切片上。因而迫切需要建立一种简便、清晰的明场免疫组化双标方法。
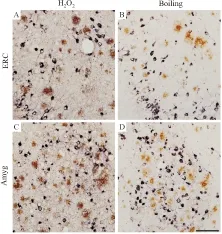
Fig 3 Comparison between H2O2 treatment and boiling in deactivating residual HRP activity
Double labeling of amyloid pathology (Aβ, brown) and tau pathology (pTau, purple) in triple transgenic mice model of Alzheimer’s disease. A and C: Sections were treated with 5% H2O2for 5 min when the first labeling of Aβ is done. B and D: Sections were boiled for 5 min after the first labeling. ERC: Entorhinal cortex; Amyg: Amygdala. Scale bar =100 μm.
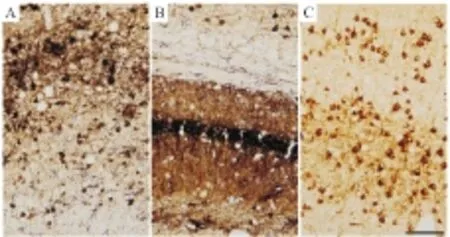
Fig 4 Various mistakes produce a failure in the immunohistochemical double labeling
A: An incomplete deactivation of residual HRP decreased the labeling contrast between tau pathology (dark brown) and GFAP (purple). B: Over staining of tau pathology in the same double labeling damaged tissue integrity in hippocampus; C: An excessive DAB reaction for tau pathology in the first labeling prevented the second labeling for amyloid pathology. Scale bar =100 μm.

Tab 2 Troubleshooting guide for the immunohistochemical double labeling method
本免疫组化双标记方法采用同一种酶标记系统,其关键之一是有效灭活第1次标记后残余的过氧化物酶活性。我们最终采用含组织切片的PBS在沸水浴上平缓煮沸4~5 min以灭活残余过氧化物酶活性的方法。与传统的H2O2灭活法相比,其操作简单、灭活效果可靠,同时短暂热灭活不损伤组织切片,也不影响第二标的抗原活性。实验探索中,我们也尝试用水浴或金属恒温浴试验不同温度(如60℃、75℃、90℃)的酶灭活效果,虽然在一部分实验中也观察一定的灭活效果,但在不同实验中重现性差,还需要特别仪器控制温度,故被弃用。
碱性磷酸酶/HRP双酶系统的常用底物为BCIP/NBT与AEC,其呈色反应产物稳定性欠佳,可溶于组织病理学常用的有机溶剂。本免疫组化双标方法选用DAB和镍增强DAB染色,颜色对比鲜明,背景清晰,尤其是双标的反应产物均稳定,可以恒久保存原始染色结果。采用DAB和镍增强DAB染色,底物使用次序需要合理考虑。一般先用DAB底物对丰度相对较低或者分布较为局限的抗原进行染色。若先用镍增强DAB后再用DAB标记,可能会导致第二标信号降弱、背景加深,从而使双标信号对比不明显。一种例外的情况是:其中一标的信号相当微弱和弥散,另一标的信号则很强,两者强度差别巨大;此时可以考虑先用镍增强DAB标记弥散弱信号,再注意调节DAB反应时间等因素恰当标记强信号。
采用本免疫组化双标获得高质量的染色结果,还需要注意以下要点:(1)组织切片制备质量良好。(2)通过预实验,获得特定抗体浓度和抗原丰度的经验。高丰度抗原如使用过高浓度抗体且呈色反应时间偏长,可导致组织切片局部损伤。(3)选择购买活性高的HRP产品,是缩短反应时间、获得清晰的染色结果和保持较好检测灵敏度的关键之一。(4)平衡第一标与第二标的染色强度。尤其是第一标染色强度尽可能适中,过强的第一标在某些情况下可以导致第二标抗原性下降。(5)在组织切片加热灭活HRP酶等操作中要防止组织切片快速干燥而损失抗原性。
本文介绍的免疫组化双标方法适用面广,冰冻和石蜡切片均可采用。适当加以改变还可以进一步提高灵敏度或发展成三标甚至多标方法。例如,与我们之前报道的序贯染色法[15]相结合,加入荧光方法与抗体洗脱、原位杂交或者化学染色方法,可以同一标本上标记出更多的组织信号。
(致谢:本项工作是在“盐城卫生职业技术学院神经退行性疾病与修复实验室”完成。)
[1] 高美钦,袁芳平,黄爱民,等. 弹力纤维染色与免疫组织化学双重染色技术[J]. 中华病理学杂志, 2003, 32(2):176- 7.
[1] Gao M Q, Yan F P, Huang A M, et al. Elastic fibers staining and immunohistochemical double staining techniques[J].ChinJPathol, 2003, 32(2):176- 7.
[2] Chen X, Cho D B, Yang P C. Double staining immunohistochemistry[J].NAmJMedSci, 2010, 2(5): 241-5.
[3] Zhou Z H, Xu G F, Zhang W J, et al. Reevaluating significance of perineural invasion in gastric cancer based on double immunohistochemical Staining[J].ArchPatholLabMed, 2014, 138(2):229-34.
[4] 段 红,李少林,唐树彬,等. 食管癌人源噬菌体单链抗体库的构建与初步筛选[J]. 中国药理学通报,2007, 23(4):451-8.
[4] Duan H, Li S L, Tang S B, et al. Construction and screening of human-originated phage single-chain antibody library associated with esophageal cancer[J].ChinPharmacolBull, 2007, 23(4):451-8.
[5] 黄 莺,王康敏,康安静,等. bFGF与ki-67双重免疫组化染色法[J] .诊断病理学杂志,2002, 9(3):65.
[5] Huang Y, Wang K M, Kang A J, et al. Immunohistochemistry double labeling of bFGF and ki-67[J].ChinJDiagnPathol, 2002, 9(3):65.
[6] 陈 罡,罗殿中,韦康来,等. 双重免疫组化染色法的操作体会[J]. 实用医技杂志,2004, 6(11):721-2.
[6] Chen G, Luo D Z, Wei K L, et al. Manipulation experience of double immunohistochemistry staining[J].JPracMedTech, 2004, 6(11):721-2.
[7] 陈 罡,周英琼,侯巧燕,等. p53与CK双重免疫组化染色法[J]. 诊断病理学杂志,2004, 11(6):69-70.
[7] Chen G, Zhou Y Q, Hou Q Y, Chen F. Immunohistochemistry double labeling of p53 and CK[J].ChinJDiagnPathol, 2004, 11(6):69-70.
[8] 许云禄,刘广芬,王晴川. 蕲蛇酶对血管内皮细胞纤维蛋白溶解功能的影响[J]. 中国药理学通报,2003,19(7):814-8.
[8] Xu Y L, Liu G F, Wang Q C. Effect of acutobin on the activity of fibrinolysis in cultured human umbilical vein endothelial cells[J].ChinPharmacolBull,2003,19(7):814-8.
[9] Hsu S M, Soban E. Color modification of diaminobenzidine (DAB) precipitation by metallic ions and its application for double immunohistochemistry[J].JHistochemCytochem,1982,30(10):1079-82.
[10] Mullink H, Vos W, Jiwa M, et al. Application and comparison of silver intensification methods for the diaminobenzidine and diaminobenzidine-nickel endproduct of the peroxidation reaction in immunohistochemistry and in situ hybridization[J].JHistochemCytochem,1992, 40(4):495-504.
[11] Dobó E, Takács V T, Gulyás A I, et al. New silver-gold intensification method of diaminobenzidine for double-labeling immunoelectron microscopy[J].JHistochemCytochem,2011, 59(3):258-69.
[12] Zhang Q P, Zhang X G, Sun A Y. Truncated tau at D421 is associated with neurodegeneration and tangle formation in the brain of Alzheimer transgenic models[J].ActaNeuropathol, 2009, 117(6), 687-97.
[13] Zhang Q P, Zhang X G, Chen J,et al. Role of caspase-3 in tau truncation at D421 is restricated in transgenic mouse models for tauopathies[J].JNeurochem, 2009, 109(2), 476-84.
[14] Lv G L, Cui B P, Lan H C, et al. Diarylethene based fluorescent switchable probes for the detection of amyloid-β pathology in Alzheimer's disease[J].ChemCommun, 2015, 51(1):125-8.
[15] Sun A Y, Nguyen X V, Bing G. Comparative analysis of an improved thioflavin-S stain, Gallyas silver stain, and immunohistochemistry for neurofibrillary tangle demonstration on same sections[J].JHistochemCytochem, 2002, 50(4): 463-72.
A novel,convenient and reliable method for immunohistochemical double labeling
CUI Bai-ping, GAO Cui-xiang, XIONG Cun-quan, SUN An-yang
(LaboratoryofNeurodegenerativeDiseasesandRepair,YanchengInstituteofHealthSciences,Yancheng,Jiangsu224005,China)
Aim To establish a convenient,reliable and high-contrast method of immunohistochemical double labeling,which can be observed with ordinary optical microscopy, and the staining results can be preserved permanently. Method This double labeling method employed the single detection system, HRP conjugated second antibodies, and used the substrates of 3,3′-diaminobenzidine (DAB) and Nickel-enhanced DAB respectively. When the first labeling was completed, HRP was totally inactivated by boiling for 4~5 min to prevent the cross-reaction in the second labeling. Results (1) Boiling for 5 min could completely inactivate HRP activity, whereas 5% H2O2treatment only reduced HRP activity, and residual enzyme activity generated the cross-reaction between two labeling. Boiling for a few minutes did not damage positive DAB staining in the first labeling or tissue integrity. (2) There was a sharp contrast between DAB in brown and Nickel enhanced DAB in purple-blue, which also gives clean backgrounds; reversely applying the substrates will ruin the quality of double labeling. In addition, the above method allowed conventional mounting protocol using xylene and Permount, instead of a water-based mounting medium, thus the staining results could be permanently preserved. Conclusion As the same HRP detection system is employed, this novel double labeling method is simple, convenient and reliable. The method would bear broad applications in basic and clinical research.
immunohistochemistry; horseradish peroxidase; 3,3′-diaminobenzidine; Nickel; method; double labeling; cross-reaction
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.028.html
2014-12-02,
2015-01-14
国家自然科学基金资助项目(30470594, 30772282)
崔白苹(1987-)女, 硕士 ,讲师, 研究方向:神经退行性疾病研究,E-mail: cuibaiping@126.com; 孙安阳(1966-)男, 博士,教授, 研究方向:神经退行性疾病研究, 通讯作者,E-mail: asun08@fudan.edu.cn
10.3969/j.issn.1001-1978.2015.03.028
A
1001-1978(2015)03-0436-06
R392-33;R392.11;R977.3