α-维尼非林经线粒体凋亡途径诱导K562细胞凋亡
2015-06-09龚福恺王晓琴李照雪孔庆军
龚福恺,王晓琴,李照雪,孔庆军,张 波
(1.石河子大学药学院,2. 省部共建新疆特种资源植物药重点实验室,3. 石河子大学生命科学学院,新疆 石河子 832002)
α-维尼非林经线粒体凋亡途径诱导K562细胞凋亡
龚福恺1,2,王晓琴1,李照雪1,孔庆军3,张 波1,2
(1.石河子大学药学院,2. 省部共建新疆特种资源植物药重点实验室,3. 石河子大学生命科学学院,新疆 石河子 832002)
目的 旨在研究α-维尼非林(α-viniferin)对人慢性髓系白血病细胞K562的作用与相关机制。方法 MTT法评价α-viniferin对K562细胞的细胞毒活性。采用细胞形态学和生物化学方法检测细胞凋亡。通过化学荧光法对细胞内线粒体膜电位、caspase-9、caspase-3活性分析。通过半定量RT-PCR表达分析来确定Bcl-2家族相关基因在α-viniferin诱导K562细胞凋亡中的作用。结果 α-viniferin能抑制K562细胞增殖,呈剂量和时间依赖性,IC50为13.61 mg·L-1。α-viniferin引起K562细胞出现死亡并伴随有染色质聚集、核破碎、凋亡小体等典型的凋亡形态学特征;此外还伴随有线粒体膜电位显著降低,caspase-9、caspase-3活性升高等现象;α-viniferin(2~32 mg·L-1)引起K562细胞caspase-3 mRNA表达持续升高,Bax、Bad、Bim、Bid促凋亡基因mRNA表达增加,而Bcl-2、Bcl-xL抗凋亡基因mRNA表达持续下降。结论 α-viniferin通过线粒体途径诱导K562细胞凋亡。
α-维尼非林;凋亡;Bcl-2家族基因;caspase活性;K562细胞;线粒体凋亡途径
viniferin是葡萄等植物产生的一类以二苯乙烯骨架为主的多酚产物,因在抵抗病菌侵染时承担重要保护作用又称为葡萄抗毒素[1]。这类产物近年来被证明具有很好的抗氧化、心血管保护及抑制肿瘤血管新生等活性[2]。α-维尼非林(α-viniferin,Fig 1)作为其中的典型代表被证实对白血病(leukemia)细胞的敏感程度较高[3]。但国内鲜有研究报道α-viniferin对白血病的药理作用。因此本研究拟以慢性髓系白血病K562细胞为模型,研究α-viniferin对K562细胞促凋亡作用与相关机制。
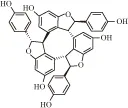
Fig 1 Structure of α-viniferin
1 材料与方法
1.1 材料人慢性髓系白血病K562细胞购自中国科学院上海细胞库;α-viniferin购自云南西力生物技术有限公司。RPMI 1640细胞培养基购自美国Gibco公司;新生牛血清购自杭州四季青生物工程材料有限公司。Giemsa染料、二甲基亚砜(DMSO)、吖啶橙(AO)、溴化乙锭(EB)购自美国Sigma公司;Hoechst 33258染料购自北京索莱宝科技有限公司;细胞凋亡线粒体膜电位检测试剂盒购自南京建成生物工程研究所;caspase-3、caspase-9荧光定量检测试剂盒购自美国Biovision公司;UNIQ-10柱式TRIzol总RNA提取试剂盒购自上海生工生物工程股份有限公司;cDNA逆转录试剂盒购自TaKaRa公司。
1.2 主要仪器CO2细胞培养箱(Thermo Forma,美国Thermo公司);Centrifuge 5430R、5424低温离心机(德国Eppendorf公司);Obsever A1倒置荧光显微镜(德国ZEISS公司);Varioskan Flash 3001多功能酶标仪(美国Thermo公司);PCR仪(德国Eppendorf公司)、UVP凝胶成像系统 (美国Spring公司)。
1.3 细胞培养K562 细胞采用含10%的新生牛血清 RPMI 1640,青霉素(100 kU·L-1) 和链霉素(50 mg·L-1),在 37 ℃、5% 的CO2孵育箱中培养,取对数生长期细胞用于实验。
1.4 α-viniferin对 K562 细胞增殖的抑制作用96孔培养板上每孔接种1×104个细胞,培养液体积为200 μL,实验组分别加入不同浓度(0、0.5、2、8、32、128 mg·L-1)的α-viniferin,对照组不加药,每组设 6 个复孔,37 ℃分别培养12、24、48 h,每孔加入 5 g·L-1的MTT溶液20 μl,继续培养4 h,800×g离心5 min 弃上清,加入DMSO 150 μl,振荡10 min,酶标仪检测490 nm 处的吸光度(OD)值,并绘制相应的抑制率-浓度曲线[4]。
1.5 细胞凋亡检测6孔培养板上每孔种植 5×105个细胞,体积为3 ml,实验组加32 mg·L-1的α-viniferin,对照组不加药,37 ℃分别培养24 h,800×g离心5 min 弃上清收集细胞,分别用Hoechst 33258[5]、Giemsa[6]、AO/EB法染色[7],可见光、荧光观察拍照。
1.6 细胞凋亡线粒体膜电位检测不同浓度(0、2、8、32 mg·L-1)α-viniferin处理细胞24 h,收集细胞,取 500 μL JC-1工作液将细胞均匀悬浮,37 ℃,5% CO2的培养箱中孵育 15~20 min;室温离心(300×g,5 min),收集细胞,用1×孵育缓冲液洗2次;吸取500 μL 1×孵育缓冲液重新悬浮细胞;酶标仪对其进行荧光检测:激发光:488 nm,发射光:530 nm。
1.7 caspase-3、caspase-9活性检测药物诱导细胞凋亡。收集2×106个细胞。转移细胞到冷冻的50 μL cell lysis Buffer中,冰上孵育细胞10 min。每个样品加入50 μL的2 × Reaction Buffer(含10 mmol·L-1DTT),加5 μL 1 mmol·L-1LEVD-AFC底物(终浓度为50 μmol·L-1)。37 ℃孵育2 h。将样品转移至96孔板中,荧光检测:激发光:400 nm;发射光:505 nm。
1.8 α-viniferin对K562细胞凋亡相关基因mRNA表达的影响分别使用 α-viniferin (0、2、8、32 mg·L-1)处理24 h。本实验使用相对定量 RT-PCR方法来检测细胞凋亡相关分子Bad、Bid、Bim、Bax、Bcl-2、Bcl-xL的表达变化。使用 UNIQ-10柱式TRIzol总RNA提取试剂盒提取总 RNA,检测定量RNA水平及含量,并用cDNA反转录试剂盒将RNA逆转录为cDNA。PCR 扩增条件为: 热启动,起始温度 94 ℃,3 min; 变性 94 ℃,30 s; 复性 58 ℃,30 s; 延伸 72℃,45 s;扩增循环数40。PCR 产物经琼脂糖凝胶(2%) 电泳后,使用核酸染料染色,凝胶成像系统拍照分析。引物序列及退火温度见Tab 1。
2 结果
2.1 α-viniferin抑制K562细胞增殖α-viniferin对K562细胞的抑制作用随作用浓度与时间增加而增强。如Fig 2 所示呈现一定的时效与量效关系。浓度小于8 mg·L-1时α-viniferin对K562细胞的抑制率较低,大于此浓度时抑制率呈快速上升趋势。24 h半数抑制浓度(IC50)为13.61、128 mg·L-1处理48 h细胞几乎全部死亡(抑制率为97.07%)。根据这些结果,后续实验选择药物浓度32 mg·L-1、处理时间为24 h进行研究。
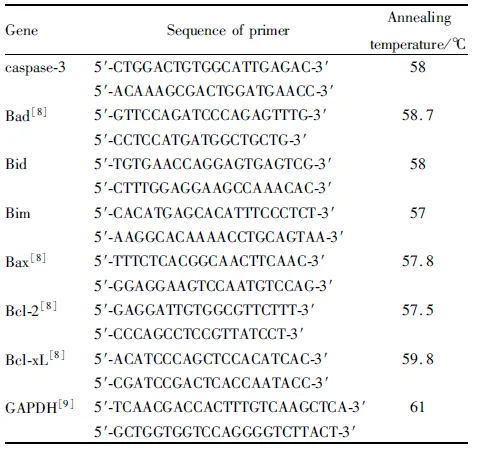
Tab 1 Primer sequence table

Fig 2 Inhibitory rate of α-viniferin on K562 cells after
2.2 α-viniferin诱导K562细胞凋亡形态变化普通光镜下观察正常对照组K562细胞呈规则圆形、透明、折光性好,边界清晰光滑整齐,细胞大小均一(Fig 3A、3E)。α-viniferin(32 mg·L-1)处理24 h后,K562细胞破裂且呈大小不均一的囊泡化特殊结构,折光性降低,边界模糊不完整,细胞出现明显凋亡形态(Fig 3B)。细胞核DNA经Hoechst 33258荧光试剂染色后,空白对照组细胞核形态规则,呈弥散均匀的圆形荧光(Fig 3C)。药物处理组则出现浓染致密的颗粒块状荧光,此现象则表现了凋亡所特有的核固缩、染色质高度凝聚和碎裂不均一化形态(Fig 3D)。通过Giemsa染色可以看出药物处理组细胞边界不规则出现凋亡小泡(Fig 3F)。经AO/EB双染可以看出α-viniferin处理K562细胞后出现早期凋亡和晚期凋亡,但未发现细胞坏死现象(Fig 3F、3H)。

Fig 3 Cellular morphological characteristic changes of K562 cells treated by α-viniferin (400×)
A、C、E、G:K562 cells without α-viniferin treatments; B、D、F、H:K562 cells treated with 32 mg·L-1α-viniferin for 24 h.
2.3 α-viniferin对K562细胞线粒体膜电势影响的量效关系α-viniferin引起K562细胞线粒体膜电势下降呈药物浓度依赖性变化(Fig 4)。在α-viniferin浓度由2 mg·L-1至32 mg·L-1增加过程中,通过JC-1染色荧光强度检测,随药物浓度增加红色荧光逐渐减弱,绿色荧光逐渐增强,细胞内绿色/红色荧光强度比升高,表明该部分线粒体膜电势降低,并呈现浓度依赖关系。
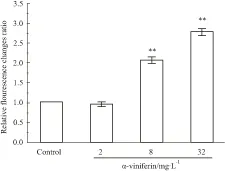
Fig 4 Cell mitochondrial membrane potential ±s, n=3)
**P<0.01vscontrol
2.4 α-viniferin对K562细胞caspase-3、caspase-9活性影响的量效关系如Fig 5所示,正常对照组caspase-3、caspase-9活性较低,随着药物浓度增加细胞内caspase-3、caspase-9活性不断增加。caspase-9活性在2~8 mg·L-1时略有升高,在32 mg·L-1时活性明显高于其它给药组。而caspase-3的活性随着药物浓度增加而明显升高。
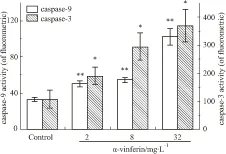
Fig 5 Analysis of cell caspase-3 and caspase-9 activity in
*P<0.05,**P<0.01vscontrol
2.5 α-viniferin对K562细胞凋亡相关基因mRNA表达影响量效关系如Fig 6所示,不同药物浓度处理K562细胞后,细胞内caspase-3的表达量较空白对照组明显增加,这与Fig 5中caspase-3活性随浓度升高而升高的现象相一致。Bcl-2家族中的促凋亡基因Bad、Bid、Bim、Bax表达量均相对于空白对照组有所增加,其中Bax在32 mg·L-1处理后表达量显著增加。抗凋亡基因Bcl-2、Bcl-xL的表达量相对于对照组明显下降。
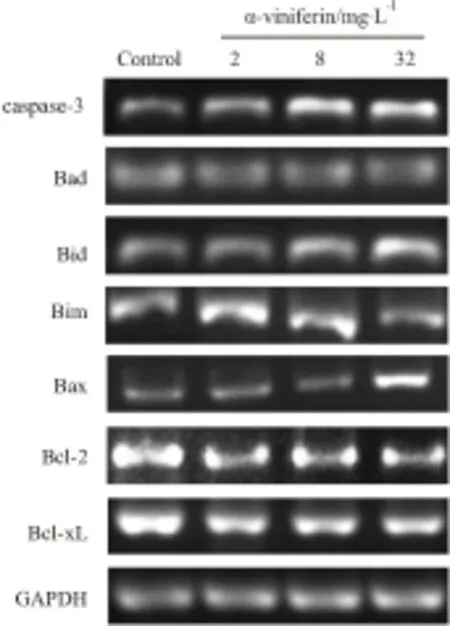
Fig 6 Expression of apoptosis-related mRNA in different groups detected by semi-quantitative RT-PCR
3 讨论
慢性粒细胞白血病K562细胞是一种危害性较大的恶性肿瘤细胞,其恶性表型为恶性克隆增殖性。化疗药物诱导K562细胞凋亡已经成为主要作用机制。
Sui等[10]研究报道,白藜芦醇对K562细胞的24 h半数抑制浓度为9 mg·L-1,而本实验研究发现α-viniferin作用K562细胞24 h后,IC50为13.61 mg·L-1。由此可见,在结构上α-viniferin虽为白藜芦醇的三聚体,但在药效学上,并不是白藜芦醇作用的简单叠加关系。由于结构不同α-viniferin很可能作用在细胞其他靶点而发挥其药效学作用。
体外实验研究证明,白藜芦醇可通过Fas/FasL途径[11]、Bcl-2家族蛋白[12]诱导caspase-3激活而引起K562细胞凋亡。在诱导凋亡过程中,白藜芦醇可下调Bcl-2,上调Bax,激活caspase-3。α-viniferin作为白藜芦醇的三聚体,国内外鲜有文献报道其对血系肿瘤细胞的影响,对于线粒体途径引起肿瘤细胞凋亡更是无文献报道。因此本文研究不同浓度的α-viniferin处理K562细胞24 h后,发现增殖抑制,形态学观察可见早期和晚期凋亡,但未发现细胞坏死现象。核固缩、染色质高度凝聚和碎裂,并伴有凋亡小体出现,为典型细胞凋亡现象。同时发现caspase-3 mRNA表达水平升高,凋亡相关基因Bax表达显著增强,Bcl-2表达下降。这些结果与白藜芦醇诱导肿瘤细胞凋亡现象相似。进一步证明α-viniferin可诱导K562细胞凋亡。Bax、Bcl-2是线粒体凋亡途径的重要调节分子。外界刺激因素引起细胞线粒体膜通透性改变,Bcl-2、Bcl-xL等下调,Bax、Bid、Bim、Bad等基因上调,进而使caspase家族出现凋亡级联反应,导致细胞发生凋亡反应[13]。本文发现,α-viniferin引起线粒体凋亡途径的关键蛋白酶caspase-9活性升高,线粒体膜通透性改变。上述研究结果表明,α-viniferin可通过线粒体凋亡途径诱导K562细胞凋亡。
综上所述,α-viniferin能抑制K562细胞增殖,并通过激活线粒体凋亡途径导致细胞凋亡。本研究指出了α-viniferin对K562细胞的致死类别与原因,对于这类化合物对白血病细胞的特殊敏感性,以及α-viniferin对白血病细胞的特异性方面仍需更多的证据。
[1] 孟旭辉,张评浒, 张朝凤. 芪类化合物及其合成酶的研究进展[J]. 中国野生植物资源,2010,29(3):15-20.
[1] Meng X H, Zhang P H, Zhang C F. Advance on the stilbenes and its synthase[J].ChinWildPlantRes, 2010, 29(3):15-20.
[2] 刘景磊,陈韩英,王晓琴,等. ε-葡萄素抑制bFGF诱导血管新生作用分析[J]. 中国实验方剂学杂志,2014,20(13):164-8.
[2] Liu J L, Chen H Y, Wang X Q, et al. Analysis of inhibition of ε-viniferin on bFGF-induced angiogenesis [J].ChinJExperTraditMedFormul, 2014, 20(13):164-8.
[3] NCI-60 DTP human tumor cell line screen. By National Cancer Institute. NO. NSC655524, 2012. http://dtp.nci.nih.gov/
[4] 易 岚,伍尤华,谭 晖,等. 二烯丙基二硫活化NADPH氧化酶诱导人白血病K562细胞凋亡[J]. 中国药理学通报,2014,30(8):1107-12.
[4] Yi L, Wu Y H, Tan H, et al. Diallyl disulfide induces apoptosis in human leukemia K562 cells through activation of NADPH oxidase[J].ChinPharmacolBull, 2014, 30(8): 1107-12.
[5] 缪 珊,张 海,石小鹏,等. 色胺酮对人白血病细胞株K562细胞增殖抑制、凋亡诱导的影响[J]. 中国药理学通报,2009,25(2):256-9.
[5] Miao S, Zhang H, Shi X P, et al. Induction of apoptosis by tryptanthrin on K562 cells[J].ChinPharmacolBull, 2009, 25(2): 256-9.
[6] 梁 蓉,王 哲,乔 岩,等. 氨基葡萄糖硫酸盐对白血病细胞K562增殖的影响[J]. 中国药理学通报,2003,19(11):1226-30.
[6] Liang R, Wang Z, Qiao Y, et al. Inhibition of glucosamine sulphate on the proliferation of leukemia cell line K562[J].ChinPharmacolBull, 2003, 19(11): 1226-30.
[7] 杨 帆,孙秋艳,刘亮亮,等. 维康醇诱导小鼠B16F0细胞凋亡的研究[J]. 中国药理学通报,2013,29(9):1269-74.
[7] Yang F, Sun Q Y, Liu L L, et al. Alteronol induced apoptosis of mouse melanoma B16-F0 cells[J].ChinPharmacolBull, 2013, 29(9): 1269-74.
[8] Tringali C, Lupo B, Cirillo F et al. Silencing of membrane-associated sialidase Neu3 diminishes apoptosis resistance and triggers megakaryocytic differentiation of chronic myeloid leukemic cells K562 through the increase of ganglioside GM3 [J].CellDeathDiffer, 2009, 16(1):164-74.
[9] Ai W,Zheng H,Yang X,et al.Tip60 functions as a potential corepressor of KLF4 in regulation of HDC promoter activity [J].NucleicAcidsRes, 2007, 35:6137-49.
[10]Sui T, Ma L, Bai X, et al. Resveratrol inhibits the phosphatidylinositide 3-kinase/protein kinase B/mammalian target of rapamycin signaling pathway in the human chronic myeloid leukemia K562 cell line [J].OncologyLetters, 2014(7): 2093-8.
[11]郝春燕,苏海翔,魏虎来,等. 白藜芦醇通过Fas依赖途径诱导K562细胞凋亡[J]. 实用癌症杂志,2004,19(6):561-3.
[11]Hao C Y, Su H X, Wei H L, et al. Resveratrol induces apoptosis in K562 cells through a Fas-dependent pathway[J].PractJCancer, 2004, 19(6): 561-3.
[12]温志震,于宝海,魏虎来,等. 白藜芦醇诱导K562细胞凋亡过程中Bcl-2蛋白水平的改变[J]. 中国临床药理学与治疗学,2006,11(4):421-3.
[12]Wen Z Z, Yu B H, Wei H L, et al. Changes of Bcl-2 expression in apoptosis induced by resveratrol in K562 cells[J].ChinJClinPharmacolTherapeut, 2006, 11(4): 421-3.
[13]Tsujimoto Y, Shimizu S. Bcl-2 family: life-or-death switch[J].FEBSLett,2000,466(1):6-10.
Abatract: Aim To investigate the effect and disclose its potential mechanisms of α-viniferin-induced proliferation and apoptosis in chronic myeloid leukemia K562 cells. Methods K562 cells were exposed to α-viniferin. The cytotoxicity was analyzed by MTT assay. The apoptosis in K562 cells was proved by both cellular morphological and biochemical methods. The chemical fuorescence assays were employed to evaluate the mitochondrial membrane potential, the relative changes of the caspase-9 and caspase-3 in the α-viniferin-treated K562 cells. The Bcl-2 family related gene expression was analyzed by semi-quantitative RT-PCR. Results After α-viniferin treatment, the proliferation of K562 cells was inhibited in a dose-dependent and time-dependent manner. The cells were treated with 32 mg·L-1α-viniferin and showed significant apoptotic morphological changes with chromatin aggregation, nuclear fragmentation and apoptotic bodies coming into being. The JC-1 fluorescence stain showed significant decreases in green/red ratio in α-viniferin treated groups. Further, caspase-9 and caspase-3 activities were increased. Bax and Bcl-xL relative mRNA level was down-regulated, and there was up-regulation of Bax and so on. Conclusion α-viniferin inhibits the proliferation and induces apoptosis in K562 cells via mitochondrial pathway.
α-viniferin induced apoptosis in K562 cells via mitochondrial pathway
GONG Fu-kai1,2, WANG Xiao-qin1, LI Zhao-Xue1, KONG Qing-jun3, ZHANG Bo1,2
(1.SchoolofPharmaceutics; 2.KeyLaboratoryofXinjiangEndemicPhytomedicineResources,MinistryofEducation; 3.SchoolofLifeScisences,ShiheziUniversity,ShiheziXinjiang832002,China)
α-viniferin; apoptosis; Bcl-2 genes; caspase activity; K562 cell; mitochondrial pathway
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.019.html
2014-11-14,
2014-12-22
国家自然科学基金资助项目(No 31160058,21362028);兵团重点领域科技攻关项目(No 2014BA029)
龚福恺 (1989-),男,硕士生,研究方向:肿瘤药理学方向,E-mail:gfkfk@163.com; 张 波 (1978-),男,教授,研究方向:肿瘤药理方向,通讯作者,Tel: 0993-2057670,E-mail: bozhang_lzu@126.com
10.3969/j.issn.1001-1978.2015.03.019
A
1001-1978(2015)03-0391-05
R329.25;R733.7;R916.4