漆黄素通过缝隙连接影响顺铂细胞毒性
2015-06-09杨克凡范丽霞彭悦霞
杨克凡,范丽霞,彭悦霞,王 琴,陶 亮
(中山大学中山医学院药理学教研室,广东 广州 510080)
◇论 著◇
漆黄素通过缝隙连接影响顺铂细胞毒性
杨克凡,范丽霞,彭悦霞,王 琴,陶 亮
(中山大学中山医学院药理学教研室,广东 广州 510080)
目的 体外观察漆黄素对顺铂细胞毒性作用影响及其机制。方法 CCK-8法观察不同浓度漆黄素对人胶质瘤U87细胞的毒性;用细胞接种荧光示踪法测定不同浓度漆黄素对U87细胞缝隙连接(GJ)功能的影响;标准细胞集落形成分析法观察顺铂的毒性及漆黄素对顺铂毒性的影响;用Western blot法研究漆黄素在影响GJIC(GJ intercellular communication)功能浓度范围内对Cx43表达的影响。结果 CCK-8法显示漆黄素在小于1 μmol·L-1的浓度范围内无细胞毒性;细胞接种荧光示踪法显示漆黄素浓度越高,U87细胞GJ通讯的荧光传递功能越强;标准细胞集落形成分析法显示,20 μmol·L-1顺铂能够抑制U87细胞的集落形成,而且在有GJ形成的细胞顺铂对细胞集落形成的抑制作用显著高于无GJ形成的细胞;Western blot结果显示漆黄素对Cx43蛋白表达量无明显影响。结论 漆黄素可以增强顺铂的细胞毒性,该作用可能与漆黄素增强U87细胞的GJ通讯功能有关,与Cx43蛋白表达水平变化无关。
漆黄素;黄酮类;顺铂;缝隙连接;缝隙连接通讯;缝隙连接蛋白Cx43;U87
细胞缝隙连接(gap junction, GJ)是细胞之间的一种蛋白质连接通道,由2个半通道,也叫连接子(connexons)组成,6个连接蛋白(connexin)可以组成1个连接子。GJ作为一种重要的连接通道,在相邻细胞的细胞质中分子量<1 ku的物质(如离子、细胞信号分子和代谢物质等)的交换中起到重要作用。根据分子量的不同可区分不同的连接蛋白,其中Cx43作为人体分布最广泛的一种连接蛋白,在人体的多种组织细胞中都有表达[1]。已有的研究证明,GJ能够增敏顺铂等化疗药物的抗肿瘤作用[2-3]。提示顺铂的细胞毒性可以由对GJ功能有增强作用的药物来提高。广泛分布于植物界的黄酮类化合物,具有消炎、抗肿瘤、抗菌等多种生物活性[4-5]。常见的黄酮类化合物有芫花中的芹菜素(apigenin)、金银花中的木犀草素(luteolin)、银杏中的山奈素(kaempferide)和槲皮素(quercetin)、桔子中的桔皮素(tangeritin)等。其中有研究表明,芹菜素和桔皮素具有消炎、抗肿瘤等多种作用[6]。漆黄素(fisetin)又称非瑟素、非瑟酮,属于天然的黄酮类化合物,天然存在于漆科植物木蜡树的木材。文献报道其具有抗菌、抗炎、抗肿瘤等多种药理作用[7]。但漆黄素对GJ功能及Cx蛋白表达的影响尚未见报道。因此可以研究这种药物对顺铂的细胞毒性及GJ功能的影响,并探讨其机理。
1 材料与方法
1.1 试剂漆黄素购于中国药品生物制品检验所;Tris、抗HA抗体购自Sigma-Aldrich公司;HRP标记的羊抗小鼠二抗、硝酸纤维素膜(NC膜)购自Amersham; ECL-plus化学发光剂购自GE公司、BSA蛋白定量试剂盒、丙烯酰胺、甲叉丙烯酰胺购自Bio-rad;DMEM干粉、胰酶(typsin)、青、链霉素(penicillin-steptomycin)购自Gibco;CCK-8试剂盒(WST-8)购自日本Dojindo公司;Calcein-AM购自Molecular Probes;顺铂(cisplatin)、二甲亚砜(DMSO)购于Sigma-Aldrich公司。
1.2 细胞培养人胶质瘤细胞U87[8]培养于高糖DMEM培养液(含10%胎牛血清,1%青霉素、链霉素)中,在37℃、5% CO2及饱和湿度的孵箱中培养。
1.3 CCK-8法测定药物的细胞毒性U87细胞计数后调整细胞密度为1×109cells·L-1,按每孔100 μL加入96孔板中培养,待细胞贴壁后加入不同浓度药物作用4 h后,每孔加入10 μL CCK-8[9]溶液,继续置于37℃、5% CO2及饱和湿度的孵箱中培养3 h后用酶标仪在450 nm处检测OD值。所有实验孔、空白孔、对照孔均设3个复孔,每个实验均重复3次。
细胞存活率/%=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%
1.4 细胞接种荧光示踪法检测缝隙连接功能将荧光指示剂Calcine-AM与表达Cx的U87细胞共同孵育,Calcine-AM可进入细胞,即供体细胞,将该细胞接种到不同浓度药物处理并已生长融合的细胞中,4 h后,待形成稳定GJ后用荧光显微镜观察。计数一个供体细胞周围含有Calcine绿色荧光的受体细胞作为GJ功能指标[10],统计实验组平均每个供体细胞周围发绿色荧光的受体细胞个数与对照组进行比较得出相对数。
1.5 标准细胞集落形成分析法测定U87细胞的细胞集落形成顺铂的毒性指标可以通过细胞集落形成率[2]的降低来测定。有GJ形成的细胞和无GJ形成的细胞可由不同密度接种细胞的方法获得,按每孔1×106cells加入6孔板中培养至生长融合,作为有GJ形成的实验组;而无GJ形成的细胞可由每孔1×103cells加入6孔板中培养形成,此时细胞未生长融合。以上细胞中加入药物预处理4 h,再联合20 μmol·L-1顺铂共同作用1 h后用PBS洗细胞,每组取1×103个细胞重新接种于6孔板7 d后测定细胞集落形成率。
存活比=处理组的细胞集落数/对照组的细胞集落数
1.6 Western blot检测Cx43蛋白表达用不同浓度药物作用于表达Cx43的U87细胞4 h后,用Western blot方法检测Cx43蛋白的表达。细胞融合至90%时弃掉培养液,经冷PBS洗3遍后加入适量细胞裂解液裂解细胞,用细胞刮匙将细胞刮下后超声破碎细胞,再于4℃、12 000 r·min-1离心30 min,取上清,采用Bio-rad DC assay法进行蛋白定量。取定量后的蛋白25 μg上样至10% SDS-PAGE凝胶中进行电泳分离,转膜至NC膜,5%脱脂奶粉/TBST封闭40 min,一抗为Cx43抗体(1 ∶3 000),二抗为羊抗鼠抗体(1 ∶6 000),使用凝胶成像系统照像记录,然后用ImageJ软件分析条带灰度[3]。
2 结果
2.1 药物的细胞毒性为了研究漆黄素自身的细胞毒性或细胞增殖作用对GJ功能影响,首先用CCK-8法检测不同浓度药物对U87细胞生长的影响,然后选择对该细胞生长无影响的药物浓度做进一步研究。Fig 1中结果显示,漆黄素在0~1 μmol·L-1时对U87细胞生长均无抑制作用(P>0.05);10、100 μmol·L-1时对细胞生长有明显抑制作用(P<0.05)。
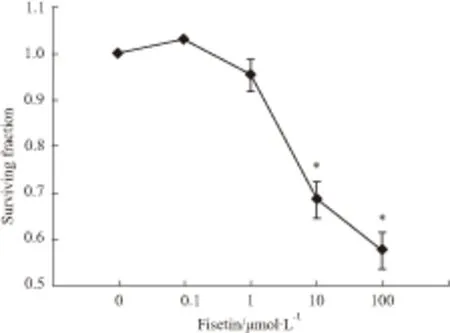
Fig 1 Cytotoxic effect of fisetin on U87 cells expressing ±s)
Surviving fraction of U87 cells after treatment with 0.1,1,10 and 100 μmol·L-1fisetin for 4 hours.*P<0.05vscontrol group.
2.2 漆黄素增强细胞缝隙连接功能结果显示随着漆黄素(0.001~1 μmol·L-1)浓度的增加,细胞间荧光传递作用增强。结果表明漆黄素可以增强U87细胞的GJ功能(Fig 2)。
2.3 漆黄素对顺铂细胞毒性的影响Fig 3中结果显示高密度(生长融合、形成GJ)细胞和低密度(生长未融合、无GJ形成)细胞与20 μmol·L-1顺铂作用1 h,均能够明显降低U87细胞的集落生成率。与单用顺铂组相比,在高密度接种细胞,漆黄素能明显降低顺铂处理后细胞集落形成率(P<0.05),而在低密度接种细胞中,漆黄素不影响顺铂处理后的细胞集落形成率(P>0.05)。结果表明,在无GJ形成的细胞,漆黄素不影响顺铂的细胞毒性;在有GJ形成的细胞,漆黄素能明显增强顺铂的细胞毒性。
2.4 漆黄素对Cx43蛋白表达的影响通过Western blot研究漆黄素是否影响Cx43蛋白的表达。Fig 4表明不同浓度的漆黄素(0.001~1 μmol·L-1)作用4 h不影响Cx43表达。
3 讨论
Cx43是在人体中分布最广泛的一种缝隙连接蛋白,人体的多种组织细胞中都有Cx43的表达。Sato等[11]发现在间皮瘤细胞中Cx43所组成的GJ能够显著增强顺铂的细胞毒性,另有Peterson-Roth等[12]发现Src可通过Cx43来改变顺铂的细胞毒性,本次研究中细胞集落形成分析法的结果也显示顺铂的细胞毒性在有GJ形成时明显增强。因此,当肿瘤细胞间的GJ功能增强时,可以增敏化疗药物的细胞毒性;反之,降低GJ功能则会抑制化疗药物的细胞毒性。
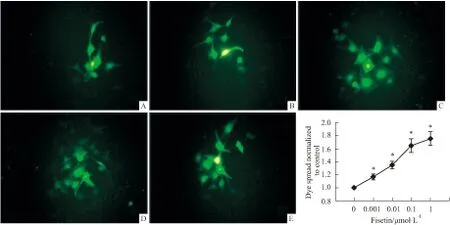
A. The dye spread of U87 cells in control group (200×). B, C, D, E: The dye spread of U87 cells in fisetin group (200×),(B, fisetin 0.001μmol·L-1; C, fisetin 0.01μmol·L-1; D, fisetin 0.1μmol·L-1; E, fisetin 1μmol·L-1). F: The normalized enhancement of dye coupling through gap junctions treated with 0.001, 0.01, 0.1, 1μmol·L-1fisetin.*P<0.05vscontrol group.
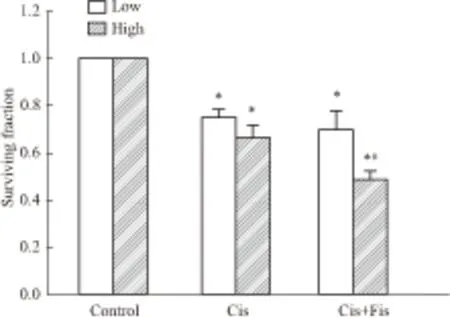
Fig 3 Effect of fisetin on the cytotoxicity of ciplatin in U87 cells expressing ±s)
Clonogenic survival of Cx43-expressing cells treated with 20 μmol·L-1cisplatin at high and low cell density with fisetin.*P<0.05vscontrol group,#P<0.05vscisplatin group.
GJ功能受到多种水平的调节,快速调节包括改变单侧通道的电导率或通道开放的概率,慢速调节则通过改变通道的数量来实现[13]。而对连接蛋白转录后调控则对GJ功能的调节起到重要作用[14]。漆黄素已有文献报道其抗肿瘤作用[7-15],但并未研究这两种药物对于GJ功能的作用。本研究实验结果显示漆黄素(0.001~1 μmol·L-1)可以随着浓度增加,GJ功能增强。根据Western blot实验可知,漆黄素可能不是通过调节Cx43的表达水平来增强GJ功能。另外,实验中1、4、24、48 h的Western blot结果显示Cx蛋白表达量也无变化。相关文献报道,漆黄素可通过p38、p53等细胞死亡信号通路来增强顺铂的细胞毒性[16],而尚无文献报道p38、p53等信号通路对Cx43表达有影响。我们将在今后的研究中探讨漆黄素增强GJ功能的机制。
本研究首次证明了漆黄素能够增强GJ功能及增敏顺铂细胞毒性:提示我们漆黄素的化疗增敏作用可能是通过增强GJ功能而实现的,本研究为寻找以GJ为靶点的新型抗肿瘤药物和化疗增敏药提供了理论基础。
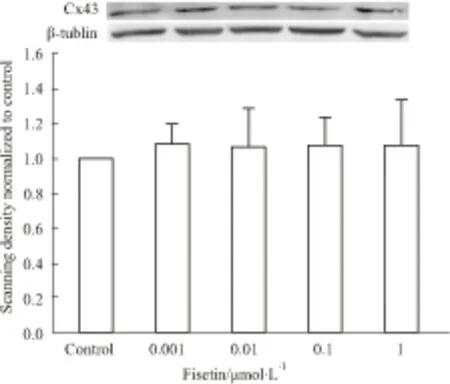
Fig 4 Effect of fisetin on the expression of Cx43 determined by Western ±s)
The figure shows that treating with fisetin(0.001~1μ mol·L-1) did not change Cx43 expression.
[1] Laird D W. The gap junction proteome and its relationship to disease[J].TrendsinCellBiology, 2010, 20(2): 92-101.
[2] Wang Y, Wang Q, Zhang S, et al. Baicalein increases the cytotoxicity of cisplatin by enhancing gap junction intercellular communication[J].MolMedRep, 2014, 10(1): 515-21.
[3] He B, Tong X, Wang L, et al. Tramadol and flurbiprofen depress the cytotoxicity of cisplatin via their effects on gap junctions[J].ClinCancerRes, 2009, 15(18): 5803-10.
[4] Conklin C M, Bechberger J F, Macfabe D, et al. Genistein and quercetin increase connexin43 and suppress growth of breast cancer cells[J].Carcinogenesis, 2007, 28(1): 93-100.
[5] Funakoshi-Tago M, Nakamura K, Tago K, et al. Anti-inflammatory activity of structurally related flavonoids, Apigenin, Luteolin and Fisetin[J].IntImmunopharmacol, 2011, 11(9): 1150-9.
[6] 李明勇 黄培春. 芹菜素对人鼻咽癌CNE-2Z细胞化疗敏感性的增强作用[J]. 中国药理学通报, 2012, 28(1): 88-92.
[6] Li M Y, Huang P C. Chemosensitization effects of apigenin on cisplatin in human nasopharyngeal carcinoma CNE-2Z cells[J].ChinPharmacolBull, 2012, 28(1):88-92.
[7] Chou R H, Hsieh S C, Yu Y L, et al. Fisetin inhibits migration and invasion of human cervical cancer cells by down-regulating urokinase plasminogen activator expression through suppressing the p38 MAPK-dependent NF-kappaB signaling pathway[J].PLoSOne, 2013, 8(8): e71983.
[8] Katakowski M, Buller B, Wang X, et al. Functional microRNA is transferred between glioma cells[J].CancerRes, 2010, 70(21): 8259-63.
[9] Tanaka H, Kono E, Tran C P, et al. Monoclonal antibody targeting of N-cadherin inhibits prostate cancer growth, metastasis and castration resistance[J].NatMed, 2010, 16(12): 1414-20.
[10] Patel S J, Milwid J M, King K R, et al. Gap junction inhibition prevents drug-induced liver toxicity and fulminant hepatic failure[J].NatBiotechnol, 2012, 30(2): 179-83.
[11] Sato H, Iwata H, Takano Y, et al. Enhanced effect of connexin 43 on cisplatin-induced cytotoxicity in mesothelioma cells[J].JPharmacolSci, 2009, 110(4): 466-75.
[12] Peterson-Roth E, Brdlik C M, Glazer P M. Src-induced cisplatin resistance mediated by cell-to-cell communication[J].CancerRes, 2009, 69(8): 3619-24.
[13] Kjenseth A, Fykerud T A, Sirnes S, et al. The gap junction channel protein connexin 43 is covalently modified and regulated by SUMOylation[J].JBiolChem, 2012, 287(19): 15851-61.
[14] Laird D W. Life cycle of connexins in health and disease[J].BiochemJ, 2006, 394(Pt 3): 527-43.
[15] Zhang W, Tang B, Huang Q, et al. Galangin inhibits tumor growth and metastasis of B16F10 melanoma[J].JCellBiochem, 2013, 114(1): 152-61.
[16] Tripathi R,Samadder T,Gupta S,et al.Anticancer activity of a combination of cisplatin and fisetin in embryonal carcinoma cells and xenograft tumors[J].MolCancerTher,2011,10(2):255-68.
Fisetin increases the cytotoxicity of cisplatin by enhancing gap junctional intercellular communication
YANG Ke-fan, FAN Li-xia, PENG Yue-xia, WANG Qin, TAO Liang
(DeptofPharmacology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China)
Aim To investigate the effect of fisetin on the cytotoxicity of cisplatin and its mechanisms. Methods CCK-8 was used to assay the toxicity of fisetin. “Parachute” dye-coupling assay was used to examine dye spread through gap junctions in U87 cells. “Standard colony-forming assay” was used to examine cell survivals of U87 treated with cisplatin with fisetin. Western blot was performed to detect the expression level of Cx43. Results Fisetin had no cytotoxic effect on U87 cells at the concentration of 0~1μmol·L-1. Parachute assay demonstrated that fisetin enhanced dye-coupling through gap juntions in U87 cells. Standard Colony forming assay showed that cisplatin inhibited the clonogenic survivals of U87 cells and fisetin could enhance cisplatin-induced inhibitory effect of clonogenic survivals on cells with gap junctional formation more than on cells without gap junctional formation. Conclusion These rusults demonstrate that fisetin could increase the sensitivity of glioma cells to cisplatin through the enhancement of gap junctional intercellular communication but this may not be related to the expression of Cx43.
fisetin; flavonoids; cisplatin; gap junction; gap junctional intercellular communication; connexin 43;U87 glioma cells
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.007.html
2014-11-22,
2014-12-29
新疆维吾尔自治区科技厅科技支疆项目(No 201233150);国家自然科学基金-新疆联合基金重点支持项目(No U1303221);国家自然科学基金面上项目(No 81373439)
杨克凡(1990-),男,硕士生,研究方向:细胞缝隙连接与疾病,E-mail:yangkf@mail.sysu.edu.cn; 陶 亮(1959-),男,博士,教授,博士生导师,研究方向:细胞缝隙连接与疾病,通讯作者,Tel:020-87332318,E-mail:taol@mail.sysu.edu.cn
10.3969/j.issn.1001-1978.2015.03.007
A
1001-1978(2015)03-0323-04
R284.1;R329.24;R341;R979.19