不同促排卵方案用于PCOS患者宫腔内人工授精的临床效果分析
2015-06-08罗小欢曾艳华
罗小欢 夏 薇 苏 宁 王 维 曾艳华
广东省广州市第一人民医院生殖健康与不孕症专科(510180)
多囊卵巢综合征(PCOS)是导致育龄妇女不孕的常见病因之一,文献报道其发生率为5%~10%[1],PCOS以持续性无排卵、闭经、高雄激素血症和多囊卵巢为主要特征,占排卵性不孕的50%~70%。促排卵方案联合宫腔内人工授精(IUI)有助于PCOS性不孕患者获得妊娠。随着不同促排卵药物的出现,各种促排卵药物及其配伍方案均被应用于治疗PCOS性不孕。本文对不同促排卵方案用于PCOS患者IUI的效果进行分析,旨在筛选出最优促排卵方案。
1 资料与方法
1.1 研究对象
回顾性分析本科2010年1月~2013年12月339例PCOS不孕症患者634个IUI周期的临床资料。患者年龄27.91±2.99(22~34)岁,不孕年限2.68±1.89(1~8)年,其中原发不孕225例,继发不孕114例。纳入标准:①符合2003年鹿特丹PCOS的诊断标准[2];②IUI治疗前均予以达英-35或加用二甲双胍、地塞米松等预治疗3~6个月,高泌乳素血症者予以溴隐亭调节,月经周期第1~3天查性激素结果基本正常。③行子宫输卵管造影或腹腔镜证实至少一侧输卵管通畅;④男方精液常规符合IUI标准,手术日前向运动精子总数≥10×106/ml。排除合并子宫、宫颈、输卵管及免疫因素导致的不孕,因个人原因中途放弃治疗的周期数不纳入统计数据。所有患者术前均签署知情同意书。
1.2 分组
根据采用的促排卵药物及其配伍进行分组,分别是氯米芬(CC)组(84周期)、来曲唑(LE)组(76周期)、尿促性素(HMG)组(153周期)、卵泡刺激素(FSH)组(45周期)、CC+HMG组(96周期)、CC+FSH组(75周期)、LE+HMG组(49周期)和LE+FSH组(56周期),将8组方案归类为单纯口服药物组(CC组和LE组)、促性腺激素(Gn)组(HMG组和FSH组)、CC联合药物组(CC+HMG组和CC+FSH组)和LE联合药物组(LE+HMG组和LE+FSH组)。
1.3 方法
1.3.1 促排卵治疗 CC组(CC,50mg/片,塞浦路斯高特制药有限公司):月经周期第5天或者撤药性出血第5天开始口服CC 50~150mg/d,连用5d;LE组(LE,2.5mg/片,江西恒瑞医药股份有限公司):月经周期第5天或者撤药性出血第5天开始口服LE 5mg/d,连用5d;HMG及FSH 组:月经第5天开始肌内注射HMG(乐宝得,75U/支,珠海丽珠集团丽珠制药厂)或者FSH(丽申宝,75U/支,珠海丽珠集团丽珠制药厂)37.5~150U/d,连用5d。上述用药5d后均行阴道B超监测,根据卵泡发育情况调整用药方案或剂量,直至人绒毛膜促性腺激素(hCG)日;联合药物组(CC+HMG、CC+FSH、LE+HMG、LE+FSH):当连续口服CC或者LE 5d后行阴道B超仍未见优势卵泡时,添加HMG或者FSH 37.5~75U/d进一步促进卵泡发育[3],并根据卵泡发育情况调整用药剂量,直至hCG日。
1.3.2 卵泡监测及手术时间 各组均以阴道B超监测卵泡生长发育,结合黄体生成激素(LH)试纸、宫颈黏液Insler评分[4]决定IUI手术时间。B超监测优势卵泡直径≥16mm时,开始每天验尿LH,当优势卵泡平均直径达18~20mm时,宫颈黏液评分≥8分,验尿LH(+)时,于当天注射hCG(5000U/支,珠海丽珠集团丽珠制药厂)或注射促性腺激素释放激素激动剂(GnRH-a,达必佳,0.1mg/支,瑞士辉凌制药有限公司)诱发排卵(卵泡数≤2个,肌内注射hCG 5000~10 000U;卵泡数≥3个,皮下注射达必佳0.2mg),24h后行IUI;验尿 LH(-)时,当天晚上22:00点注射hCG或达必佳,36h后行IUI。排卵后予以黄体支持:肌注黄体酮(20mg/支,浙江仙琚制药有限公司)20mg/d,共14d或者hCG 2000U,1次/3d,共3次;口服地屈孕酮(达芙通,10mg/片,荷兰 Abbott Biologicals B.V.)20mg/d或者黄体酮胶囊(益玛欣,100mg/粒,浙江仙琚制药有限公司)200mg/d,共14d;若予达必佳诱发排卵则加用口服戊酸雌二醇(补佳乐,1mg/片,拜耳医药保健有限公司广州分公司 )2mg/d,共14d。本科黄体支持方法采用口服黄体酮类药物(黄体酮胶囊或者地屈孕酮)联合肌注hCG或者肌注黄体酮进行。
1.3.3 精液处理 根据精液情况采用上游法或者密度梯度法收集精子。处理后前向运动精子总数均≥10×106/ml。
1.3.4 观察项目 比较各组患者年龄、不孕年限、体重指数(BMI)、基础内分泌指标、基础窦卵泡数(AFC)、优势卵泡数、排卵数、单卵泡发育成熟率、最大卵泡直径、到达hCG日天数、初始及手术日子宫内膜厚度、Gn使用天数及使用总量、黄素化未破裂卵泡综合征(LUFS)和卵巢过度刺激综合征(OHSS)发生率、临床妊娠率、流产率、多胎妊娠和异位妊娠发生率等。
1.3.5 妊娠诊断标准 所有患者IUI后14d返院行尿hCG或者血β-hCG检测,hCG(+)者IUI后5周行阴道B超,如见宫内孕囊或原始心管搏动确定为临床妊娠。
1.4 统计学处理
采用SPSS16.0软件进行数据分析,不同组间的均数比较采用F检验,两两均数比较采用SNK-q检验,率的比较采用χ2检验或者校正χ2检验、Fish检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本特征
各组患者年龄、不孕年限、BMI、AFC、基础FSH、LH/FSH、睾酮(T)比较,差异均无统计学意义(P>0.05)。见表1。
表1 不同促排卵方案组患者基本特征比较(±s)
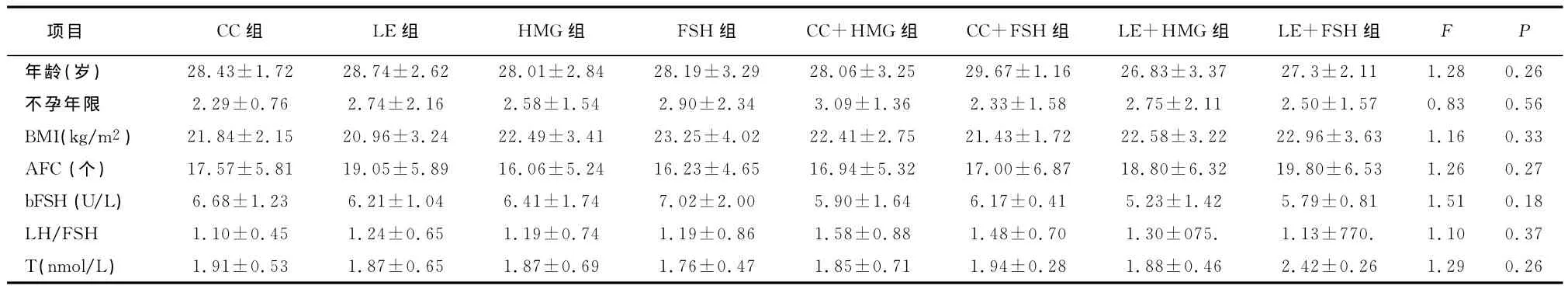
表1 不同促排卵方案组患者基本特征比较(±s)
年龄(岁) 28.43±1.72 28.74±2.62 28.01±2.84 28.19±3.29 28.06±3.25 29.67±1.16 26.83±3.37 27.3±2.11 1.28 0.26不孕年限 2.29±0.76 2.74±2.16 2.58±1.54 2.90±2.34 3.09±1.36 2.33±1.58 2.75±2.11 2.50±1.57 0.83 0.56 BMI(kg/m2) 21.84±2.15 20.96±3.24 22.49±3.41 23.25±4.02 22.41±2.75 21.43±1.72 22.58±3.22 22.96±3.63 1.16 0.33 AFC (个) 17.57±5.81 19.05±5.89 16.06±5.24 16.23±4.65 16.94±5.32 17.00±6.87 18.80±6.32 19.80±6.53 1.26 0.27 bFSH (U/L) 6.68±1.23 6.21±1.04 6.41±1.74 7.02±2.00 5.90±1.64 6.17±0.41 5.23±1.42 5.79±0.81 1.51 0.18 LH/FSH 1.10±0.45 1.24±0.65 1.19±0.74 1.19±0.86 1.58±0.88 1.48±0.70 1.30±075. 1.13±770. 1.10 0.37 T(nmol/L) 1.91±0.53 1.87±0.65 1.87±0.69 1.76±0.47 1.85±0.71 1.94±0.28 1.88±0.46 2.42±0.26 1.29 0.26
2.2 不同促排卵方案卵泡发育情况比较
比较各组hCG日优势卵泡(直径>14mm)数和排卵数,Gn组(FSH组、HMG组)及CC联合药物组(CC+HMG组、CC+FSH组)的优势卵泡数和排卵数均多于单纯口服药物组(CC组、LE组)及LE联合药物组(LE+HMG组、LE+FSH组),差异有统计学意义(P<0.05);而Gn组与CC联合药物组比较,单纯口服药物组与LE联合药物组比较,差异均无统计学意义(P>0.05)。比较各组单卵泡发育成熟率以LE组最高,与其余7个组比较差异有统计学意义(P<0.01);而CC组和LE联合药物组(LE+HMG组、LE+FSH组)的单卵泡发育成熟率亦高于Gn组(FSH组、HMG组)和CC联合药物组(CC+HMG组、CC+FSH组),差异有统计学意义(P<0.05);CC组与LE联合药物组比较、Gn组与CC联合药物组比较差异均无统计学意义(P>0.05)。比较各组到达hCG日所需天数,HMG组、CC+HMG组、LE+HMG组均多于单纯口服药物组(CC组、LE组),差异有统计学意义(P<0.05),HMG组、CC+HMG组和LE+HMG组到达hCG日所需天数与FSH组、CC+FSH组和LE+FSH组比较,差异均无统计学意义(P>0.05)。单纯口服药物组(CC组、LE组)与FSH组、CC+FSH组、LE+FSH组比较,差异无统计学意义(P>0.05)。各组最大卵泡直径、LUFS发生率比较差异均无统计学意义(P>0.05)。见表2。

表2 不同促排卵方案组的卵泡发育及子宫内膜情况
2.3 不同促排卵方案子宫内膜厚度比较
各组初始子宫内膜厚度比较差异无统计学意义(P>0.05)。手术日子宫内膜厚度CC组最薄,与其余各组比较差异均有统计学意义(P<0.05),剩余7个组比较差异均无统计学意义(P>0.05)。对于促排过程中子宫内膜较薄的部分周期,使用了补佳乐等增加子宫内膜厚度的药物,但CC组手术日子宫内膜厚度<8mm仍有9个周期,占10.71%(9/84),与其余各组比较差异均有统计学意义(P<0.05)。见表2。
2.4 Gn使用天数和使用总量比较
联合药物组(CC+HMG组、LE+HMG组、CC+FSH组、LE+FSH组)使用Gn的天数及使用支数均少于Gn组(FSH组、HMG组),差异有统计学意义(P<0.05),而FSH组与 HMG组比较及CC+HMG组、LE+HMG组、CC+FSH 组、LE+FSH组4个组比较,差异均无统计学意义(P>0.05)。见表3。
表3 不同促排卵方案组Gn使用情况(±s)

表3 不同促排卵方案组Gn使用情况(±s)
*与联合药物组比较P<0.05
F P Gn使用天数(d) 6.88±2.35* 6.88±2.35* 7.34±2.99 6.33±2.07 8.95±5.39 6.70±2.26 2.5项 目 HMG组 FSH组 CC+HMG组 CC+FSH组 LE+HMG组 LE+FSH组5 0.04 4 0.02 Gn使用总量(支) 17.86±10.28* 12.96±7.04* 7.84±3.80 6.31±4.43 8.92±3.82 6.88±2.35 2.3
2.5 妊娠结局及并发症的发生率
339对患者夫妇共行634个IUI周期,109个周期获得临床妊娠,周期临床妊娠率为17.19%(109/634),累计妊娠率为32.15%(109/339);另有13个IUI周期早期自然流产或者胚胎停止发育,流产率为11.93%(13/109);4个周期为异位妊娠,异位妊娠率为3.67%(4/109);78例单胎妊娠,11例双胎妊娠,3例三胎妊娠(均减胎为单胎或者双胎),多胎妊娠率12.84%(14/109);发生轻度 OHSS 4例,发生率0.63%(4/634),无中、重度 OHSS发生。CC组的临床妊娠率除与LE组比较差异无统计学意义外(P>0.05),明显低于其余6个组(P<0.05)。LE组的临床妊娠率高于CC组低于其余6组,但差异无统计学意义(P>0.05)。各组间流产率比较差异均无统计学意义(P>0.05)。HMG组及FSH组分别出现了3例及1例轻度OHSS,其余各组均未发生。多胎妊娠HMG组7例,FSH组4例,CC+HMG组、CC+FSH组和LE+HMG组各有1例。CC组、HMG组、FSH组和LE+HMG组各出现1例异位妊娠。见表4。

表4 不同促排卵方案组IUI临床结局比较
3 讨论
PCOS是妇产科的常见病及多发病,对育龄期妇女最大的困扰是由于排卵障碍而导致不孕,故需要对PCOS不孕症患者采用个体化促排卵治疗。PCOS不孕症患者对促排卵药物的敏感性反应不一,本文通过研究不同促排卵药物及其配伍在PCOS不孕症患者IUI中的应用,希望找到一种具有较高临床妊娠率,又能减少OHSS及多胎妊娠发生的优选方案。Willis等[5]研究认为Gn类药物促排卵比单独口服药物有较高的妊娠率,但有较高的OHSS发生率、多胎妊娠率及成本,联合促排方案可减低其风险而不影响妊娠率,且弥补了口服药物的缺点。
本研究比较8种促排卵方案的优势卵泡数和排卵数发现,Gn组和CC联合药物组的优势卵泡数和排卵数均多于单纯口服药物组和LE联合药物组,4例轻度OHSS均出现在Gn组,14例多胎妊娠出现在Gn组和联合药物组(Gn组11例,联合药物组3例),其余各组均未发生。当应用CC促排卵未能成功诱导优势卵泡时,添加Gn可有效改善卵泡发育,明显提高卵泡的数量和生长速度。对于PCOS等合并排卵障碍的患者来说,应用Gn可促使多个卵泡发育并排出,但易导致OHSS及增加多胎妊娠率。由于使用hCG诱发排卵以及黄体支持容易导致OHSS的发生,以及妊娠后可能进一步加重OHSS,因此在促排卵周期中当成熟卵泡数≥3个,使用GnRH-a代替hCG诱发排卵以及使用肌注黄体酮代替hCG进行黄体支持以减少发生OHSS的风险。目前国内外多数报道显示GnRH-a代替hCG诱发排卵,其排卵率、妊娠率以及卵子质量相仿,但OHSS的发生率及程度较低[6-7]。
8种促排卵方案中,以LE的单卵泡发育成熟率最高(63/76,82.89%),与其余7组比较有差异。这与有关研究报道使用LE促排卵单卵泡率81.6%[8-9]相 似。这 可 能 与 LE 半 衰 期 较 短 (约48h),使用LE出现优势卵泡后体内雌激素增多,通过负反馈抑制FSH的释放,从而减少卵泡的发育有关。LE联合药物组的单卵泡发育成熟率亦高于Gn组及CC联合药物组,可见即使添加Gn,LE联合药物组仍有较高的单卵泡周期数。
传统上认为CC是PCOS不孕症患者的一线促排卵药物,由于其安全、方便、经济等优点广泛应用于临床[10],但存在对子宫内膜影响大,排卵率高、妊娠率低等缺点[11]。本研究亦发现,在初始子宫内膜厚度无差异的基础上,术日子宫内膜的厚度以CC组最薄;即使使用了补佳乐和阿司匹林等增加子宫内膜厚度的药物,CC组术日仍有9个促排周期的子宫内膜<8mm,与其余各组比较有差异。但CC联合药物组的子宫内膜厚度明显大于CC组,可见CC联合用药方案可明显改善子宫内膜的厚度,弥补了单纯口服CC的不足。
临床工作中常根据PCOS患者的特点采用HMG低剂量(37.5~75U)递增方案促进卵泡发育。Balassch等[12]研究显示PCOS患者采用37.5 U低剂量的Gn方案足以促进卵泡发育,但低剂量递增的方案也增加了部分周期的治疗时间和Gn使用数量。本研究发现到达hCG日平均天数,HMG组、CC+HMG组、LE+HMG组分别多于CC组及LE组,除口服CC或者LE 5d后阴道B超未见优势卵泡时再添加HMG从而增加了治疗天数外,也与使用HMG时许多周期采用低剂量(37.5U)递增的促排卵方案有关,从而使部分周期的治疗时间与Gn的总使用剂量增加。另外,Badawy等[13]的研究结果发现联合用药方案可以明显减少Gn的使用时间及使用剂量,与本研究结果相符。连续5d的口服药物可促使一批小卵泡的发育,但下丘脑的负反馈效应使Gn分泌仍未达到卵泡优势化的阈值,在此基础上再添加外源性Gn,可明显增加卵泡的生长速度,也可减少Gn的使用时间和使用剂量。
CC组的临床妊娠率除与LE组比较无差异,明显低于其余6组,与Papageorgiou等[14]的荟萃分析相似,可能与其抗雌激素作用导致子宫内膜发育不良,子宫容受性下降有关。Gn组和联合药物组的临床妊娠率相当,联合药物获得满意的妊娠率可能与添加Gn后弥补改善了单纯口服药物的不足有关。
综上所述,PCOS患者各种促排卵治疗方案各有优缺点,均切实可行,但CC的妊娠率较低,可能与其抗雌激素作用有关;LE有较高的单卵泡发育成熟率,单独使用或与Gn联合应用均可获得满意的妊娠率;Gn组和联合药物组的临床妊娠率相当,但单独使用Gn伴随较高的OHSS发生率和多胎妊娠率,而联合促排方案则可明显减少Gn的使用天数及总使用量,减少OHSS的发生率和多胎妊娠率。综上所述,联合促排方案更加合理、经济、有效,值得推广。
[1]Teede H,Deeks A,Moran L,et al.Polycystic ovary syndrome:a complex condition with psychological,reproductive and metabolic manifestations that impacts on health across the lifespan[J].BMC Medicine,2010,8(1):41.
[2]Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group.Revised 2003consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome(PCOS)[J].Hum Reprod,2004,19(1):41-44.
[3]黄荷凤,卢光琇,陈子江,等.临床诊疗指南.辅助生殖技术与精子库分册[M].北京:人民卫生出版社,2009:62-63.
[4]罗丽兰.不孕与不育[M].北京:人民卫生出版社,1998:213-217.
[5]Willis M.Y,Browne AS,Session DR,et al.Controlled ovarian hyperstimulation:a review for the non~ART patient[J].Minerva Ginecol,2011,63(2):119-135.
[6]徐明彩,张亦文.GnRH-a替代hCG诱发排卵的研究现状[J].中国优生与遗传杂志,2009,17(7):132-134.
[7]Acevedo B,Gomez-Palomare JL,Ricciarelli ER,et al.Triggering ovulation with gonadotropin~releasing hormone agonists does not compromise embryo implantation rates[J].Fertil Steril,2006,86(6):1682-1687.
[8]Azantee YW,Murad ZA,Roszaman R,et al.Associated factors affecting the successful pregnancy rate of intrauterine insemination at International Islamic University Malaysia(IUM)Fertility Centre[J].Med J Malaysia.2011,66(3):195-198.
[9]耿蔷,全松,郭遂群,等.来曲唑等4种促排卵药物用于宫腔内人工授精的疗效比较[J].实用妇产科杂志,2011,27(3):187-190.
[10]Vargyas JM,Morente C,Shangold G,et al.The effect of different methods of ovarian stimulation for human in vitro fertilization and embryo replacement[J].Fertil Steril,1984,42(5):745-749.
[11]陈丹青,周馥贞.克罗米酚对分泌期子宫内膜组织形态影响的研究[J].中国实用妇科与产科杂志,1998,14(2):97-98.
[12]Balasch J,Fabregues F,Creus M,et al.Recombinant human follicle-stimulating hormone for ovulation induction in polycystic ovary syndrome:aprospective,randomized trial of two starting doses in a chronic low-dose step-up protocol[J].J Assist Reprod Genet,2000,17(10):561-565.
[13]BadawyA,ElnasharA,Totongy M,et al.Clomiphene citrate or aromatase inhibitors combined with gonadotropins for superovulation in women undergoing intrauterine insemination:A prospective randomised trial[J].Department of Obstetrics and Gynecol,2010,30(6):617-621.
[14]Papageorgiou TC,Guibert J,Savale M,et al.Low dose recombinant FSH treatment may reduce multiple gestations caused by controlled ovarian hyperstimulation and intrauterine insemination[J].BJOG,2004,1(11):1277-1282.
