副溶血弧菌TDH蛋白高效表达、免疫原性分析及初步应用
2015-06-08李欣彤陈永军刘迎春白雪瑞王少辉韩先干刘永杰
李欣彤,陈永军,刘迎春,白雪瑞,王少辉,韩先干,刘永杰,王 权,蒋 蔚
(1. 中国农业科学院上海兽医研究所,上海200241;2. 南京农业大学动物医学院 农业部动物疫病诊断与免疫重点开放实验室,南京210095)
副溶血弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐菌,普遍存在于河口、海洋和沿海环境,夏季和春季是该菌引起食物中毒的高发季节,可引起人严重的急性胃肠炎、败血症和伤口感染[1-3]。近几年由副溶血弧菌在全球范围内引起的食物中毒事件频发,已成为较严重的公共卫生问题[3,4]。此外,该菌可引起多种水产动物(鱼、虾、贝、蟹等)感染发病,尤其是对凡纳滨对虾危害严重[4,5],给水产养殖业造成了巨大的经济损失,成为困扰和阻碍我国沿海海水网箱养殖行业发展的因素之一。
现普遍认为副溶血弧菌菌株间存在致病与非致病的差异,其致病性与产生的毒力因子密切相关,并且在不同菌株间存在差异[6]。很多毒力因子参与副溶血弧菌的致病过程,包括溶血素、黏附因子、各种酶以及细菌分泌系统等。其中耐热直接溶血毒素(thermostable direct hemolysin,TDH)与副溶血弧菌致病性密切相关,是公认的主要毒力因子, 具有溶血性、细胞毒性和肠毒性[7]。TDH具有热稳定性,在100℃加热10 min的情况下仍不失活[6,7]。具有TDH的分离株在高盐的Wagatsuma 平板上能够溶解人红细胞,这种现象被称为神奈川现象(Kanagawa phonomenon,KP)[8]。国内外研究工作者对副溶血弧菌的TDH及其致病机理进行了广泛深入的研究。TDH在溶液中可以形成一个直径为23 Å,高度为50 Å的四聚体[9]。电子显微镜下可以观察到,TDH四聚体附着于脂质体,提示该分泌蛋白是一种孔隙形成毒素,通过破环细胞的脂质微区,在细胞表面形成大孔道, 使水和离子穿过细胞膜,从而产生细胞毒性[10]。研究表明副溶血弧菌感染导致腹泻的机制与TDH改变了肠道细胞的离子通道密切相关[11]。
目前对副溶血弧菌TDH的表达纯化、抗体制备及免疫学检测方法的研究还比较少见。本研究对副溶血弧菌tdh基因进行原核表达,对表达的包涵体进行复性和纯化,进一步制备纯化蛋白的兔抗血清,并初步应用于副溶血弧菌TDH的Dot-ELISA检测,为副溶血弧菌快速诊断试剂以及基因工程疫苗的研制提供技术储备。
1 材料与方法
1.1 菌株、质粒和感受态细胞 副溶血弧菌SHJLA(TDH+)由本实验室分离保存[2];副溶血弧菌ATCC33847(TDH+)购自中国微生物菌种保藏管理委员会普通微生物中心;副溶血弧菌ATCC17802(TDH-)购自美国模式培养物集存库;VPh510(TDH+)和VPh299(TDH+)由本实验室保存;其他供试菌嗜水气单胞菌、大肠杆菌、沙门氏菌和金黄色葡萄球菌为本实验室保存;载体pET28a(+)由中国农业科学院上海兽医研究所兽医公共卫生实验室保存;E.coli TOP10,E.coli BL21感受态细胞购自TaKaRa公司。
1.2 试剂 蛋白胨、酵母提取物、TCBS培养基购自英国OXOID公司;科玛嘉弧菌显色琼脂购自上海科玛嘉微生物技术有限公司;限制性内切酶、连接酶、DNA Marker购自大连宝生物公司;2×PCR Taq Mix购自广州东盛生物科技有限公司;琼脂糖凝胶回收DNA片段试剂盒和质粒小提试剂盒购自美国Axygen公司;DAB底物显色液试剂盒购自武汉博士德生物工程有限公司;其余试剂为进口或国产分析纯。二月龄雄性新西兰白兔,体重2.5~3 kg,购自中国科学院上海实验动物中心。
1.3 细菌DNA提取 取1 mL新鲜培养菌液于离心管中,10 000×g离心2 min,弃上清,收集沉淀。根据细菌基因组DNA(TIANamp Bacteria DNA kit,上海天根生物技术有限公司)提取试剂盒说明书提取细菌DNA,得到的DNA用灭菌水溶解,保存于-20℃备用。
1.4 引物设计与合成 根据GenBank中发表的副溶血弧菌tdh基因序列(GenBank 登录号:M10069),利用软件Primer Premier 5.0设计1对引物扩增tdh基因,上游引物tdh:5'-CCAGGATCCATGAAACACC AATATTTTGC-3',下划线处为引入的Bam H I酶切位点;下游引物tdh:5'-GCAGAGCTCTTATTTTT ATTGTTGATGT-3',下划线处为引入的Sac I酶切位点。引物由上海英骏生物公司合成。
1.5 目的基因的克隆、表达质粒构建与鉴定 以提取的SHJLA株基因组DNA为模板,扩增tdh基因,反应体系为25 μL:2×PCR Taq Mix 12.5 μL、上下游引物各0.5 μL、细菌基因组DNA 1 μL、以ddH2O补足体积。94℃预变性5 min,然后94℃变性30 s,60 ℃复性30 s,72℃延伸45 s,按以上步骤进行30个循环,最后72℃延伸10 min。取6 μL扩增产物进行1%琼脂糖凝胶电泳,回收目的基因。
将回收的目的基因与载体pGEM-T在16℃下连接过夜,之后转入E.coli TOP10感受态细胞中。将转化菌接种于含100 μg/mL氨苄青霉素的LB琼脂平皿,37℃培养12~20 h。挑取菌落,接种于含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、200 r/min震荡培养过夜。按照质粒小提试剂盒提取质粒DNA,经PCR扩增确定后由上海英骏有限公司进行测序。
对含pGEM-tdh和表达载体pET28a(+)的重组菌,分别提取质粒,选取BamH I和Sac I对pGEM-tdh和pET28a(+)质粒分别进行酶切,酶切体系60 μL,37℃酶切6 h。将酶切后的目的片段混合,加T4 DNA缓冲液和T4 DNA连接酶至总体积为10 μL,4℃反应过夜后,转入E.coli BL21(DE3)感受态细胞,采用PCR法和酶切法筛选阳性克隆。
1.6 目的基因在大肠杆菌中的表达 将阳性克隆株接种于5 mL LB 培养基(含50 μg/mL硫酸卡那霉素),37℃、200 r/min振荡培养6~8 h,取培养物全部加入新鲜的含相同浓度硫酸卡那霉素的LB培养基250 mL中,37℃、200 r/min振荡培养,扩增至OD600为0.6~0.8时(约2 h),加入异丙基硫代-β-D-半乳糖苷(IPTG)至终浓度0.2 mmol/L,诱导4~5 h。4 000×g离心10 min收菌,超声裂解细菌后再4℃、10 800×g离心25 min,分别收集上清液和沉淀,用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。
1.7 包涵体蛋白的复性 诱导表达后细菌经4℃,6 500×g离心15 min,去除上清。用0.1倍培养基体积的1×IB Wash Buffer(20 mmol/L Tris-HCl、pH7.5的10 mmol/L EDTA、1% Triton X-100)重悬沉淀,充分混匀。冰上操作,使细菌重悬液保持4℃,防止细胞裂解过程中产热,超声裂解细菌。超声后产物4℃、10 000×g离心10 min,收集包涵体。使用Merk公司的Protein Refolding Kit 蛋白重折叠试剂盒对包涵体蛋白进行复性,具体方法参照说明书进行。
1.8 Western blot分析复性蛋白的抗原性 将复性后的TDH蛋白进行SDS-PAGE电泳,电转移至PVDF膜,5%脱脂乳封闭过夜。用PBS快速洗涤3次,再用PBS置摇床洗涤3次(5 min/次)。将实验室感染副溶血弧菌SHJLA后存活的小鼠抗血清(本实验室制备并保存)按1:500用5%脱脂乳稀释,室温条件下,在摇床上反应0.5 h,37℃温箱反应1.5 h。取出后用PBS快速洗涤3次,再用PBS置摇床洗涤3次(5 min/次)。将辣根酶标记的羊抗鼠IgG按1:4000用5%脱脂乳稀释,室温摇床孵育0.5 h,37℃温箱反应1 h。PBS快速洗涤3次后置摇床洗涤3次(5 min/次)。取出PVDF膜按照DAB博士德生物工程有限公司说明书操作,显色约5 min,蒸馏水充分洗涤,终止反应。
1.9 重组蛋白TDH多克隆抗体的制备和效价测定 将纯化的重组蛋白TDH用生理盐水稀释至1 mg/mL,取1 mL与同体积佐剂Montanide ISA 50 V(SEPPIC,法国)混合,充分震荡混匀制成油乳混合物,采用背部皮下多点注射免疫新西兰白兔(2.5 kg);首免15、30 d用同样的方法进行第2次及第3次免疫。3免后d 10心脏采血,收集血液,室温静置2 h后,4℃静置过夜。次日4℃、12 000×g离心20 min,收集纯化TDH蛋白抗血清,-20℃保存备用。
采用BCA蛋白浓度测定试剂盒(碧云天)测定TDH蛋白的浓度。按常规方法用ELISA测定血清效价,以方阵实验数据为依据,将复性后的蛋白倍比稀释后包被酶标板,以倍比稀释的血清为一抗,HRP-羊抗鼠IgG为二抗,TMB显色,多功能酶标仪读取OD450n处值。选择阳性血清与阴性血清的比值OD450(P/N)最佳时对应的抗原、抗体稀释度分别为抗原最佳包被浓度及血清最佳稀释度。以最佳抗原包被浓度包被酶标板,多抗血清倍比稀释,读取OD450值,若待测孔OD值大于0.1,且P/N大于2.1,则判定为阳性,以阳性血清的最高稀释倍数为血清抗体效价。
1.10 多克隆抗体初步应用于副溶血弧菌Dot-ELISA检测 剪取适当大小的PVDF膜,用铅笔画边长为1 cm的方格,在甲醇中浸泡2~5 min后自然风干,取各菌5 μL点样于方格中间,37℃烘干。将已点样的PVDF膜浸入脱脂乳封闭液中进行封闭后,用PBST漂洗3次,每次5 min。加入抗TDH多抗体作用10 min,PBST漂洗3次,每次5 min。将膜浸入HRP-羊抗兔IgG中反应,PBST漂洗3次,每次5 min。将PVDF膜放于一干净的平皿中,按照DAB显色试剂盒说明书操作(博士德生物工程有限公司),避光显色约5 min,用蒸馏水洗涤终止反应。出现明显的斑点为阳性,无斑点为阴性。
2. 结果
2.1tdh基因的PCR扩增与克隆 以副溶血弧菌SHJLA株的基因组DNA为模板,经PCR扩增得到预期大小约为576 bp的目的片段,空白对照组无特异性扩增条带(图1)。将tdh基因定向克隆至表达载体pET28a(+)。重组质粒经BamH I和SacI双酶切得到约576 bp和5 000 bp左右的片段(图2),与预期结果一致。将重组表达质粒命名为pET28a-tdh。
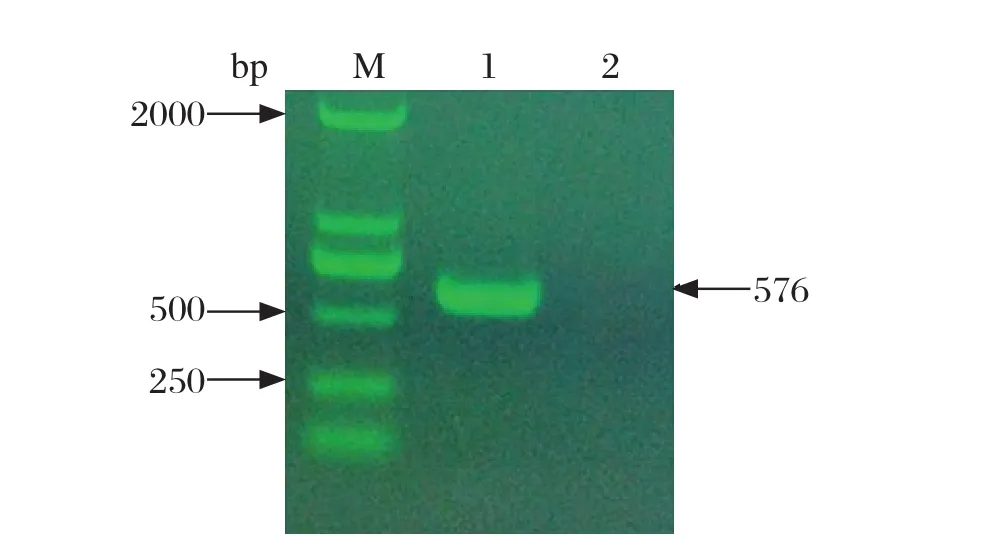
图1 tdh基因PCR扩增结果Fig. 1 The results of PCR amplification of tdh gene
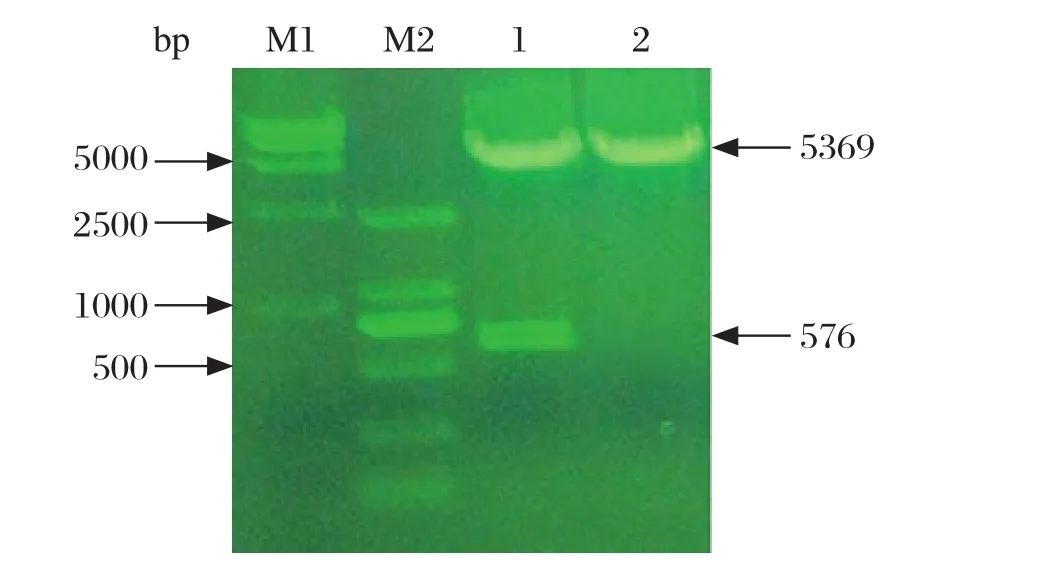
图2 pET28a(+)-tdh重组质粒酶切鉴定结果Fig. 2 Identification of recombinant plasmid pET28a(+)-tdh by restriction enzyme digestion
2.2 测序结果及同源性分析 运用DNAStar软件进行序列分析表明,副溶血弧菌tdh基因序列共有570 bp,阅读框正确,编码190个氨基酸,编码蛋白大小约为21 kDa。Blast比对后发现与RIMD2210633株(GenBank BA000031.2)同源性达100%,与BB22OP株(GenBank登录号:CP003973.1)同源性达100%,与ATCC 17803(GenBank登录号:AY249144.1)同源性达99%。
2.3 目的基因在大肠杆菌中的表达、纯化和鉴定 副溶血弧菌TDH蛋白的分子量约为21 kDa,pET28a(+)质粒编码表达约6 kDa的蛋白片段,推测重组蛋白为27 kDa。表达菌经诱导后,取样裂解处理。经SDS-PAGE电泳分析后,在27 kDa处出现预期目的条带,诱导前重组蛋白未出现相应条带。表达的重组蛋白主要以包涵体的形式存在,使用Merk公司的蛋白重折叠试剂盒对包涵体蛋白进行复性纯化(图3)。将复性的重组蛋白进行Western blot分析,能被感染副溶血弧菌存活的鼠感染血清所识别,在27 kDa处呈现明显的条带(图4),表明复性的THD蛋白表达产物具有较强的反应原性。
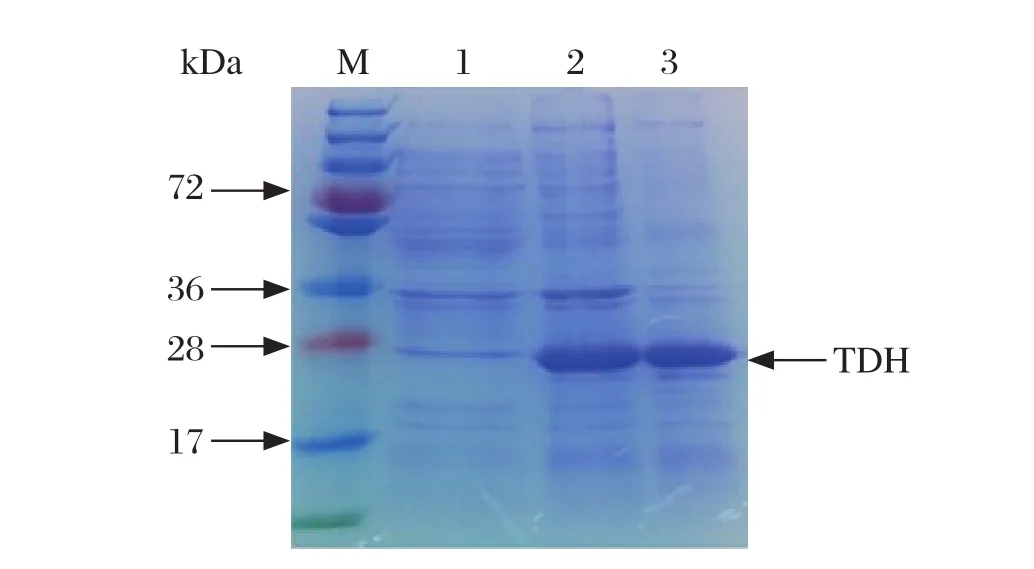
图3 TDH重组蛋白表达及复性产物SDS-PAGE分析Fig. 3 SDS-PAGE analysis of the expression and refolding of recombinant protein TDH

图4 重组蛋白TDH的Western blot分析Fig. 4 Western blot analysis of the recombinant protein TDH
2.4 ELISA测定表达产物免疫效价 采用BCA蛋白浓度测定试剂盒(碧云天)测定重组蛋白TDH蛋白浓度为1.6 mg/mL。采用ELISA方阵滴定法对表达产物制备的多克隆抗体进行效价测定,多抗血清按1:8000稀释时,表达产物TDH抗原(1.6 mg/mL)以1:500稀释,反应灵敏且阳性血清OD450>1.0。据此确定TDH抗原最佳包被浓度为3.2 μg/mL,制备的多抗血清最佳稀释度为1:8000。以TDH抗原最佳包被浓度3.2 μg/mL包被,同时设立平行对照组,多抗血清系列稀释,当P/N>2.1,制备的TDH多抗血清效价至少为1:256 000。
2.5 抗TDH多克隆抗体的初步应用 Dot-ELISA检测结果表明,只有产生TDH的阳性副溶血弧菌可以呈现明显清晰地斑点,而不能产生TDH的副溶血弧菌以及其他阴性对照菌均无斑点显示,结果见图5。表明本研究制备的抗TDH多抗可应用于副溶血弧菌的Dot-ELISA检测。

图5 抗TDH多克隆抗体应用于Dot-ELISA的检测Fig.5 Application of anti-TDH polyclonal antibody in Dot-ELISA test
3 讨论
目前副溶血弧菌引起的食物中毒事件在细菌性食源感染致病的比例较高,其危害程度仅次于沙门氏菌、大肠杆菌、葡萄球菌和肉毒梭菌,因此副溶血弧菌检测被各国列为食品安全重点检测和监控的项目,其中市售水产品中的副溶血弧菌检测更是重中之重[12]。副溶血弧菌引起食物中毒主要是因为其溶血毒素(TDH和TRH),国内外对直接耐热溶血素TDH研究较为广泛,被认为是区分致病副溶血弧菌和非致病菌的标志[7]。环境中分离到的副溶血弧菌多数为非致病菌,而临床分离株tdh基因的携带率可达90%以上[13]。
Kumar等[14]建立了针对副溶血弧菌TRH毒素建立的双抗体夹心 ELISA 法。目前采用免疫学技术对TDH 的检测研究比较少见,主要采用分子生物学技术,如:多重 PCR、荧光实时定量 PCR 等[15]。这些检测方法的硬件条件和操作技术要求比较高,在实践工作中的推广难度较大。而ELISA等免疫学检测方法具有检测成本低,操作简单快捷等优点,容易进行快速推广使用。刘秀萍等[16]建立了弧菌融合蛋白TDH-VVC-VMHA双抗体夹心ELISA 检测方法,用于副溶血弧菌、创伤弧菌或拟态弧菌毒素的检测。在食品中毒性弧菌的检验中,该检测方法可以提高初筛的速度与效率。Dot-ELISA方法具有快速、特异性较强、重复性好、可同时检测大量的样品等优点,既保留了常规ELISA的优点,又克服了其繁琐的程序,且结果直观,可用肉眼直接观察,实现待检菌株的快速有效检测[17]。
本研究首先表达副溶血弧菌的TDH重组蛋白,并免疫新西兰大白兔制备抗体,将抗TDH多抗应用于副溶血弧菌致病菌Dot-ELISA检测方法的建立,结果表明可有效的鉴定出TDH阳性的致病性副溶血弧菌,为开发副溶血弧菌快速诊断试剂盒奠定了基础,并有望在将来的致病性副溶血弧菌的检测中得到大量推广使用。
[1]McCarter L. The multiple identities of Vibrio parahaemolyticus[J]. J Mol Microbiol Biotechnol,1999,1(1): 51-57.
[2]蒋蔚, 李欣彤, 何再平, 等. 副溶血弧菌 SHJLA 株的分离鉴定及致病性分析[J]. 中国动物传染病学报, 2013, 21(6): 26-32.
[3]Kaneko T, Colwell R R. Ecology of Vibrio parahaemolyticus in Chesapeake Bay[J]. J Bacteriol,1973(1): 113: 24-32.
[4]Koralage M, Alter T, Pichpol D, et al. Prevalence and molecular characteristics of Vibrio spp isolated from preharvest shrimp of the North Western Province of Sri Lanka [J]. Food Prot, 2012, 75: 1846-1850.
[5]樊景凤, 宋立超, 王 斌, 等. 一株引起凡纳滨对虾红体病的病原菌-副溶血弧菌的初步研究[J]. 海洋科学, 2006,30(4): 40-44.
[6]Broberg C A, Calder T J, Orth K. Vibrio parahaemolyticus cell biology and pathogenicity determinants [J]. Microbes Infect, 2011, 13(12-13): 992-1001.
[7]Okuda J, Ishibashi M, Abbott S, et al. Analysis of the thermo stable direct hemolysin (tdh)gene and the tdhrelated hemolysin (trh)genes in urease-positive strains of Vibrio parahaemolyticus isolated on the West Coast of the United States[J]. Clin Microbiol, 1997, 35(8): 1965-1971.
[8]Yanagihara I, Nakahira K, Yamane T, et al. Structure and functional characterization of Vibrio parahaemolyticus thermostable direct hemolysin [J]. Biol Chem, 2010,285(21):16267-16274.
[9]Shirai H, Ito H, Hirayama T, et al. Molecular epidemiologic evidence for association of thermostable direct hemolysin (TDH)and TDH-related hemolysin of Vibrio parahaemolyticus with gastroenteritis[J]. Infect Immun, 1990, 58 (11): 3568-3573.
[10]Honda T, Ni Y, Miwatani T, et al. The thermostable direct haemolysin of Vibrio parahaemolyticus is a poreforming toxin[J]. Can J Microbiol, 1992, 38 (11): 1175-1180
[11]Takahashi A, Sato Y, Shiomi Y, et al. Mechanisms of chloride secretion induced by thermostable direct haemolysin of Vibrio parahaemolyticus in human colonic tissue and a human intestinal epithelial cell line[J]. J Med Microbiol, 2000, 49(9): 801-810.
[12]赵怀龙, 付留杰, 唐功臣. 我国主要的食源性致病菌[J].医学动物防制, 2012, 28 (11): 1212-1216.
[13]Yeung P S, Boor K J. Epidemiology, pathogenesis,and prevention of foodborne Vibrio parahaemolyticus infections[J]. Foodborne Pathog Dis, 2004, 1(2): 74-88.
[14]Kumar B K, Raghunath P, Devegowda D, et al.Development of monoclonal antibody based sandwich ELISA for the rapid detection of pathogenic Vibrio parahaemolyticus in seafood[J]. Int J Food Microbiol,2011, 145(1): 244-249.
[15]窦勇, 胡佩红, 顾鹏程. 副溶血弧菌 TDH 毒素及其检测方法研究进展[J]. 现代食品科技, 2013, 29(1): 215-218.
[16]刘秀萍, 王铁良, 唐峰. 弧菌融合蛋白 TDH-VVCVMHA 双抗体夹心 ELISA 检测方法的建立[J].中国农学通报, 2011, 27(32): 34-37.
[17]任燕, 潘子豪, 陆承平, 等. Dot-ELISA法检测致病性嗜水气单胞菌[J]. 畜牧兽医学报, 2011, 42(10): 1409-1415.
