基于Glaser偶合反应的铜离子探针的合成及性能
2015-06-07郑长征
屈 涛,郑长征
(西安工程大学环境与化学工程学院,陕西西安 710048)
基于Glaser偶合反应的铜离子探针的合成及性能
屈 涛,郑长征
(西安工程大学环境与化学工程学院,陕西西安 710048)
为准确检测溶液中铜离子浓度,首先合成结构简单的有机小分子铜离子探针,利用探针分子能够发生Glaser偶合反应的性质对铜离子进行实时检测,研究探针分子结构对铜离子响应的灵敏度.其次通过核磁共振确定探针分子的结构,利用紫外吸收光谱和荧光光谱分析探针分子对铜离子的识别作用.最后通过紫外光谱确定荧光光谱的激发波长为370nm,且荧光发射强度随铜离子浓度的增加而减弱,随时间的延长而降低.
铜离子;荧光探针;Glaser偶合;荧光强度
重金属离子是化学、生命科学、环境科学和医学等许多领域研究的重点,对溶液中铜离子的识别和检测是分析化学的主要任务之一[1].铜离子是一种广泛存在于环境中的常见重金属离子,它在人体内的适量存在有益于维持机体的正常工作,如参与体内的造血作用、酶反应以及一些氧化还原过程等.若体内铜离子的代谢平衡受到破坏,则有可能导致一系列疾病[2-3].因此,寻求一种快速而灵敏的检测铜离子的方法具有非常重要的意义.目前主要的检测方法有化学法、光谱法以及荧光探针法.其中化学法也称为滴定法,是利用无机沉淀剂或者有机沉淀剂定量滴定,但离子的选择性太差;光谱法是通过原子吸收光谱,电感耦合等离子体发射光谱以及光谱电化学法来分析检测,但操作繁琐,仪器价格高昂.荧光分子探针检测法不仅简便,而且在高灵敏度、选择性、时间分辨、实时原位检测方面均有突出优点[4-7].有机探针分子的结构多样,种类繁多,可选择性高,并且其价格低廉,操作简便,检测效果明显,快速高效.因此,寻求新型兼具分子质量小,易操作合成的铜离子探针对于环境及生命科学都极为重要[8-9].本文通过合成结构简单的有机小分子铜离子探针,利用探针分子能够发生Glaser偶合反应的性质对铜离子进行检测.
1 实 验
1.1 仪器
电热恒温鼓风干燥箱(DHG-9123A,上海精宏);旋转蒸发器(RE52GS-1,上海亚荣生化仪器厂);电子天平(BS124S型,北京赛多利斯仪器有限公司);核磁共振波谱仪(Advance Bruker 400M);荧光分光光度计(日本岛津RF-5301PC);紫外可见分光光度计(日本岛津UV-2450).
1.2 药品
四丁基氟化铵(天津市光复精细化工研究所);四氢呋喃(天津市天力化学试剂有限公司);氢氧化钠(天津市光复科技发展有限公司);无水乙醇(CH3CH2OH,天津市永大化学试剂开发中心,分析纯);丙酮(天津市富宇精细化工有限公司,分析纯);氨水(西安三浦化学试剂有限公司,分析纯).
1.3 原理
铜离子的检测过程只需在合成探针分子后配制成有机溶液或者水溶液,便可以进行快速检测.但合成适于含水体的新型探针分子仍具有挑战性.若改善探针分子在水中的检测效果,可加入羧基,但检测时增加有机试剂的用量会对环境和生物体系不利,所以增加探针分子的水溶性显得更加重要.文中利用Glaser偶合原理,在铜催化作用下,化合物发生偶合反应,将三键连在一起生成一定的聚合物,并进行水解反应,分子上的羧基可增加其水溶性,为荧光铜离子探针进入人体体液中进行检测创造可能性.
1.4 合成
荧光铜离子探针分子合成路线如图1所示.
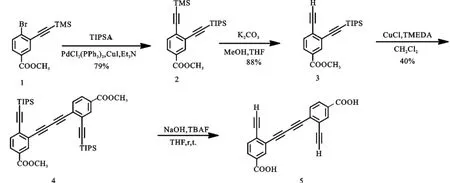
图1 H-Cu1荧光铜离子探针分子合成路线Fig.1The synthetic route of H-Cu1fluorescent copper ion probe
1.4.1 中间产物2的合成 分别称取1.398g(4.1mmol)的化合物1,0.145g(0.21mmol)的三苯基膦二氯化钯及0.078g(4.92mmol)碘化亚铜.首先将称好的化合物1和50mL的四氢呋喃加入到三口烧瓶中,氮气鼓泡20min除去空气[10].鼓泡结束后,在溶液中加入0.145g的三苯基膦二氯化钯及0.078g碘化亚铜,搅拌溶解.混合溶液用氮气鼓泡20min后,加入0.7mL的TMSA,搅拌均匀再鼓泡20min.把反应混合物加热到50℃,搅拌反应24h后冷却,再旋转蒸发除去溶剂.过层析柱后旋干溶剂,展开剂极性为乙酸乙酯/正己烷=1/6,得到最终产物为无色油状液体.通过核磁测定其结构超参数为:1H NMR(400MHz,CDCl3)δ8.11(d,J=1.4Hz,1H),7.87(dd,J=8.2,1.7Hz,1H),7.52(d,J=8.2Hz,1H),3.92(s,3H),1.16(s,21H),0.25(s,9H).
1.4.2 中间产物3的合成 将1.4g(3.39mmol)的化合物2,0.258g(1.87mmol)的碳酸钾,30mL的四氢呋喃,30mL的甲醇依次加入到100mL单口圆底烧瓶中,混合溶液在室温(28℃)下搅拌5h后,待反应完全,停止反应.将混合液移入500mL的烧杯中,加入100mL的去离子水和50mL的乙醚,将混合液分两次萃取后,收集有机相,加入无水硫酸镁干燥1h,过滤除去硫酸镁.旋转蒸发掉溶剂后,收集产物.过柱子后旋干溶剂,展开剂极性为乙酸乙酯/正己烷=1/19,得到最终产物为无色油状液体.通过核磁测定其结构参数为1H NMR(400MHz,CDCl3)δ8.13(d,J=1.5Hz,1H),7.90(dd,J=8.1,1.7Hz,1H),7.54(d,J=8.1Hz,1H),3.93(s,3H),3.41(s,1H),1.15(s,21H).
1.4.3 中间产物4的合成 称取0.98g(2.88mmol)的化合物3,将其与100mL二氯甲烷,3mL的四甲基乙二胺(TMEDA)依次加入到200mL的圆底烧瓶中.再称取0.3g(3mmol)的氯化亚铜加入到上述烧瓶中.混合物在38℃搅拌4h,点板后发现反应物消耗完,停止反应.将混合物倒入500mL的烧杯中,加入100mL水,搅拌均匀.萃取混合物3次后,收集有机相,用无水硫酸镁干燥1h后,过滤,除去无水硫酸镁,旋转蒸发除掉溶剂,过柱子分离产物,得到浅黄色油状物.通过核磁测定其结构参数为:1H NMR(400MHz,CDCl3)δ8.14(d,J=1.3Hz,1H),7.93(dd,J=8.2,1.6Hz,1H),7.52(d,J=8.2Hz,1H),3.94(s,3H),1.17(s,21H).
1.4.4 化合物5的合成 称取200mg上述反应式的化合物4,放入圆底烧瓶中,加入40mL四氢呋喃,30mL的NaOH(2mol/L)溶液,室温下(28℃)搅拌反应10h进行点板.待反应完全后,将圆底烧瓶放置在冰水浴的环境下慢慢滴加稀盐酸.在pH为5时产生白色沉淀物,过滤,然后收集产品,通过核磁测定其结构参数为:1H NMR(400MHz,DMSO)δ7.99(d,J=1.1HZ,2H),7.97(dd,J=8.1,1.6Hz,2H),7.71(d,J=8.1Hz,2H),3.31(2H).
2 结果与讨论
2.1 储备液的配置
称取0.003 4g化合物5,溶于1mL的四氢呋喃中,制成1×10-2mol/L的溶液.用微量进样器取50μL上述溶液,稀释到浓度为1×10-5mol/L的四氢呋喃溶液.称取0.026 6g氯化铜固体并溶于20mL的水中,配置1×10-2mol/L的氯化铜溶液.称取0.019 8g氯化亚铜固体,将其溶于20mL的水中,配置1×10-2mol/L溶液.
2.2 Cu2+对化合物5的紫外荧光光谱影响
2.2.1 不同Cu2+加入量的影响 加入铜离子的反应量对化合物5发生偶合反应非常重要.因此,文中考察Cu2+加入量对化合物光谱的影响.取2mL 1×10-5mol/L的探针分子溶液于比色皿中,用微量进样器取50μL浓度为1×10-2mol/L的氯化铜溶液于比色皿中,搅拌10min进行紫外、荧光测试.共滴加300μL氯化铜溶液,测试6组数据,图2所示为滴加不同Cu2+量的化合物5的紫外光谱图和荧光光谱图.
从图2(a)可以看出,紫外光谱曲线中最大的吸收峰所对应的波长是跃迁时所吸收光线的波长,光谱图波峰位置的波长都择350nm.所以荧光测试的激发波长选择350nm.化合物5的紫外-可见吸收峰随着Cu2+加入量的增加逐渐减弱,当加入300μL Cu2+时达到最低值.
图2(b)可以看出,图谱中荧光的峰值位于410nm,有一个尖峰位于425nm.随着Cu2+加入量的增加,位于410nm的荧光峰逐渐减弱;位于425nm处的荧光峰先增加,当Cu2+加入量达到250μL时开始减弱.从峰值变化可知,随着Cu2+加入量的增加,化合物5的荧光强度出现先增强后减弱的现象.因此,Cu2+加入量会改变化合物的荧光强度.
2.2.2 反应时间的影响 考虑Glaser偶合反应需要一定的时间.因此在铜离子加入后,测试化合物5与铜离子反应时间对光谱的影响.将配好的20mL 1×10-5mol/L的探针分子溶液放于小烧杯中,用微量进样器取100μL于小烧杯中,搅拌10min后取2mL于比色皿中进行紫外光谱和荧光光谱测试.测试时继续搅拌小烧杯中溶液.第1次测试完后将比色皿中溶液倒掉,取2mL再次搅拌10min的溶液于比色皿中再进行紫外荧光测试.如此循环共测试6次.图3为化合物5随着反应时间变化的紫外荧光光谱图.
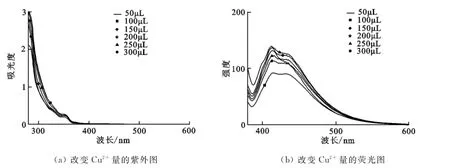
图2 不同Cu2+浓度下化合物5的紫外荧光光谱图Fig.2UV-Visible spectra and fluorescence spectra of compound 5in different concentration of Cu2+
从图3(a)可以看出,光谱曲线中最大的吸收峰所对应的波长是跃迁时所吸收光线的波长.光谱图波峰位置的波长都370nm.所以荧光测试的激发波长都选择370nm.同时,化合物5的紫外-可见吸收峰随着Cu2+加入后搅拌时间的增加逐渐增强.
图3(b)是随着时间变化Cu2+与化合物5反应的荧光光谱图.从图中可以看出化合物5的主荧光峰值位于420nm,同时在400nm,450nm处分别有两个肩峰.随着Cu2+离子与化合物作用时间的延长,化合物5的3个荧光峰的强度都在减弱.当反应60min时荧光强度达到了最低,降低至之前的一半.
从以上对Cu2+加入量和搅拌时间的光谱测试可以初步判断化合物5检测Cu2+时会随着化合物5溶液中Cu2+浓度的增加,荧光减弱.同样随着搅拌时间的延长荧光强度也会减弱.这说明Cu2+可能使得化合物发生了Glaser偶合,从而使得探针分子生成了偶合化合物,荧光强度降低.
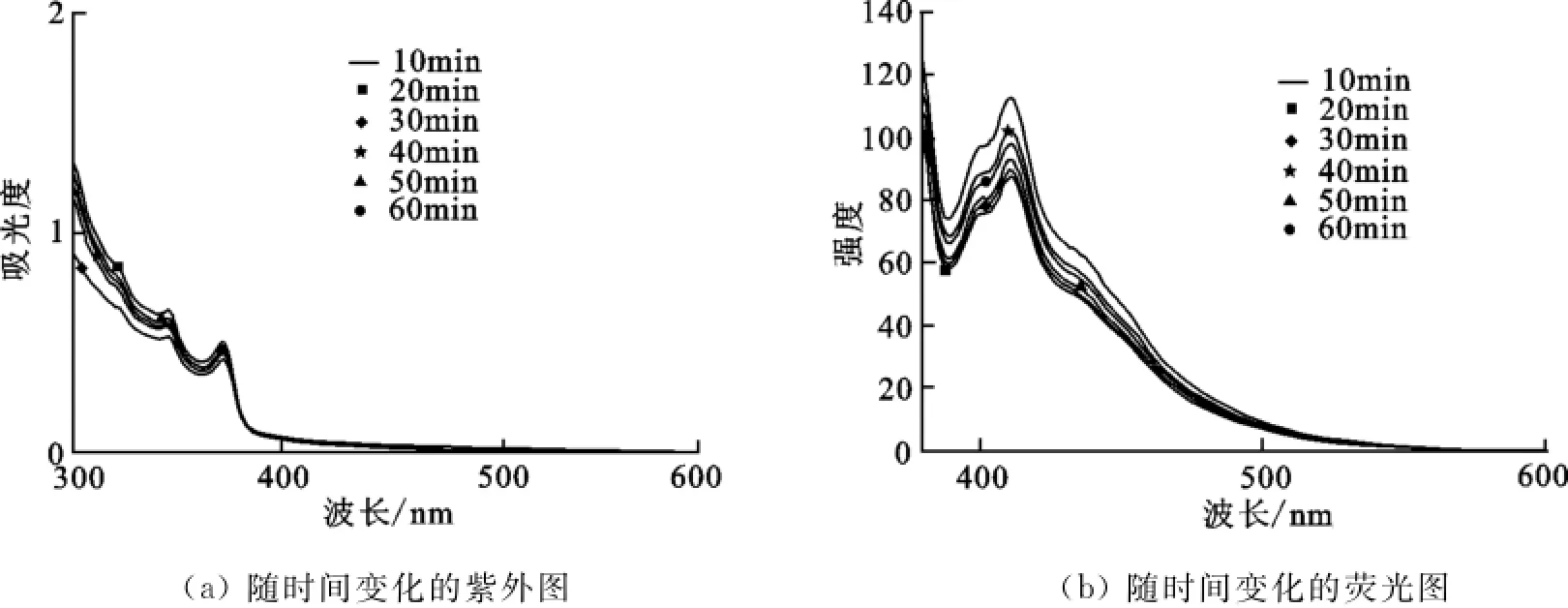
图3 不同反应时间下化合物5的紫外荧光光谱图Fig.3UV-Visible spectra and fluorescence spectra of compound 5in different reaction time
2.3 Cu+对化合物5的紫外荧光光谱性能影响
2.3.1 不同Cu+加入量的影响 取2mL 1×10-5mol/L的探针分子溶液于比色皿中,用微量进样器取50μL浓度为1×10-2mol/L的氯化亚铜溶液于比色皿中,搅拌10min后进行紫外、荧光测试.然后每次多加50μL氯化亚铜溶液于比色皿中搅拌10min,检测其紫外、荧光性能.共加入300μL氯化亚铜溶液,测试6组数据.
从图4(a)可以看出,光谱曲线中最大的吸收峰所对应的波长是跃迁时所吸收光线的波长.光谱图波峰位置的波长都在360nm.所以荧光测试的激发波长都选在360nm.从紫外光谱图可以看出,化合物5的紫外-可见吸收峰随着Cu+加入量的增加逐渐增强,当加入300μL Cu+时,紫外可见吸光度达到最大值.
图4(b)是随着Cu+加入量的增加,化合物5的荧光光谱图.观察图中化合物5有2个明显的荧光峰,即在440~450nm左右有2个明显的尖峰.荧光主峰峰值位于410nm,另一个荧光峰位于395nm.随着Cu+加入量的增加,位于395nm和410nm的荧光峰明显减弱,当Cu+加入量达到300μL时,荧光强度降低最多.从峰值变化可知随着一价铜离子加入量的增加,化合物5的荧光强度出现明显减弱,Cu+加入越多,化合物5的荧光强度就越弱,说明化合物能够定性检测Cu+离子.
图4 不同Cu+浓度下化合物5的紫外荧光光谱图Fig.4UV-Visible spectra and fluorescence spectra of compound 5in different concentration Cu+
2.3.2 反应时间的影响 取20mL配好的1×10-5mol/L的探针分子溶液放于小烧杯中,用微量进样器取100μL氯化亚铜溶液于小烧杯中,加入磁石搅拌10min后取2mL于比色皿中进行紫外荧光光谱测试.测试时让小烧杯中溶液继续搅拌.测试完后将比色皿中溶液倒掉,再次抽取2mL搅拌10min后的溶液于比色皿中再进行紫外荧光光谱测试.
图5(a)是Cu+随着时间变化的紫外光谱,曲线中最大的吸收峰所对应的波长是跃迁时所吸收光线的波长.波峰位置的波长都在370nm.化合物5的紫外-可见吸收峰随着搅拌时间的增加逐渐增强,当加入300μL时Cu+紫外可见吸收峰达到最大值.
观察随着时间变化Cu+与化合物5反应的荧光光谱图(图5(b)),发现化合物5的荧光吸收峰值位于410nm,在430nm处有尖峰.随着Cu+与化合物作用时间的延长,化合物5荧光峰的强度在不断减弱.当反应60min时荧光强度达到了最低.从以上对Cu+加入量和搅拌时间的光谱测试可以初步判断化合物5检测Cu+时会随着Cu+加入量的增加荧光减弱,同样随着搅拌时间的增长荧光强度也会减弱.这说明Cu+可使化合物5发生Glaser偶合,生成偶合化合物,从而使得荧光强度降低.
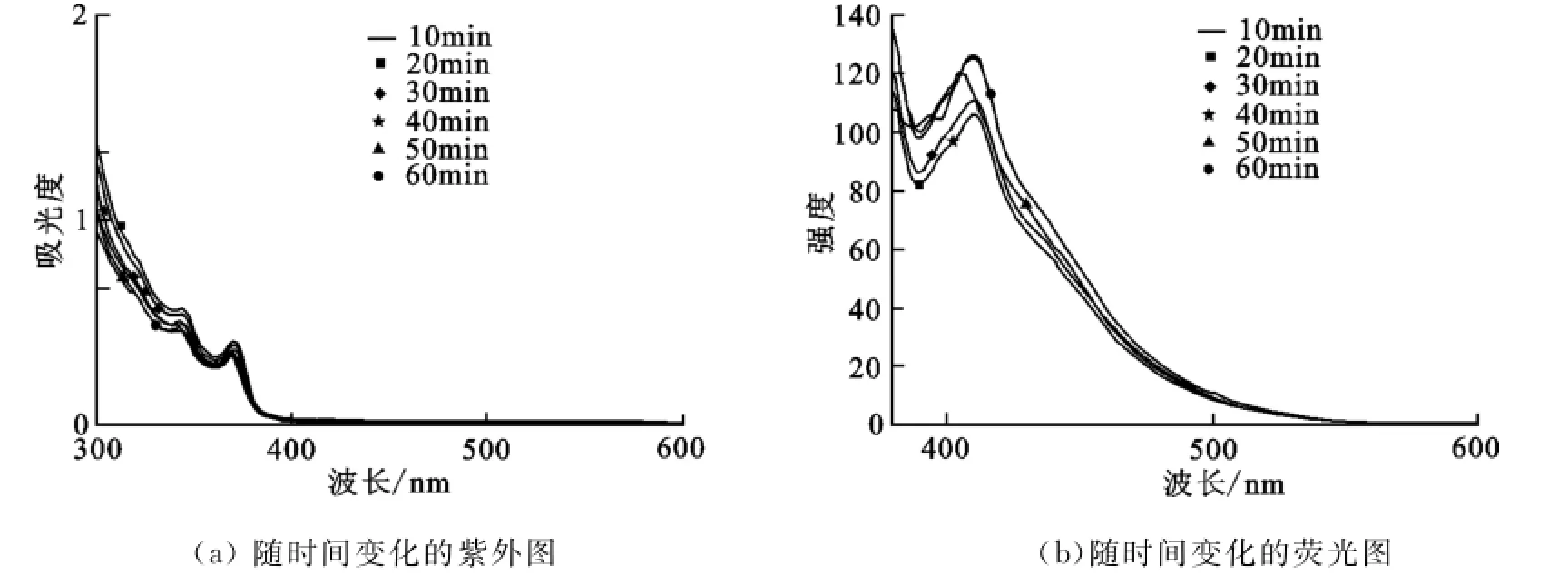
图5 不同反应时间下化合物5的紫外荧光光谱图Fig.5UV-Visible spectra and fluorescence spectra of compound 5in different reaction time
2.4 Cu2+和Cu+与化合物5的反应机制分析
结合上述的紫外可见光谱和荧光光谱数据,可以推测铜离子的加入使得探针分子化合物5的荧光强度减弱,主要是由于化合物5在铜离子的催化下发生了Glaser偶合反应,生成了具有三键-单键-单键单元结构的螺旋状产物,该产物可能是聚合物,无法测试其荧光.图6是推测化合物5发生Glaser偶合反应后生成的化合物.图7通过计算软件对生成偶合产物的结构进行了优化.以此为据,能够得到为何探针分子在加入铜离子之后其紫外和荧光光谱均发生了变化,也可以说明化合物5作为铜离子探针的潜质.
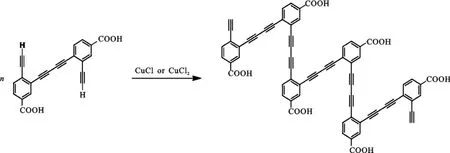
图6 化合物5发生的Glaser偶合反应Fig.6The Glaser coupling reaction of compound 5
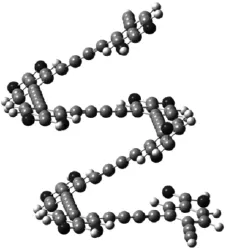
图7 化合物5耦合后的优化结构Fig.7The optimized structure of compound 5produced by Glaser coupling reaction
3 结束语
本文合成一种新型的小分子铜离子荧光探针,通过核磁共振对
其结构进行表征.紫外吸收和荧光光谱测定表明荧光铜离子探针可以检测到铜离子并能反应出铜离子的浓度大小.结合光谱数据,铜离子的加入使得探针分子的荧光强度减弱,主要是由于荧光探针分子在铜离子的催化下发生了Glaser偶合反应,生成了聚合物.
[1] 许金钩,王尊本.荧光分析法[M].2版.北京:科学出版社,2006:3-4.XU Jingou,WANG Zunben.Fluorescence Analysis[M].2nded.Beijing:Science Press,2006:3-4.
[2] KIM J S,QUANG D T.Calixarene-derived fluorescent probes[J].Chem Rev,2007,107:3780-3799.
[3] VALEUR B,LERAY I.Design principles of fluorescent molecular sensors for cation recognition[J].Coord Chem Rev,2000,205:3-40.
[4] BARCELOUX D G J,BARCELOUX D.Copper[J].Clin Toxicol,1999,37(2):217-230.
[5] HARRISON M D,DAMERON C T.Molecular mechanisms of copper metabolism and the role of the Menkes disease protein[J].J Biochem Mol Toxicol,1999,13(2):93-106.
[6] STRAUSAK D,MERCER J F B,DIETER H H,et al.Copper in disorders with neurological symptoms:Alzheimer's,Menkes,and Wilson diseases[J].Brain Res Bull,2001,55(2):175-185.
[7] WAGGONER D J,BARTNIKAS T B,GITLIN J D.The role of copper in neurodegenerative disease[J].Neurobiology of Disease,1999,6(4):221-230.
[8] 易卫国,张荣,顾峥.一种新型铜离子荧光分子探针的合成与性能研究[J].化学学报,2011,69(8):1024-1028.YI Weiguo,ZHANG Rong,GU Zheng.Synthesis and characterization of a new fluorescence molecular probe for copper ions[J].Acta Chemica Sinica,2011,69(8):1024-1028.
[9] TAPIERO H,TOWNSEND D M,TEW K D.The antioxdant role of selenium and seleno-compounds:Oxidative stress pathologies and antoxidants[J].Biomedicine &Pharmacotherapy,2003,57(3-4):134-144.
[10] 吕晓利.新型荧光金属离子探针的设计、合成及性能研究[D].北京:北京化工大学,2012:15-25;35-72.LYU Xiaoli.The research on design,synthesis and performance of new fluorescent probes for metal ions[D].Beijing:Beijing University of Chemical Technology,2012:15-25;35-72.
编辑、校对:武 晖
Synthesis and characterization of Cu iron fluorescence probes based on Glaser coupling reaction
QU Tao,ZHENG Changzheng
(School of Environmental and Chemical Engineering,Xi′an Polytechnic University,Xi′an 710048,China)
In order to test copper ion in solution,firstly,fluorescent copper ion probes with simple structure is synthesized,the copper ion could be detected by Glaser coupling reaction of the fluorescent probe.Then,the molecular structure of copper ion probe is confirmed by1HNMR data.The UV-Vis and fluorescence spectra were used to study the role of the probe for recognizing copper ion.The fluorescence spectra were measured at 370nm determined by the UV-Vis spectra.The results of fluorescence spectra show that the fluorescence emission intensity is weakened with the increase of concentration of copper ion,and decreased with the extension of reaction time.
copper ion;fluorescence probes;Glaser coupling reaction;fluorescence intensity
O 622.5
A
1674-649X(2015)05-0561-06
10.13338/j.issn.1674-649x.2015.05.008
2015-05-20
郑长征(1959—),男,陕西省横山县人,西安工程大学教授,研究方向为金属有机煤化工.E-mail:zgcgzg@126.com
