微生物燃料电池对苯酚的降解及其产电性能
2015-06-06陈柳柳陈英文祝社民沈树宝
陈柳柳,徐 源,杨 倩,陈英文,祝社民,沈树宝
(1. 南京工业大学 生物与制药工程学院,江苏 南京 210009;2. 南京工业大学 材料科学与工程学院,江苏 南京 210009)
研究报告
微生物燃料电池对苯酚的降解及其产电性能
陈柳柳1,徐 源1,杨 倩1,陈英文1,祝社民2,沈树宝1
(1. 南京工业大学 生物与制药工程学院,江苏 南京 210009;2. 南京工业大学 材料科学与工程学院,江苏 南京 210009)
构建了单室空气阴极微生物燃料电池(MFC),研究了苯酚含量对以苯酚和葡萄糖为底物的MFC产电性能及苯酚去除率的影响。实验结果表明:当CODB(苯酚贡献的COD)为0时,MFC的运行周期为36 h,最大输出电压为560 mV,最大功率密度为489 mW/m2;CODB为1 000 mg/L时,MFC的运行周期为54 h,最大输出电压为436 mV,最大功率密度为98 mW/m2;当CODB为200 mg/L时,MFC的COD去除率、苯酚去除率和库伦效率(CE)均达到最大,分别为89.7%、99.9%和 7.2%,同时, MFC的阳极生物膜产生的氧化峰电流最高,表明在葡萄糖-苯酚双底物对微生物的协同作用下,MFC的阳极生物膜氧化性最强;随着CODB的增大,COD去除率、苯酚去除率和CE均逐渐减小,说明苯酚的抑制作用导致微生物活性降低。
微生物燃料电池;苯酚;葡萄糖;底物;产电性能;阳极;生物膜
微生物燃料电池(MFC)由于既能将废水中有机物的化学能转换成电能或氢能,同时又能处理废水而受到广泛关注[1]。此外,MFC具有原料来源广泛、反应条件温和以及产物CO2和H2O不会造成二次污染等优点。MFC的底物主要是葡萄糖[2]、乙酸盐[3-4]、丁酸盐[3]、生活污水[5]等易生物降解的物质。然而,实际废水中含有大量的生化性较差、高浓度下有毒性的难降解有机物,如酚类化合物、芳香类化合物等。这类有机物能否作为MFC的底物,在被降解的同时产生电能,是MFC能否产业化的关键问题之一。
苯酚是一种典型的酚类难降解物质,广泛用于合成树脂、香料、染料、炼油、农药、医药等的生产中。苯酚对皮肤、黏膜有腐蚀作用,可抑制中枢神经或损害肝、肾功能,因此,美国环境保护署将苯酚列为优先污染物。研究表明,苯酚不仅可作为MFC底物,在有效降解的同时产生电能,而且在驯化期加入葡萄糖能提高MFC的功率密度,但目前以苯酚为底物MFC的功率密度普遍较低,通常为6~39 mW/m2[6-9]。
本工作构建了单室空气阴极MFC,研究了苯酚含量对以苯酚和葡萄糖为底物的MFC的产电性能的影响,并探索了该过程中阳极微生物的氧化还原活性,为MFC处理酚类有机物提供参考。
1 实验部分
1.1 实验装置
采用碳布作为阳极、Pt/C催化剂作为阴极,构建单室空气MFC。反应器由有机玻璃制成,呈圆筒型。阳极室容积85 cm3,阳极有效面积28.3 cm2,电极间距3 cm。两电极间以铜线相连,外接电阻1 000 Ω。输出电压由信号采集与分析系统(南京贺普科技有限公司)进行采集,采集频率为1次/min。
1.2 MFC的微生物接种与运行
将菌株在实验室配制的葡萄糖培养液中驯化培养,厌氧污泥和葡萄糖培养液按体积比1∶1加入反应器内进行挂膜。培养液组成[10]:葡萄糖1 g/ L,NH4Cl 0.31 g/L,KCl 0.13 g/L,Na2HPO4·12H2O 11.88 g/L,NaH2PO4·2H2O 2.55 g/L,MgSO4·7H2O 0.19 g/L,微量元素。经过一段时间驯化后,当输出电压稳定时,按照MFC底物CODT(总COD)为1 000 mg/L,逐步增加苯酚的含量,使CODB(苯酚贡献的COD)分别为0,200,400,600,800,1 000 mg/ L,相对应的CODG(葡萄糖贡献的COD)分别为1 000,800,600,400,200,0 mg/ L。待MFC产电稳定后,记录相关数据。待输出电压低于130 mV时,更换新底物。MFC运行温度控制在(33±0.1)℃。
1.3 计算方法
最大功率密度可通过测定极化曲线得到;极化曲线通过稳态放电法测得,即当MFC输出电压达到每个周期的最大值并稳定时,通过调节变阻箱,改变负载电阻的大小,测定电阻两端的电压。电流(I,A)和功率密度(P,mW/m2)按式(1)和式(2)计算。

式中:U为输出电压,mV;R为负载电阻,Ω;A为阳极有效面积,m2。
由式(3)计算库伦效率(CE,%)[3]。

式中:t为反应时间,h;M为O2的相对分子质量,32 g/mol;F为法拉第常数,96 485 C/mol;b为1 mol O2获得的电子摩尔数,4 mol;V为溶液体积,L;ΔCOD为COD去除量,g/L。
1.4 分析方法
采用重铬酸钾法测定COD[11]210-213;采用4-氨基安替比林分光光度法测定苯酚浓度[11]460-462。采用天津市兰力科化学电子高技术有限公司的LK3200型电化学工作站对MFC阳极进行循环伏安曲线扫描。阳极生物膜作为工作电极,以Pt电极作为对电极,Ag/AgCl作为参比电极。电压扫描范围为-0.6 V至0.6 V,扫描速率为10 mV/s。
2 结果与讨论
2.1 不同苯酚含量下的输出电压曲线
不同苯酚含量下的输出电压曲线见图1。由图1可见:CODB为0时,即当底物为单一葡萄糖时,MFC的运行周期为36 h,最大输出电压为560 mV;随着CODB的增大,MFC的运行周期延长,最大输出电压有所下降;CODB为1 000 mg/L时,即当底物为单一苯酚时,最大输出电压最低,为436 mV,MFC的运行周期为54 h。

图 1 不同苯酚含量下的输出电压曲线CODB/(mg·L-1):— 0; — 200;— 400;— 600;— 80;— 1 000
葡萄糖-苯酚双底物刺激了MFC阳极室中微生物的生长,同时,葡萄糖的降解产物可促进微生物对苯酚的降解,为降解苯酚的酶提供能量[12]。当以苯酚作为单一底物时,MFC输出电压稳定,说明MFC能在无葡萄糖的条件下利用苯酚进行产能。
2.2 苯酚含量对MFC最大功率密度的影响
MFC输出电压达到极大值且稳定运行后,进行稳态放电实验。不同底物的MFC功率密度-电流密度曲线见图2。
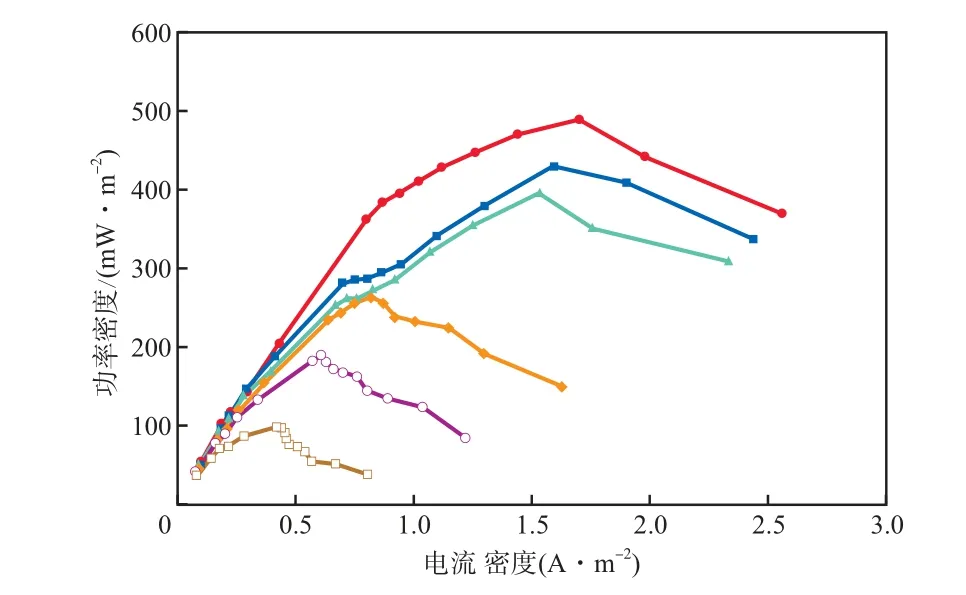
图2 不同底物的MFC功率密度-电流密度曲线CODB/(mg·L-1):0;200;400;600;80;1 000
由图2可见:CODB为0时,MFC的最大功率密度最高,为489 mW/m2;随着CODB的增大,MFC的最大功率密度逐渐下降;当CODB为1 000 mg/L时,MFC的最大功率密度为98 mW/m2。不同底物的MFC电压-电流曲线见图3。

图3 不同底物的MFC电压-电流曲线CODB/(mg·L-1):0;200;400;600;80;1 000
电压-电流曲线的斜率大小代表MFC内阻的大小。由图3可见,随着CODB的增大,MFC的内阻逐渐增大,这和底物的代谢有关。葡萄糖是某些代谢途径的中间产物,可以直接被微生物降解利用;而苯酚是一种高分子物质,经过羧化酶和还原酶作用后,苯环断裂,最终进入厌氧苯甲酸途径被氧化成电子和质子[13],这必然影响MFC阳极室的电子传递,导致内阻增大。
本实验以苯酚作为单一底物时,MFC的最大功率密度高于Luo等[14]和Friman等[7]的实验结果。这是因为,本实验装置为无质子交换膜的单室反应器,其内阻小于双室反应器;此外,本实验中接种的菌株不是直接取自污水处理厂的污泥,而是在实验室中长期厌氧驯化的污泥,产电菌株的浓度相对较高。加入葡萄糖作为底物有利于提高MFC的产电性能[15]。
2.3 苯酚含量对底物去除率和CE的影响
苯酚含量对底物去除率和CE的影响见表1。由表1可见,在葡萄糖-苯酚双底物或苯酚单一底物的MFC中,苯酚去除率在85%以上,这表明苯酚能在MFC中被高效降解。由表1还可见,COD去除率低于苯酚去除率,进一步说明微生物并不是直接利用苯酚作为底物,而是先将苯酚降解成小分子后才进行利用。
CE表征了回收的电子与有机物能提供的电子之比。CE变化可能是由于底物的改变使得微生物的数量和种类有所改变而影响微生物降解底物产生电子的能力。

表1 苯酚含量对底物去除率和CE的影响
由表1可见,当CODB为200 mg/L时,COD去除率、苯酚去除率和CE均达到最大,分别为89.7%、99.9%和 7.2%,然后随着CODB的增大而逐渐减小。这是因为,苯酚含量低时,葡萄糖-苯酚双底物对微生物的活性提高有促进作用;苯酚含量高时,对微生物的活性产生抑制。Uygur等[16]的研究表明,当CODB大于400 mg/L时,废水中N、P元素的去除受到显著影响。徐庆清等[17]的研究表明,CODB为500 mg/L时,抑制微生物的活性;当CODB为700 mg/L时,苯酚降解速率仅为CODB为500 mg/L时的43%。由此可见,不同的运行条件,苯酚对微生物抑制浓度范围也不同。底物降解和产能是MFC运行的主要目标。在本实验中,随着CODB的增加,COD去除率、苯酚去除率及CE均降低,但CODB为200 mg/L和400 mg/L时,COD去除率、苯酚去除率及CE均较接近。在实验中,希望MFC在耐受较高的苯酚含量的同时稳定产能,故本实验适宜的CODB为400 mg/L。
2.4 苯酚含量对MFC的循环伏安曲线的影响
苯酚含量对MFC的循环伏安曲线的影响见图4。由图4可见:CODB为200 mg/L时,MFC的阳极生物膜产生的氧化峰电流最高,表明MFC的阳极生物膜氧化性最强;当CODB为1 000 mg/L时,阳极生物膜产生的氧化峰电流最低。峰电流大小决定了阳极微生物直接氧化苯酚的能力。阳极微生物氧化还原活性与微生物种类、数量、生长状态相关[18]。当CODB为200 mg/L时,葡萄糖-苯酚双底物促进微生物协同作用,氧化活性较高;随着CODB的增大,苯酚的抑制作用导致微生物活性相应降低。

图4 苯酚含量对MFC的循环伏安曲线的影响CODB/(mg·L-1):— 0; — 200;— 400;— 600;— 80;— 1 000
3 结论
a)MFC能够利用葡萄糖、苯酚和葡萄糖-苯酚双底物进行产电。当CODB为0时,即当底物为单一葡萄糖时,MFC的运行周期为36 h,最大输出电压为560 mV;随着CODB的增大,MFC的运行周期延长,最大输出电压有所下降;CODB为1 000 mg/L时,即当底物为单一苯酚时,最大输出电压最低,为436 mV,MFC的运行周期为54 h。
b)CODB为0时,MFC的最大功率密度最高,为489 mW/m2;随着CODB的增大,MFC的最大功率密度逐渐下降;当CODB为1 000 mg/L时,MFC的最大功率密度为98 mW/m2。
c)当CODB为200 mg/L时,COD去除率、苯酚去除率和CE均达到最大,分别为89.7%、99.9%和7.2%;随着CODB的增大,COD去除率、苯酚去除率和CE均逐渐减小。综合考虑本实验适宜的CODB为400 mg/L。
d)CODB为200 mg/L时,MFC的阳极生物膜产生的氧化峰电流最高,表明MFC的阳极生物膜氧化性最强,葡萄糖-苯酚双底物促进微生物协同作用;随着CODB的增大,苯酚的抑制作用导致微生物活性相应降低。
[1] Liu Hong,Ramnarayanan R,Logan B E. Production of Electricity during Wastewater Treatment Using a Single Chamber Microbial Fuel Cell[J]. Environ Sci Technol,2004,38(7):2281 - 2285.
[2] Hosseini M G,Ahadzadeh I. Electrochemiacal Impedance Study on Methyl Orange and Methyl Red as Power Enhancing Electron Mediators in Glucose Fed Microbial Fuel Cell[J]. J Taiwan Institute Cheml Eng,2013, 44(4): 617 - 621.
[3] Liu Hong,Cheng Shaoan,Logan B E. Production of Electricity from Acetate or Butyrate Using a Single-Chamber Microbial Fuel Cell[J]. Environ Sci Technol, 2005,39(2):658 - 662.
[4] Wang Haiping,Jiang S C,Wang Yun,et al. Substrate Removal and Electricity Generation in a Membrane-Less Microbial Fuel Cell for Biological Treatment of Wastewater[J]. Bioresour Technol,2013,138:109 - 116.
[5] Yu Jaecheul,Seon Jiyun,Park Younghyun. Electricity Generation and Microbial Community in a Submerged-Exchangeable Microbial Fuel Cell System for Low-Strength Domestic Wastewter Treatment[J]. Bioresour Technol,2012,117:172 - 179.
[6] Huang Deyin,Zhou Shungui,Chen Qing,et al. Enhanced Anaerobic Degradation of Organic Pollutants in a Soil Microbial Fuel Cell[J]. Chem Eng J,2011,172 (2):647 - 653.
[7] Friman H,Schechter A,Ioffe Y,et al. Current Production in a Microbial Fuel Cell Using a Pure Culture ofCupriavidus Basilensis Growing in Acetate or Phenol as a Carbon Source[J]. Microbial Biotechnol, 2013, 6 (4): 425-434.
[8] 蒋胜韬,管玉江,白书立,等. 以苯酚为燃料的微生物燃料电池产电性能研究[J]. 环境污染与防治,2013,35(5):19 - 23.
[9] Song Tianshun,Wu Xiayuan,Zhou Charles C. Effect of Different Acclimation Methods on the Performance of Microbial Fuel Cells Using Phenol as Substrate[J]. Bioprocess Biosystems Eng,2014,37(2):133 - 138.
[10] Lovley D R,Phillips E J P. Novel Mode of Microbial Energy Metabolism:Organic Carbon Oxidation Coupled to Dissimilatory Reduction of Iron or Manganese[J]. Appl Environ Microbiol,1988,54(6):1472 - 1480.
[11] 原国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002.
[12] 郁丹,阮文权,邹华,等. 厌氧生物法处理苯酚废水[J]. 食品与生物技术学报,2007,26(5):84 -87.
[13] Lack A,Fuchs G. Evidence that Phenol Phosphorylation to Phenylphosphate is the First Step in Anaerobic Phenol Metabolism in a Denitrifying Pseudomonas sp.[J]. Archives Microbiol,1994,161(2):132 -139.
[14] Luo Haipig,Liu Guangli,Zhang Renduo,et al. Phenol Degradation in Microbial Fuel Cells[J]. Chem Eng J,2009,147(2):259 - 264.
[15] 丁巍巍,汪家权,吕剑,等. 微生物燃料电池处理苯酚废水[J]. 合肥工业大学学报:自然科学版,2010,33(1):94 - 96.
[16] Uygur A,Kargi F. Phenol Inhibition of Biological Nutrient Removal in a Four-Step Sequencing Batch Reactor[J]. Process Biochem,2004,39(12):2123 -2128.
[17] 许庆清,周作明. 微生物降解苯酚废水的特性研究[J]. 环境科学与管理,2006,31(4):136 - 138.
[18] Harnisch F,Freguia S. A Basic Tutorial on Cyclic Voltammetry for the Investigation of Electroactive Microbial Biofi lms[J]. Chem Asian J,2012,7(3): 466 -475.
(编辑 祖国红)
Phenol Degradation and Electricity Generation in Microbial Fuel Cell
Chen Liuliu1,Xu Yuan1,Yang Qian1,Chen Yingwen1,Zhu Shemin2,Shen Shubao1
(1. College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing Jiangsu 210009,China;2. College of Material Science and Engineering,Nanjing Tech University,Nanjing Jiangsu 210009,China)
An air-cathode singer chamber microbial fuel cell(MFC)was constructed and fed with phenol and glucose as substrates. The effects of phenol concentration on electricity generation performance and phenol removal rate were investigated. The experimental results show that:when the CODB(COD contributed by phenol) is 0,the MFC operation cycle is 36 h,the maximum output voltage is 560 mV and the maximum power density is 489 mW/m2;When the CODBis 1 000 mg/L,the MFC operation cycle is 54 h,the maximum output voltage is 436 mV and the maximum power density is 98 mW/m2;When the CODBis 200 mg/L,the maximum COD removal rate,phenol removal rate and the coulombic effi ciency(CE)are 89.7%,99.9% and 7.2% respectively,and the oxidation peak current is the highest,which indicates that with the synergistic effect of glucose-phenol co-substrate on microorganism,the oxidation capacity of the biofi lm on the MFC anode is the strongest;The COD removal rate,phenol removal rate and the CE are decreased with the increasing of CODB,which indicates that the inhibition of phenol results in the reduce of microbial activity.
microbial fuel cell;phenol;glucose;substrate;electricity generation performance;anode; biofi lm
TM911.45
A
1006 - 1878(2015)01 - 0001 - 05
2014 - 07 - 11;
2014 - 09 - 22。
陈柳柳(1990—),女,湖南省湘乡市人,硕士生,电话 15195998277,电邮 yayaliuliuchen@163.com。联系人:陈英文,电话 025 - 58139922,电邮 ywchen@njtech.edu.cn。
国家自然科学基金资助项目(51172107;21106072);国家科技支撑计划项目(2012BAE01B03-3);教育部博士点基金项目(20113221110004)。
