1,4-环己烷二甲酸催化加氢制备1,4-环己烷二甲醇的热力学分析
2015-06-06朱庆才畅延青
朱庆才,畅延青
(中国石化 上海石油化工研究院,上海 201208)
1,4-环己烷二甲酸催化加氢制备1,4-环己烷二甲醇的热力学分析
朱庆才,畅延青
(中国石化 上海石油化工研究院,上海 201208)
采用Constantinou-Gani基团贡献法和Rozicka-Domalski基团贡献法计算了1,4-环己烷二甲酸(CHDA)加氢制备1,4-环己烷二甲醇(CHDM)过程中涉及的主副产物的标准摩尔生成焓、标准摩尔蒸发焓和摩尔定压热容;分别计算了CHDA加氢反应体系中各反应的焓变、Gibbs自由能变和平衡常数。计算结果表明,在373.15~573.15 K内,CHDA加氢体系中的各反应均为放热反应,主反应为可逆反应,副反应为不可逆反应。计算了不同反应温度和氢分压下CHDA加氢生成中间产物4-羟甲基-环己烷甲酸(CHMA)及CHMA加氢生成CHDM的平衡转化率。实验结果表明,降低反应温度和提高氢分压均有利于反应物CHDA和中间产物CHMA平衡转化率的提高。
1,4-环己烷二甲酸;1,4-环己烷二甲醇;基团贡献法;加氢;热力学
1,4-环己烷二甲醇(CHDM)是工业上生产饱和聚酯树脂和不饱和聚酯树脂的重要原料,具有优良的特性。以CHDM为原料合成的饱和聚酯可制成高性能的釉料及涂料用的增塑剂,合成的不饱和聚酯可用作胶质涂料、层压和注塑树脂。CHDM最重要的应用是制备线型聚酯纤维,由该原料制成的纤维相对密度小、熔点高和电性能好,特别适用于制作电器设备[1]。
美国、前苏联在20世纪50年代开始开展CHDM的制备及其应用研究,美国伊斯曼公司在1959年实现了CHDM的商品化,也是目前全球实现CHDM商品化生产的主要企业[2-3]。日本近十年大力开展CHDM的生产及其应用研究,致力于新型催化剂的研究,降低反应压力,现已拥有了属于自己的专利技术[4-10],但这些专利多为实验研究,极少涉及工业化问题。在目前的工业生产中,CHDM主要采用对苯二甲酸(TA)二甲酯两步加氢制得。但随着技术的进步,以TA为原料制备CHDM正逐渐成为一种技术趋势,因为无论从原料成本考虑,还是从操作环境、操作成本、毒性和安全性考虑,用TA制备CHDM具有很大优势。以TA为原料的相关报道以两步加氢法居多[11],即TA先经苯环骨架加氢生成1,4-环己烷二甲酸(CHDA),然后CHDA经羧基加氢生成CHDM,其中,第二步反应是整个反应的关键步骤。因此,很多研究者都侧重第二步反应的研究[12-13],该反应中除涉及反应物CHDA和产物CHDM外,还有中间产物4-羟甲基-环己烷甲酸(CHMA)和酯类物质,以及副产物环己烷甲醇(CHM)和4-甲基环己烷甲醇(MCHM)。由此可知,CHDA加氢制备CHDM是一个非常复杂的反应,除催化剂外,还必须对反应的工艺条件进行严格控制,才能提高CHDM的选择性和收率,而热力学分析可为该反应操作条件的选择及反应装置的设计提供重要参考,但有关该反应中大部分物质的热力学基础数据还很缺乏。
本工作采用Constantinou-Gani基团贡献法和Rozicka-Domalski基团贡献法对CHDA加氢制备CHDM体系中可能发生的主副产物进行了热力学数据估算。在此基础上,计算了该反应体系中各反应的焓变、Gibbs自由能和平衡常数随反应温度变化的规律,从而为该体系反应条件的优化和应用提供理论依据。
1 反应体系热力学数据的计算
Yoshinori等[13]根据反应产物的分布情况,提出了CHDA加氢的反应途径(如图1所示)。CHDA加氢制备CHDM过程中涉及的主要反应见表1。

图1 CHDA加氢的反应途径Fig.1 Reaction paths of the CHDA hydrogenation.CHDA:1,4-cyclohexanedicarboxylic acid;CHMA:1,4-cyclohexane-hydroxymethyl carboxylic acid;CHDM:1,4-cyclohexanedimethanol;Esters:1,4-cyclohexanedicarboxylic acid-1,4-cyclohexanedimethanol ester;CHM:hydroxymethyl cyclohexane;MCHM:1,4-hydroxymethyl methylcyclohexane.

表1 CHDA加氢制备CHDM过程中涉及的反应Table 1 Reactions concerned in the hydrogenation of CHDA to CHDM
在该反应体系中,除H2,H2O,CO2的热力学参数可通过查阅文献[14]得到外,其他物质的热力学基础数据均需采用基团贡献法进行估算。另外,考虑到中间产物酯类物质的分子结构太复杂,不利于基团贡献法的计算,同时该物质对目标产物CHDM的影响不大,故本实验未对其进行计算。
1.1 298.15 K下气态化合物生成焓的估算
Constantinous和Gani于1994年提出了一种计算标准摩尔生成焓(ΔfHmΘ)的新方法(简称C-G法)[15],该方法把基团贡献法分为第一级和第二级,第二级可认为是邻近基团的影响,计算式见式(1)。

式中,Δ H1和Δ H2分别为第一级和第二级的基团值,kJ/mol;n1和n2分别为第一级和第二级的基团个数。该方法的数据源主要来自DIPPR系统,用373个数据点考核本方法,平均绝对误差为3.71 kJ/mol。
采用C-G法可得到表1中各化合物在气体状态下的标准摩尔生成焓(ΔfHmΘ(g)),计算结果见表2。
表2 各化合物的估算值Table 2 Standard molar enthalpies of formationfor the compounds under gaseous state
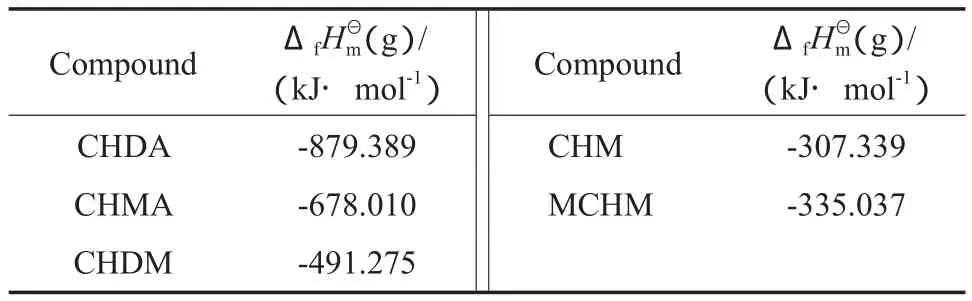
表2 各化合物的估算值Table 2 Standard molar enthalpies of formationfor the compounds under gaseous state
Compound ΔfHmΘ(g)/ (kJ·mol-1) Compound ΔfHmΘ(g)/ (kJ·mol-1)CHDA -879.389 CHM -307.339 CHMA -678.010 MCHM -335.037 CHDM -491.275
1.2 298.15 K下液态化合物蒸发焓的估算
C-G法除可计算生成焓外,还可计算液态化合物的标准摩尔蒸发焓(ΔvHmΘ),计算式见式(2)[15]。

采用C-G法计算可得到各化合物的ΔvHmΘ,计算结果见表3。
表3 各化合物的估算值Table 3 Standard molar enthalpies of vaporizationfor the compounds
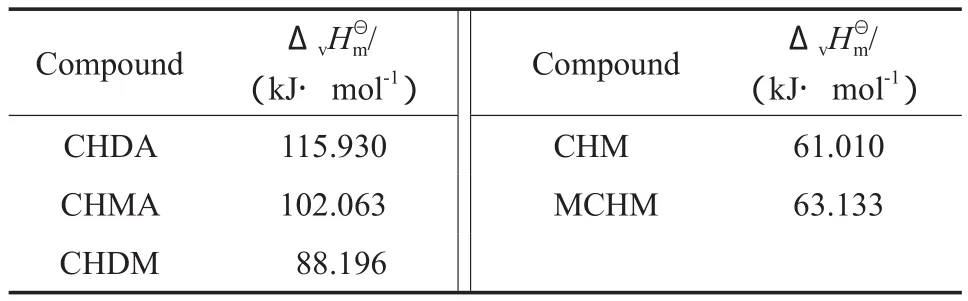
表3 各化合物的估算值Table 3 Standard molar enthalpies of vaporizationfor the compounds
Compound ΔvHmΘ/ (kJ·mol-1) Compound ΔvHmΘ/ (kJ·mol-1)CHDA 115.930 CHM 61.010 CHMA 102.063 MCHM 63.133 CHDM 88.196
1.3 298.15 K下液态化合物生成焓的估算
由于TA加氢反应在液相中进行,故计算反应热力学时需获得各化合物在液态时的标准摩尔生成焓(ΔfHmΘ(1))。与ΔfHmΘ(g)相比,ΔfHmΘ(1)的估算方法既少又差,目前常采用式(3)进行间接计算[15]。
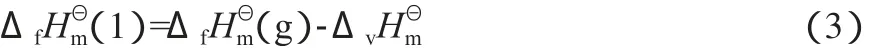
根据式(3)并结合表2和表3中的数据可得到各化合物的ΔfHmΘ(1),计算结果见表4。
表4 各化合物的估算值Table 4 Standard molar enthalpies of formationfor the components under liquid state
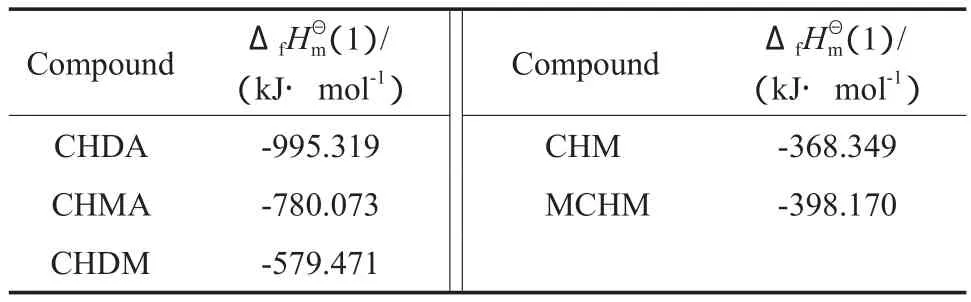
表4 各化合物的估算值Table 4 Standard molar enthalpies of formationfor the components under liquid state
Compound ΔfHmΘ(1)/ (kJ·mol-1) Compound ΔfHmΘ(1)/ (kJ·mol-1)CHDA -995.319 CHM -368.349 CHMA -780.073 MCHM -398.170 CHDM -579.471
1.4 液态化合物的摩尔定压热容及标准摩尔熵的估算
采用Rozicka-Domalski基团贡献法对液态化合物的摩尔定压热容(Cp(l))进行估算,计算式见式(4)[15]。

式中,a,b,c为参数;T为温度,K。

1.5 反应焓变、熵变和Gibbs自由能变
由热力学理论可知,通过计算反应焓变(ΔrHm)、反应熵变(ΔrSm)、Gibbs自由能变(ΔrGm)和摩尔反应热容变化(ΔrCp m)可确定一定条件下反应进行的方向和限度,计算公式见式(6)~(9)[17]。
表5 各化合物的的估算值Table 5 Molar heat capacities at constant pressureand standard entropiesfor the compounds under liquid state
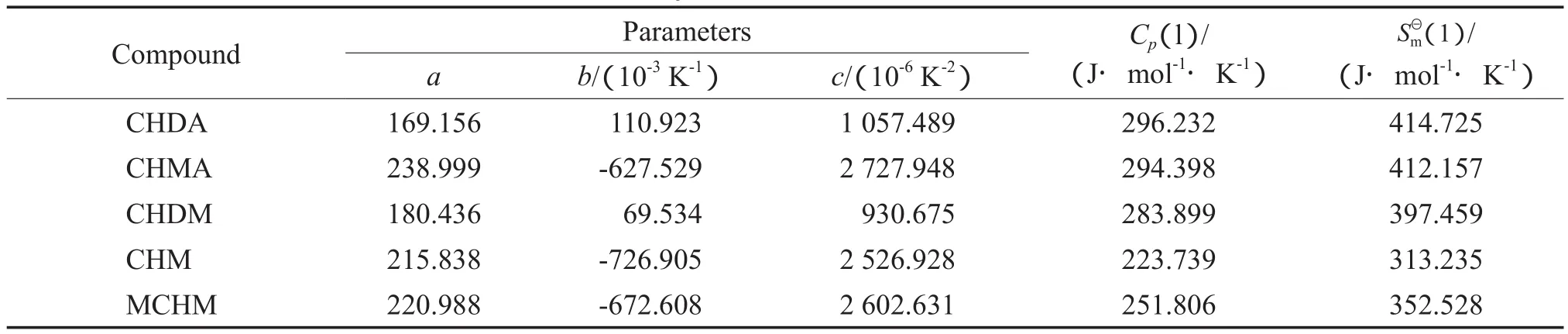
表5 各化合物的的估算值Table 5 Molar heat capacities at constant pressureand standard entropiesfor the compounds under liquid state
Compound Parameters Cp(l)/ (J·mol-1·K-1)SmΘ(1)/ (J·mol-1·K-1)a b/(10-3K-1) c/(10-6K-2)CHDA 169.156 110.923 1 057.489 296.232 414.725 CHMA 238.999 -627.529 2 727.948 294.398 412.157 CHDM 180.436 69.534 930.675 283.899 397.459 CHM 215.838 -726.905 2 526.928 223.739 313.235 MCHM 220.988 -672.608 2 602.631 251.806 352.528

式中,ΔfHm为摩尔生成焓,kJ/mol;ΔfSm为摩尔生成熵,J/(mol·K);n为反应物或产物相应的计量数。
根据式(6)~(9)及表4和表5中的数据可得到表1中各反应在298.15 K时的标准摩尔反应焓变(ΔrHmΘ)、标准摩尔Gibbs自由能变和ΔrCp m,计算结果见表6。
表6 298.15 K时各反应的Table 6for the reactions at 298.15 K

表6 298.15 K时各反应的Table 6for the reactions at 298.15 K
standard molar reaction enthalpy change;standard molar Gibbs free energy change;reaction heat capacity change at constant pressure;ni:number of i-type groups;ai,bi,ci:parameters of the i-type groups.
Reaction No. ΔrCp m/(J·mol-1·K-1) ΔrHmΘ/(kJ·mol-1) ΔrGmΘ/(kJ·mol-1)∑niai∑nibi/(10-3K-1) ∑nici/(10-6K-2)Ⅰ87.243 -738.452 1 670.459 -70.584 -12.753 Ⅱ-249.963 697.063 -1 797.273 -85.228 -23.780 Ⅲ108.252 -837.828 1 469.439 -52.390 -66.587 Ⅳ133.131 -783.531 1 545.142 -260.341 -174.891
2 结果与讨论
2.1 温度对反应焓变的影响

根据关系式(10),计算得到373.15~573.15 K内CHDA加氢制备CHDM反应体系中各反应的ΔrHm随T的变化情况,计算结果见表7。由表7可见,在反应温度范围内,各反应的ΔrHm均小于0,表明反应为放热反应,且随T的升高,除反应(2)外其他反应的ΔrHm均呈增大趋势,表明随T的升高,反应的放热量减少,只有反应(2)的放热量增加。
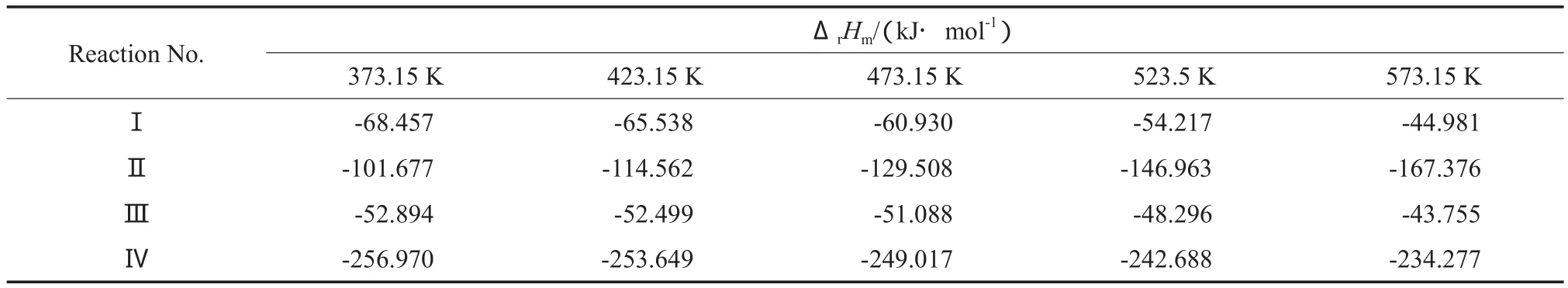
表7 ΔrHm与T的关系Table 7 Relationship between the reaction enthalpy changes(ΔrHm) and reaction temperature(T)
2.2 温度对Gibbs自由能变的影响


根据式(11),计算得到373.15~573.15 K内CHDA加氢制备CHDM反应体系中各反应的ΔrGm随T的变化情况,计算结果见表8。由表8可见,在反应温度范围内,反应Ⅰ的ΔrGm>0,且反应Ⅱ的ΔrGm只有在低温(373.15 K)下才小于零,因此可认为主反应Ⅰ和Ⅱ不会自发进行。随T的升高,主反应Ⅰ和Ⅱ及副反应Ⅳ的ΔrGm增大,表明降低T有利于主反应Ⅰ和Ⅱ及副反应Ⅳ的进行。针对副反应Ⅲ,随T的升高,反应Ⅲ的ΔrGm呈减小趋势,表明升高T有利于反应Ⅲ的进行。
2.3 温度对反应平衡常数的影响
根据ΔrGm=-RTlnK可得到反应平衡常数(K)与T的关系式(12)。

根据式(1 2)及表8中的数据,可得到373.15~573.15 K内CHDA加氢制备CHDM反应体系中各反应的K随T的变化情况,计算结果见表9。
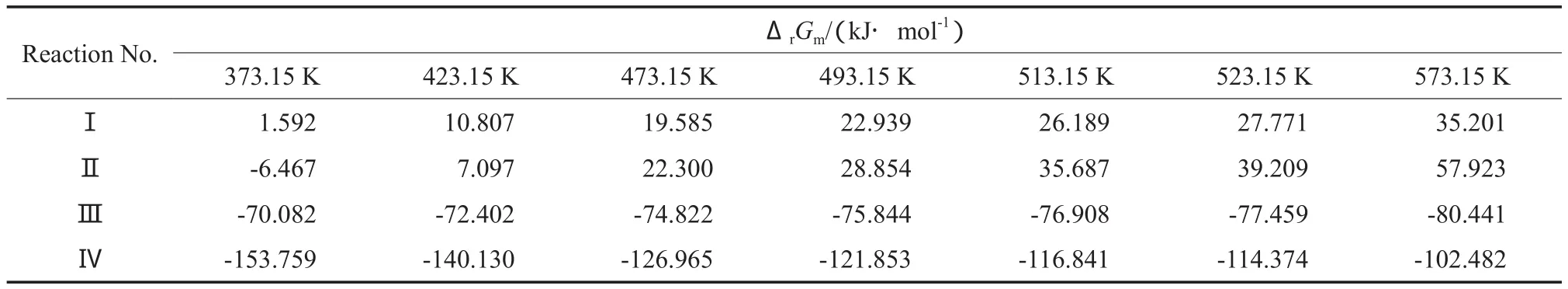
表8 ΔrGm与T的关系Table 8 Relationship between the Gibbs free energy changes(ΔrGm) and T

表9 K与T的关系Table 9 Relationship between the equilibrium constants(K) and T
K的大小可表示反应进行的程度,一般认为K>105时反应进行得较完全(即为不可逆反应);K<10-5时反应很难进行(即不反应)。由表9可知,副反应Ⅲ和Ⅳ为不可逆反应,主反应Ⅰ和Ⅱ为可逆反应,而对于可逆反应xA+yBpC+qD,在一定T下达到化学平衡时,其K值可用式(13)表示。

对于主反应Ⅰ和Ⅱ的K可分别写成K1=由此可计算不同T和氢分压(pH2)下,CHDA和CHMA的平衡转化率,计算结果见图2和图3。
由图2和图3可见,低温(423.15 K)下只需5 MPa左右的pH2就可使CHDA和CHMA的平衡转化率达到99%,这是十分有利的,但对催化剂的要求相对较高。随T的升高,欲获得相同的平衡转化率,则需提供几倍甚至几十倍的pH2。如在513.15 K下,要使CHDA的平衡转化率达到95%以上,则需要提供10 MPa的pH2;若要使CHMA的平衡转化率也达到95%以上,则pH2需达到30 MPa,如此高的pH2,不仅增加了工业操作的难度和危险性,且增加了设备投资的费用。在这种情况下,可适当降低平衡转化率,如将CHMA的平衡转化率降至85%,则pH2只需15 MPa即可。因此,在工业实际操作过程中须权衡利弊,不能盲目地追求高平衡转化率。
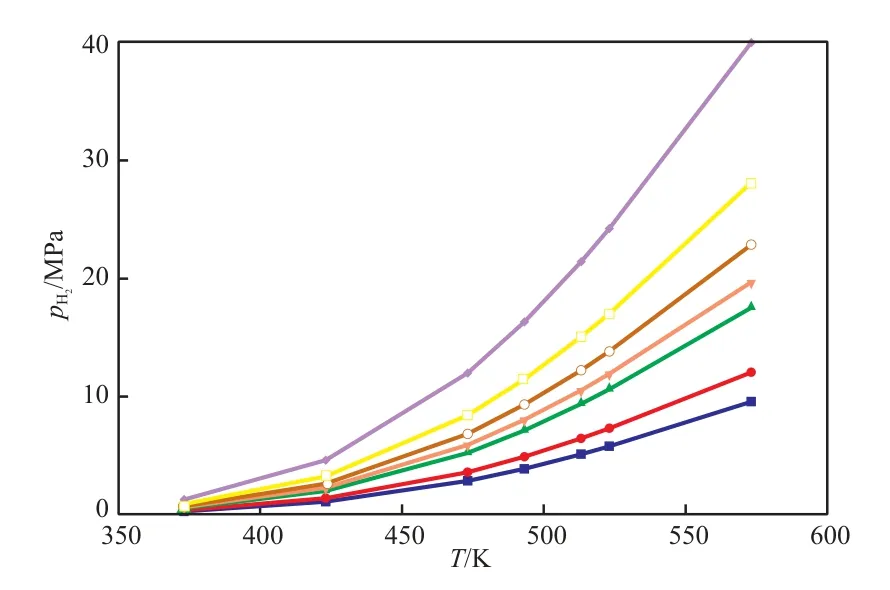
图2 不同T和pH2下CHDA的平衡转化率Fig.2 Equilibrium conversion of CHDA under various T and H2pressure(pH2).Equilibrium conversion/%:85;90;95;96;97;□ 98;99
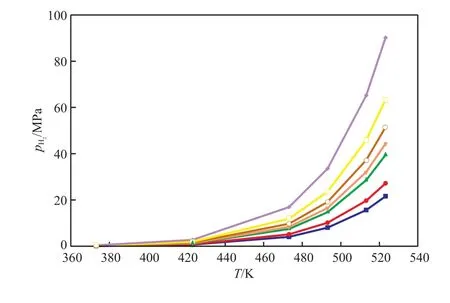
图3 不同T和pH2下CHMA的平衡转化率Fig.3 Equilibrium conversion of CHMA under various T and pH2.Equilibrium conversion/%:85;90;95;96;97;98;99
3 结论
1)采用C-G法和Rozicka-Domalski基团贡献法对CHDA加氢制备CHDM反应体系中的热力学数据进行估算,得到了该反应体系的ΔrHm,ΔrGm,K。
2)CHDA加氢体系中,所有反应均为放热反应,且随T的升高,只有CHMA加氢生成CHDM反应的放热量增加,其他反应的放热量均降低。
3)主反应CHDA加氢和CHMA加氢反应为可逆反应,降低T有利于CHDA和CHMA平衡转化率的提高;在同一平衡转化率下,T的略微升高将导致所需pH2急剧升高,故在实际工业操作中须权衡利弊,不能盲目地追求高平衡转化率。
符 号 说 明
a,b,c 参数
Cp定压比热容,J/(mol·K)
ΔrGpm摩尔反应热容变化,J/(mol·K)
cΘ标准浓度,1 mol/L
ΔrGmGibbs自由能变,kJ/mol
g 气态
Δ H1,Δ H2第一级、第二级的基团值,kJ/mol ΔfHm摩尔生成焓,kJ/mol
l 液态
n 反应物或生成物相应的化学计量数
nii型基团的个数
p 压力,MPa
pΘ 标准压力,kPa
R 气体常数,J/(mol·K),
SmΘ标准摩尔熵,J/(mol·K)
ΔfSm摩尔生成熵,J/(mol·K)
ΔrSm反应熵变,J/(mol·K)
T 温度,K
[1] 石勇,季丛立,赵国勇. 1,4-环己烷二甲醇的展望[J]. 精细化工原料及中间体,2008(5):8 - 9.
[2] Eastman Kodak Company. Plural Stage Hydrogenation of Dialkyl Terephthalate Using Palladium and Then Copper Chromite:US,3334149[P]. 1967 - 08 - 01.
[3] 伊斯特曼化学公司. 环己二甲醇的制备方法:中国,1109859 [P].1995 - 10 - 11.
[4] Mitsubishi Chemical Corporation. Method for Producing Cyclohexane Dicarboxylic Acid:JP,2002020346[P]. 2002 - 01 -23.
[5] Towa Chemical Industry Co. Ltd. Process for Preparing 1,4-Cyclohexanedicarboxylic Acid:US,5430184[P].1995 -07 - 04.
[6] Showa Denko KK. Noble Metal Raney Catalysts and Preparation of Hydrogenation Compounds Using Such Catalysts:EP,0724908[P]. 1996 - 07 - 08.
[7] Mitsubishi Chemical Corporation. Method for Hydrogenating Terephthalic Acid:JP,2002145824[P]. 2002 - 02 - 26.
[8] Mitsubishi Chemical Corporation. Method for Hydrogenating Terephthalic Acid:JP,2002145824[P]. 2002 - 05 - 22.
[9] Mitsubishi Chemical Corporation. Process for the Manufacture of Cycloalkydimethanol:US,6294703[P]. 2001 - 09 - 25.
[10] Mitsubishi Chemical Corporation. Production of 1,4-Cyclohexane-Dimethanol:JP,2000007596[P]. 2000 - 01 - 11.
[11] 朱志庆. 对苯二甲酸催化加氢制1,4-环己烷二甲醇的专利技术[J]. 化工进展,2005,24(7):754 - 757.
[12] Zhu Zhiqing,Lu Zihong,Li Bin,et al. Characterization of Bimetallic Ru-Sn Supported Catalysts and Hydrogenation of 1,4-Cyclohexanedicarboxylic Acid[J]. Appl Catal,A,2006,302(2):208 - 214.
[13] Yoshinori Hara,Kouetsu Endou. The Drastic Effect of Platinum on Carbon-Supported Ruthenium-Tin Catalysts Used for Hydrogenation Reactions of Carboxylic Acids[J]. Appl Catal,A,2003,239(1/2):181 - 195.
[14] 马沛生,李永红. 化工热力学[M]. 北京:化学工业出版社,2011:288 - 293.
[15] Poling B E,Prausnitz J M,O’Connell J P. 气液物性估算手册[M]. 赵红玲,王凤坤,陈圣坤,译. 北京:化学工业出版社,2006:45 - 48.
[16] 赵国良,靳长德. 有机物热力学数据的估算[M]. 北京:高等教育出版社,1983:17 - 19.
[17] 胡英. 物理化学[M]. 北京:高等教育出版社,1999:93 -95.
(编辑 李明辉)
Thermodynamic Analysis of Hydrogenation of 1,4-Cyclohexanedicarboxylic Acid to 1,4-Cyclohexanedimethanol
Zhu Qingcai,Chang Yanqing
(SINOPEC Shanghai Research Institute of Petrochemical Technology,Shanghai 201208,China)
Many products,namely 1,4-cyclohexane-hydroxymethyl carboxylic acid(CHMA),hydroxymethyl cyclohexane(CHM),1,4-cyclohexanedimethanol(CHDM) and 1,4-hydroxymethyl methylcyclohexane(MCHM),can form in the hydrogenation of 1,4-cyclohexanedicarboxylic acid;(CHDA) to CHDM. The standard molar enthalpies of formation,standard molar enthalpies of vaporization and molar heat capacities at constant pressure of the products were calculated by Constantinou-Gani group contribution method and Rozicka-Domalski group contribution method. The enthalpy changes,Gibbs free energy changes and equilibrium constants of the reactions in the hydrogenation process were also calculated in the temperature range of 373.15-573.15 K. The results showed that all of the reactions were exothermic. The main reactions (Ⅰ,Ⅱ) were reversible while the side-reactions(Ⅲ,Ⅳ) were irreversible. Moreover,the equilibrium conversions for both the hydrogenation of CHDA to CHMA and the hydrogenation of CHMA to CHDM under different temperature and H2pressure were also calculated. The results showed that low temperature and high H2pressure were benefi cial to increasing the equilibrium conversions of CHDA and CHMA.
1,4-cyclohexanedicarboxylic acidd;1,4-cyclohexanedimethanol;group contribution method;hydrogenation;thermodynamics
1000 - 8144(2015)06 - 0712 - 07
TQ 013.1
A
2014 - 11 - 06;[修改稿日期] 2015 - 03 - 03。
朱庆才(1981—),男,江苏省苏州市人,博士,工程师,电话 13816217656,电邮 xhsj1998@163.com。
