全氟化合物对水生植物的生态效应研究Ⅱ—金鱼藻对水中PFOS的生物富集及生理响应
2015-06-05孔潇潇王铁宇张晓军蒋曌泽周云桥李奇锋孟晶朱朝云
孔潇潇,王铁宇,张晓军,蒋曌泽,周云桥,李奇锋,孟晶,朱朝云
1. 牡丹江师范学院生命科学与技术学院,牡丹江 157012 2. 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 3. 中国科学院大学,北京 100049
全氟化合物对水生植物的生态效应研究Ⅱ—金鱼藻对水中PFOS的生物富集及生理响应
孔潇潇1,2,王铁宇2,*,张晓军1,#,蒋曌泽1,2,周云桥2,3,李奇锋2,3,孟晶2,3,朱朝云2,3
1. 牡丹江师范学院生命科学与技术学院,牡丹江 157012 2. 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 3. 中国科学院大学,北京 100049
为探究全氟化合物对水生植物的生态效应,选择金鱼藻(Ceratophyllum demersum L.)为受试生物,设定5、100、1 000、10 000、50 000、100 000 μg·L-1以及对照共7个PFOS浓度梯度进行水培,分析包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)在内的抗氧化系统酶和细胞色素含量等生理响应特征,并研究金鱼藻对PFOS的生物有效性及富集能力。结果表明:金鱼藻对PFOS的富集量最高可达3 180 mg·kg-1dw,最大富集系数高达40.7倍,可作为PFOS污染水体植物修复的遴选物种。随PFOS浓度升高,SOD活力总体上没有明显变化,但POD活力表现为双重效用,即低浓度促进酶活力积累,而高浓度抑制酶活力积累。CAT活力在低浓度组(0、5、100、1 000 μg·L-1),未表现出明显异常,在高浓度组(10 000、50 000、100 000 μg·L-1),出现先升高后降低的趋势。色素含量也反应较为敏感,低浓度处理后色素含量升高,高浓度处理则导致色素含量先升高后降低,最高浓度处理下一直处于较低水平,可作为评价PFOS污染水体的生理敏感性指标。
全氟化合物;金鱼藻;PFOS生物有效性;抗氧化系统;生态效应
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)及其盐类是一类含氟持久性有机物,具有性质稳定、不易降解等特点,已成为全球性普遍关注的新型污染物,并在全球范围内均有不同程度地有检出[1-4]。鉴于PFOS存在的广泛性和对环境的危害性,2000年12月,3M公司发布了停止生产全氟类有机磺酸盐的公告[5]。2006年12月,欧洲议会和部长理事会联合发布《关于限制全氟辛烷磺酸销售及使用的指令》(2006/122/EC)。2009年5月,《关于持久性有机污染物的斯德哥尔摩公约》将全氟辛烷磺酸及其盐类列入持久性有机污染物(POPs)优控名单[6]。国外PFOS的生产量在2000年以后已明显下降,但我国的生产量却在2002-2006年间呈增加趋势,目前我国每年的PFOS产量在100 t左右。由于PFOS相比其他类POPs具有一定的弱水溶性,因此水体成为PFOS赋存和传输的重要载体。已有研究表明,在世界范围内的海水、地表水和饮用水等都检测到了PFOS的污染。其中,现有数据中污染最严重的是多伦多Etobicoke河,浓度高达2.2 mg·L-1[7],我国黄河、长江、渤海、大辽河、淮河等几大流域,水体、土壤、沉积物中均检出较高水平的PFOS[8-11],香港近海域、珠江三角洲,包括南海以及韩国海域海水中PFOS浓度范围分别为0.09~3.1 ng·L-1,0.02~12 ng·L-1,0. 04~730 ng·L-1[12-13]。
目前,国内外对PFOS的研究主要集中在水环境以及鱼、虾、蟾蜍、海豚、水鸟等动物层面[14-17],对植物的研究也多集中于陆生植物如小麦、莴苣、玉米、胡萝卜、土豆等体内PFOS含量测定[18-23],有关水生植物对PFOS富集和生态效应的研究极为匮乏。金鱼藻是华北水系普遍存在的水生植物优势物种,因此本研究选用该类沉水生植物为对象,通过分析金鱼藻对PFOS的吸收及抗氧化系统反应,研究金鱼藻对PFOS的生物有效性及富集效果,以期为水环境中PFOS生态风险评价及污染水体修复提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
金鱼藻取自沭阳县苏怡花卉园艺场水草培养池塘,首先对金鱼藻进行挑选,选择长势相同,茎粗为(0.8±0.1) mm,长度为(20±1) cm的金鱼藻用于驯养。实验前,金鱼藻在测试温度为(25±2) ℃下的0.1 Hoagland培养液中实验室驯养2周。
1.2 实验仪器与试剂
实验仪器:为高效液相色谱(Agilent 1200型,美国)/质谱(SCIEX 3000型,美国)联用仪(HPLC/MS-MS)、酶标仪(SPECTRAmax190,美国)、紫外可见光分光光度计(UV-1700,日本岛津)、氮吹仪(Organomation,美国)等。
试剂:ENVI-carb(Supelco公司,美国)、Florisi SPE(Supelco公司,美国)、全氟辛烷磺酸盐(98%,Matrix Scientific公司,美国)、同位素标记物为13C4PFOS(98% Wellington实验室,加拿大)、色谱级甲醇、四丁基硫酸氢铵(TBAHS)、甲基叔丁基醚(MTBE)和醋酸钠(J.T.Baker公司,美国)。
1.3 实验处理
根据预实验条件分析和Felizeter等有关PFOS胁迫对水培生菜的已有报道,本研究共设6个实验组和1个空白对照组,并设置为0、5、100、1 000 μg·L-1的低浓度组和10 000、50 000、100 000 μg·L-1的高浓度组,每组设3个平行。在配制好的0.1 Hoagland溶液中加入用去离子水冲洗3次并晾干表面的金鱼藻,密度为8 L的0.1 Hoagland溶液内25棵金鱼藻,置于(28±2) ℃温室内培养,用无菌培养容器封口膜(12 cm×12 cm)将实验容器10 L广口瓶封口。通入洁净的中空玻璃管,内径1 cm,长50 cm。光照14 h:10 h,光强260~350 μmol·m-2·s-1,水深(25±0.5) cm相对湿度60%~70%,每天充气12 h。试验开始前先在样品未分组时随机取样测定每组样品各项指标的初始值,初始值是植物分剪前的状态,可反映植物驯化后的最初生长状况。另外在分剪过程中植物会被从培养液中取出,受光照、温度、湿度等外界因素影响,植物会出现少量失水或人为机械损伤,致使初始值与0处理的0天有差异。因此设定0处理的第0天作为分拣后的初始样品,试验过程中每日记录金鱼藻的表观状况,于每日9时每瓶取出金鱼藻4棵,剪碎后称重并用于其他各项指标测定。
1.4 分析方法
1.4.1 生理生化指标测定前处理
将培养后的金鱼藻小心取出,用去离子水冲洗3次,甲醇冲洗1次,而后用滤纸阴干表面后液氮冷冻,放入研钵加入9倍体积的0.1 PBS缓冲液(pH=7.4),手动冰浴研磨后将匀浆液放入离心管中,在4 ℃、3 500 r·min-1条件下离心10 min,取上清液置于-80 ℃冰箱待测。采用丙酮提取法测定叶绿素含量,氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性,愈创木酚显色法测定过氧化物酶(POD)活性,紫外吸收法测定过氧化氢酶(CAT)活性。
1.4.2 植物体PFOS的提取与净化
用甲醇淋洗20 s后去离子水冲洗3次,在滤纸上阴干用铝箔纸包裹,冷冻干燥后研磨成粉末。称取0.2 g干燥的植物样于50 mL的聚丙烯离心管中,加入5 ng PFOS内标,2 mL氢氧化钠溶液(0.4 mol·L-1),涡旋后置于冰箱过夜。然后依次加入1 mL TBAHS(0.5 mol·L-1)、2 mL碳酸钠-碳酸氢钠缓冲液(0.25 mol·L-1)涡旋,5 mL MTBE,700 r·min-1条件下震动5 min,超声10 min,3 000 r·min-1条件下离心10 min,转移上清液,用5 mL MTBE重复2次,共收集15 mL MTBE,高纯氮气吹至1 mL。取Florisil SPE小柱,用5 mL的甲醇、5 mL的MTBE对其活化。将1 mL样品通过,并用甲醇冲洗聚丙烯离心管3次,用5 mL的MTBE冲洗Florisil SPE柱,用5 mL的甲醇MTBE溶液(30:70,V:V )洗脱小柱并收集。将收集到的到的溶液氮吹至1 mL。最后通过ENVI-Carb小柱净化,首先用1 mL甲醇冲洗ENVI-Carb小柱,重复3次,然后将1 mL的样品通过,用1 mL甲醇冲洗聚丙烯管,冲洗3次,同样甲醇冲洗小柱3次,速度始终控制在1滴每秒,共收集样液10 mL。用高纯氮气吹至1 mL,0.2 μm的尼龙滤膜过滤,分液待上机。
1.5 质量保证与控制
为了最大限度地降低PFOS污染,实验所用器皿均先用自来水洗净,用甲醇冲洗3遍后,再用去离子水冲洗3次。每批样品中加1个方法空白,方法空白不加植物样,但加入相同量的回收率指示物,按与样品相同的步骤进行分析。每个浓度设定0 μg·L-1为对照组,样品分拣前测定植物样品各项指标的初始值。
1.6 数据处理方法
数据处理和图表制作采用Excel 2010,所有结果为3次重复数据的平均值,差异显著性采用SAS 8.0的One-way ANOVA (Ducan法)进行检验,显著性水平为P<0.05。
2 结果与分析(Results and analysis)
2.1 金鱼藻对PFOS的生物富集特征
金鱼藻在水体PFOS胁迫处理后,不同浓度不同时间处理条件下表现出不同的生物富集程度,随溶液PFOS浓度的增高,金鱼藻体内PFOS积累量呈持续增长态势(表1),在初始的第0天金鱼藻体内均检测到PFOS存在,其值为(4.05~7.60 ng·g-1dw,均值5.29 ng·g-1dw)。低浓度PFOS处理(5、100、1 000 μg·L-1)之间没有较大差异,但均显著低于高浓度PFOS处理组(10 000、50 000、100 000 μg·L-1),高浓度组各处理间均存在不同程度的显著性差异(P<0.05)。各植株之间PFOS初始含量均保持在4.05~7.60 μg·kg-1dw范围,并随水培溶液中PFOS浓度的递增而呈增加态势,金鱼藻体内PFOS含量呈直线性增长,无拐点出现(表2)。其中,高浓度组在第4天金鱼藻中PFOS含量降低,叶片出现萎蔫现象。但第5、6天含量又逐步回升。此外,金鱼藻PFOS富集量在培养液浓度为100 000 μg·L-1时的第3天出现最高值(3 180 mg·kg-1dw),富集系数为31.7,在培养液PFOS浓度为50 000 μg·L-1时的第6天富集量为2 040 mg·kg-1dw,富集系数达到最高值(40.74)。可以看出,在PFOS污染水体的植物修复中,金鱼藻具有潜在的应用价值。

表1 不同处理时间下金鱼藻体内PFOS的含量Table 1 PFOS concentrations in Ceratophyllum demersum at different treatments
注:表中数据为3个重复的平均值±标准差;横排不同字母标注(a,b,c,d)为显著差异(P<0.05),低浓度处理(0、5、100、1 000 μg·L-1)金鱼藻体内PFOS含量单位为μg·kg-1(干重),高浓度处理(10 000、50 000、100 000 μg·L-1)单位为mg·kg-1(干重)。Note: values represent mean ± standard deviation of three repeats; letter (a,b,c,d) characterize significant difference (P<0.05); units of PFOS concentrations in low (0, 5, 100, 1 000 μg·L-1) and high (10 000,50 000,100 000 μg·L-1) level treatments were μg·kg-1dw and mg·kg-1dw, respectively.
2.2 PFOS不同处理水体中金鱼藻的生长状况
PFOS对金鱼藻的生理效应随着浓度的增大和时间的延长而加重。加入PFOS的第1天各浓度处理的金鱼藻表观上均未发生明显的急性毒理变化。第2天最高浓度处理开始出现叶片萎蔫现象。第4天,高浓度组中的2个较高浓度处理均出现萎蔫,其中,最高浓度处理开始出现叶片脱落。由表3对比发现,50 000 μg·L-1浓度及以上的PFOS处理下的金鱼藻长势逐渐变弱,并于第4天出现死亡现象。

表2 金鱼藻对水体中PFOS的吸收方程Table 2 Absorption equation of Ceratophyllum demersum intake of PFOS from water
注:R2拟合优度;P值为结果可信程度的一个递减指标;F是回归方程的显著性检验。
Note: R2is coefficient of determination; P value is the credibility of the results; F is the significant test of regression equation.
2.3 PFOS不同处理水体中金鱼藻的色素变化
不同浓度PFOS处理对金鱼藻体内色素的影响如图1所示。整体来看,金鱼藻体内色素含量随着PFOS浓度的升高,呈现先降低、后升高、而后又降低的趋势,初始阶段PFOS对金鱼藻起到一定刺激作用,但随天数递增,低浓度胁迫下金鱼藻体内色素含量逐步升高。当PFOS浓度为100 000 μg·L-1时,金鱼藻体内色素含量降低后没有发生明显抬升,基本低于初始值,说明高浓度的PFOS能够在一定程度上抑制金鱼藻体内色素的形成。但在10 000、50 000 μg·L-1浓度处理下,总色素含量呈先升高后降低趋势,并在第4天达到最高值。此时,金鱼藻体内的PFOS浓度也达到最高值,部分植株在表观上出现萎蔫现象。在PFOS浓度为10 000 μg·L-1时,金鱼藻体内色素总量高于其他处理。
2.4 PFOS不同处理水体中金鱼藻的酶活性变化
不同浓度处理下,PFOS胁迫对金鱼藻SOD活性的影响如图2所示。可以看出,SOD的活性随PFOS浓度递增总体变化不大。但在PFOS处理浓度低于10 000 μg·L-1时,SOD活性呈先升高后降低的趋势,当浓度高于10 000 μg·L-1后,SOD活力整体无明显趋势,且均低于初始值,这与金鱼藻体内PFOS的富集呈现相同趋势。高浓度组在第4天时,金鱼藻体内SOD活力最低,此时,金鱼藻体内的总色素含量也达到最大值,这与低浓度处理下总色素量随浓度升高而增加趋势基本一致。
不同浓度处理下,PFOS胁迫对金鱼藻CAT活性的影响整体变化不大(图3),但在PFOS浓度为10 000 μg·L-1时,CAT活力随培养天数的变化有所升高,在最高浓度处理条件下(100 000 μg·L-1)CAT活力呈现先升高后降低的趋势,并在实验第3天达最高值,第6天达最低值。

表3 不同浓度PFOS处理下第6天的植物生长状况Table 3 Plant growth after six days exposure to different concentrations of PFOS
注:5、100、1 000 μg·L-1为低浓度处理组,10 000、50 000、100 000 μg·L-1为高浓度处理组。
Note: 5, 100, 1 000 μg·L-1are low concentration treatments; 10 000, 50 000, 100 000 μg·L-1are high concentration treatments.

图1 不同浓度PFOS处理下金鱼藻体内色素含量Fig. 1 Pigment content in Ceratophyllum demersum after exposure to different PFOS concentrations
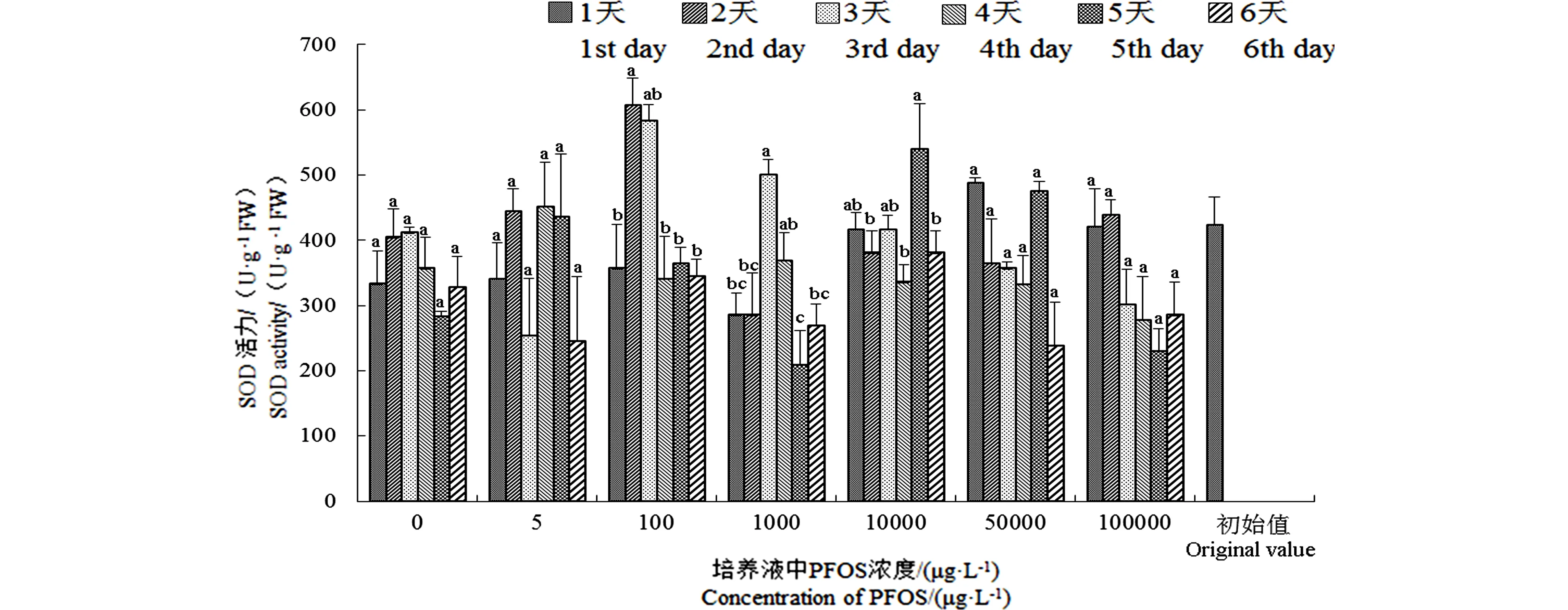
图2 不同浓度PFOS处理下金鱼藻SOD活力变化Fig. 2 SOD activities of Ceratophyllum demersum after exposure to different PFOS concentrations

图3 不同浓度PFOS处理下金鱼藻CAT活力变化Fig. 3 CAT activities of Ceratophyllum demersum after exposure to different PFOS concentrations

图4 不同浓度PFOS处理下金鱼藻POD活力变化Fig. 4 POD activities of Ceratophyllum demersum after exposure to different PFOS concentrations
POD活性随PFOS浓度的升高并没有显著性变化,但不同处理时间呈波动性变化(图4)。整体上,处理第2天时POD有所升高,但在处理后的第3、4、5天,金鱼藻体内POD活力降低,并在第4天降至最低值,这与金鱼藻对PFOS的富集、色素含量和SOD活力的变化趋势基本一致。在PFOS浓度低于10 000 μg·L-1时,POD活力随时间变化逐步升高,当PFOS浓度高于10 000 μg·L-1时,POD活力呈明显下降趋势。表明在低浓度PFOS处理下,短时间内对金鱼藻并未有显著的生理抑制效应。
3 讨论(Discussion)
随PFOS浓度增高,金鱼藻体内PFOS累积量呈线性增长趋势,说明影响植物吸收和富集PFOS的主要因素是生长介质内PFOS的浓度。金鱼藻在初始的第0天检测到PFOS(4.05~7.60 μg·kg-1dw均值为5.29 μg·kg-1dw),可能因为金鱼藻初期生长阶段是在环境中由自然水体养殖,自然水体中已存在少量的PFOS。实验中高浓度组在第4天含量均降低,叶片萎蔫,生长受到抑制,植物生长减慢,新陈代谢水平下降。但第5、6天含量又有所升高,应是因为植物死亡,其吸收方式由原来的主动吸收变为被动吸收,从而导致PFOS在体内大量聚集,这与水生植物芦苇、菖蒲和水葱对水体中Cd富集结果极为相似[24]。Felizeter等[19]研究PFOS胁迫对水培生菜的富集态势时也呈直线增长,且根部富集量高于叶片,根部和叶子富集系数分别达25和3.2。本研究发现当PFOS浓度达100 000 μg·L-1时,金鱼藻对PFOS的富集量在第3天达最高值(3 180 mg·kg-1),富集系数为31.7,当PFOS浓度为50 000 μg·L-1时,金鱼藻对PFOS的富集量在第6天达最大值(2 040 mg·kg-1),富集系数高达40.7,说明水培生菜和金鱼藻对PFOS表现为相似的吸收规律。潘义宏等[25],研究发现金鱼藻对重金属有更高的生物有效性,其中As、Zn、Cu、Cd、Pb的富集系数分别达到887、759、148、1 094、58。水生植物对环境中污染物的去除普遍优于陆生植物,而且金鱼藻对PFOS也有较强的耐受性,当浓度达10 000 μg·L-1浓度时,才开始出现生理抑制。因此,在PFOS水体污染的植物修复中,金鱼藻具有潜在的应用价值。
SOD、CAT和POD被认为是抵抗过氧化反应的关键酶,其活性直接影响活性氧(ROS)的生成和代谢,高活性抗氧化酶有利于提高植物对各种生物及非生物胁迫的耐受性[26]。SOD作为清除活性氧的防御酶,其活性升高通常反映逆境胁迫下植物体内活性氧自由基增多,膜脂过氧化加剧[27]。本研究中SOD活性随PFOS浓度变化总体变化不大,说明SOD对PFOS的刺激响应并不明显,但仍出现了双重效应,即PFOS浓度低于10 000 μg·L-1时,SOD未出现明显规律,PFOS浓度高于10 000 μg·L-1时,SOD活性变化不大,但在最高浓度处理时100 000 μg·L-1均低于初始值,这与Hanson等[28]对PFOS毒性研究中发现PFOS对狐尾藻的最大无影响浓度为11.4 mg·L-1出现相似的结果。高浓度短期胁迫下之所以会受到抑制,是因为高浓度PFOS处理下胁迫强度的增强可能超过了分子防御系统负荷,部分酶活、色素含量显著降低,甚至出现金鱼藻死亡的现象[29]。在氧化胁迫时,植物体内会产生ROS,SOD能够将ROS转化成H2O2,而H2O2的清除需要POD和CAT的参与[30]。本研究中POD随PFOS浓度递增呈波动式变化,可能是毒物兴奋作用、抗氧化防御与酶蛋白破坏的平衡作用以及高浓度酶蛋白破坏共同作用的结果,这一结果与张蕾等[31]关于麝香酮和镉单一与复合污染对金鱼藻生态毒理作用结果一致。而且POD与SOD在高浓度处理下,均在第4天出现最低值,金鱼藻出现萎蔫死亡现象,证明此时为金鱼藻对PFOS吸收方式由主动变为被动的一个转折点。
叶绿素含量可反映植物生长发育是否受到污染物的损害,有研究表明,叶绿体是氟化物积累的主要场所[32]。类胡罗卜素也可作为光保护剂抵抗光、氧和光敏色素的有害作用,抵抗细胞产生的化学物质引起的氧化损伤。本研究中金鱼藻体内色素随PFOS浓度变化有先降低后升高再降低的趋势,即短时间内PFOS对金鱼藻起到一定的刺激作用,但随实验天数递增,低浓度PFOS处理使金鱼藻体内色素含量升高。高浓度PFOS处理,则使金鱼藻体内色素含量降低,表明植物光合作用对PFOS的生理响应表现为双重效应,即高浓度短期胁迫下光合作用受到抑制,低浓度短期胁迫下光合作用受到促进[33]。此外,PFOS浓度为100 000 μg·L-1,金鱼藻体内色素含量一直处于最低状态,且均低于初始值,说明PFOS对金鱼藻的生长发育存在生理毒性,能够抑制金鱼藻体内色素的形成。类胡罗卜素占总素色的比例在PFOS处理浓度为50 000 μg·L-1时达最大,说明高浓度处理下,金鱼藻体内的色素合成已经受到伤害。整体来看,研究基本证明了金鱼藻对PFOS表现出较强的抗逆特性和较强的生物有效性,对其吸收累积机制以及毒性作用机理尚需从细胞结构、生物特性、吸附条件等方面开展深入研究。
[1] Giesy J P, Kannan K. Global distribution of perfluorooctane sulfonate in wildlife [J]. Environmental Science & Technology, 2001, 35(7): 1339-1342
[2] Kannan K, Tao L, Sinclair E, et al. Perfluorinated compounds in aquatic organisms at various trophic levels in a great lakes food chain [J]. Archives of Environmental Contamination and Toxicology, 2005, 48(4): 559-566
[3] Yeung L W Y, Miyake Y, Sachi T, et al. Perfluorinated compounds and total and extractable organic fluorine in human blood samples from China [J]. Environmental Science & Technology, 2008, 42(21): 8140-8145
[4] Naile J E, Khim J S, Hong S J, et al. Distributions and bioconcentration characteristics of perfluorinated compounds in environmental samples collected from the west coast of Korea [J]. Chemosphere, 2013, 90(2): 387-394
[5] Tomy G T, Tittlemier S A, Palace V P, et al. Biotransformation of N-ethyl perfluorooctane sulfonamide by rainbow trout (Onchorhynchus mykiss) liver microsomes[J]. Environmental Science & Technology, 2004, 38(3):758-762
[6] Wang T, Wang Y, Liao C, et al. Perspectives on the inclusion of perfluorooctane sulfonate into the Stockholm Convention on persistent organic pollutants[J]. Environmental Science & Technology, 2009, 43(14):5171-5175
[7] Moody C A, Martin J W, Kwan W C, et al. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into etobicoke creek[J]. Environmental Science &Technology, 2002, 36(4): 545-551
[8] So M K, Miyake Y, Yeung W Y, et al. Perfluorinated compounds in the Pearl River and Yangtze River of China [J]. Chemosphere, 2007, 68(11): 2085-2095
[9] Wang T Y, Lu Y L, Chen C L, et al. Perfluorinated compounds in estuarine and coastal areas of North Bohai Sea, China[J]. Marine Pollution Bulletin, 2011, 62(8):1905-1914
[10] Bao J, Jin Y H, Liu W, et al. Perfluorinated compounds in sediments from the Daliao River system of Northeast China [J]. Chemosphere, 2009, 77(5): 652-657
[11] Meng J, Wang T Y, Wang P, et al. Perfluoroalkyl substances and organochlorine pesticides in sediments from Huaihe Watershed in China[J]. Journal of Environmental Sciences, 2014, 26(11): 2198-2206
[12] Boulanger B, Vargo J, Schnoor J L, et al. Detection of perfluorooctane surfactants in great lakes water [J]. Environmental Science & Technology, 2004, 38(15): 4064-4070
[13] Naile J E, Khim J S, Wang T Y, et al. Perfluorinated compounds in water, sediment, soil and biota from estuarine and coastal areas of Korea[J]. Environmental Pollution, 2010, 158(5): 1237-1244
[14] 苏红巧, 任东凯, 曹闪, 等. 全氟辛烷磺酸盐(PFOS)及其替代品对两栖类蝌蚪的急性毒性[J]. 生态毒理学报, 2012, 7(5): 521-524
Su H, Ren D, Cao S, et al. Acute toxicity of perfluorooctane sulfonate (PFOS) and its substitutes to amphibian tadpoles[J].Asian Journal of Ecotoxicology, 2012, 7(5): 521-524 (in Chinese)
[15] Kannan K, Hansen K J, Wade T L, et al. Perfluorooctane sulfonate in oysters, crassostrea virginica, from the Gulf of Mexico and the Chesapeake Bay, USA[J]. Archives of Environmental Contamination and Toxicology, 2002, 42(3): 313-318
[16] Kowalczyk J, Ehlers S, Furst P, et al. Transfer of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) from contaminated feed into milk and meat of sheep: Pilot study[J]. Archives of Environmental Contamination and Toxicology, 2012, 63(2): 288-298
[17] Chinje E, Kentish P, Jarnot B, et al. Induction of the cyp4a subfamily by perfluorodecanoic acid: The rat and the guinea pig as susceptible and non-susceptible species[J]. Toxicology Letters, 1994, 71(1): 69-75
[18] Zhao H, Guan Y, Zhang G, et al. Uptake of perfluorooctane sulfonate (PFOS) by wheat (Triticum aestivum L.) plant [J]. Chemosphere, 2013, 91(2): 139-144
[19] Felizeter S, McLachlan M S, de Voogt P. Uptake of perfluorinated alkyl acids by hydroponically grown lettuce (Lactuca sativa)[J]. Environmental Science & Technology, 2012, 46(21): 11735-11743
[20] Krippner J, Brunn H, Falk S, et al. Effects of chain length and pH on the uptake and distribution of perfluoroalkyl substances in maize (Zea mays) [J]. Chemosphere, 2014, 94: 85-90
[21] Lechner M, Knapp H. Carryover of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) from soil to plant and distribution to the different plant compartments studied in cultures of carrots (Daucus carota ssp. Sativus), potatoes (Solanum tuberosum), and cucumbers (Cucumis sativus)[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11011-11018
[22] Zhao H, Guan Y, Zhang G, et al. Uptake of perfluorooctane sulfonate (PFOS) by wheat [J]. Chemosphere, 2013, 91(2): 139-144
[23] 吕振娥, 苏玉红, 乔敏. 全氟辛烷磺酸短期暴露对不同作物苗期生长的影响[J]. 生态毒理学报, 2013, 8(5): 695-701
Lv Z, Su Y, Qiao M. Influence of short-term exposure of PFOS on seedling growth of different plants [J]. Asian Journal of Ecotoxicology,2013,8(5): 695-701 (in Chinese)
[24] 任珺, 陶玲, 杨倩, 等. 芦苇、菖蒲和水葱对水体中Cd富集能力的研究[J]. 农业环境科学学报, 2010, 29(9): 1757-1762
Ren J, Tao L, Yang Q, et al. Accumulation ability of Cd in water for Phragmites australis, Acorus calamus and Scirpus tabernaemontani [J]. Journal of Agro-Environment Science, 2010, 29(9): 1757-1762 (in Chinese)
[25] 潘义宏, 王宏镔, 谷兆萍, 等. 大型水生植物对重金属的富集与转移[J]. 生态学报, 2010, 30(23): 6430-6441
Pan Y, Wang H, Gu Z, et al. Accumulation and translocation of heavy metals by macrophytes[J]. Acta Ecologica Sinica, 2010, 30(23): 6430-6441 (in Chinese)
[26] 张蕾, 周启星, 孙福红, 等. 麝香酮和镉单一与复合污染对金鱼藻的生态毒理效应研究[J]. 生态毒理学报, 2009, 4(4): 507-515
Zhang L, Zhou Q, Sun F, et al. Single and joint effects of musk ketone and cadmium on coontail (Ceratophyllum demersum L.) [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 507-515 (in Chinese)
[27] Monk L S, Fagerstedt K V, Crawford R M M. Oxygen-toxicity and superoxide-dismutase as an antioxidant in physiological stress[J]. Physiologia Plantarum, 1989, 76(3): 456-459
[28] Hanson M L, Sibley P K, Brain R A, et al. Microcosm evaluation of the toxicity and risk to aquatic macrophytes from perfluorooctane sulfonic acid [J]. Archives of Environmental Contamination and Toxicology, 2005, 48(3): 329-337
[29] Lichtenthaler H K. Vegetation stress: An introduction to the stress concept in plants[J]. Journal of Plant Physiology, 1996, 148(1-2): 4-14
[30] Borges T, Glauert H P, Robertson L W. Perfluorodecanoic acid noncompetitively inhibits the peroxisomal enzymes enoyl-CoA hydratase and 3-hydroxyacyl-CoA dehydrogenase[J]. Toxicology and Applied Pharmacology, 1993, 118(1): 8-15
[31] 顾晓军, 田素芬. 毒物兴奋效应概念及其生物学意义[J]. 毒理学杂志, 2007(5): 425-428
[32] Zhou Q. Interaction between heavy metals and nitrogen fertilizers applied to soil-vegetable systems [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(2): 338-344
[33] 李砧, 胡涛, 李艳晖, 等. 金鱼藻对水中氟污染物去除作用的研究[J]. 广东农业科学, 2013, 40(18): 165-168
Li Z, Hu T, Li Y, et al. Research on removal effect of fluoride in water by Ceratophyllum demersum [J].Guangdong Agricultural Sciences, 2013, 40(18): 165-168 (in Chinese)
◆
Ecological Effects on Aquatic Plants Induced by Perfluorinated Compounds II—Bioaccumulation and Physiological Response ofCeratophyllumDemersumin PFOS Polluted Water
Kong Xiaoxiao1,2, Wang Tieyu2,*, Zhang Xiaojun1,#, Jiang Zhaoze1,2, Zhou Yunqiao2,3, Li Qifeng2,3, Meng Jing2,3, Zhu Zhaoyun2,3
1. College of Life Sciences and Technology, Mudanjiang Normal University, Mudanjiang 157012, China 2. State Key Lab of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China 3. Graduate University of Chinese Academy of Sciences, Beijing 100049, China
16 January 2015 accepted 21 March 2015
In order to explore the aquatic ecological effects of perfluorooctane sulfonate (PFOS), Ceratophyllum demersum was selected as a target endpoint to analyze its bioavailability and physiological responses. Hydroponic experiments at seven grades of PFOS concentrations (0, 5, 100, 1 000, 10 000, 50 000, 100 000 μg·L-1), were designed to detect the activities of superoxide dismutase (SOD), peroxide enzyme (POD), catalase(CAT), as well as PFOS bioaccumulation. Ceratophyllum demersum showed significant higher bioaccumulation of PFOS with maximum of 3 180 mg·kg-1dw and the bioaccumulation factor up to 40.7. The activitiy of SOD did not show significant changes. POD activity showed two different trends: lower concentrations of PFOS promoted POD activities, while higher concentrations inhibited POD activities. With increasing concentrations of PFOS, CAT did not exhibit significant changes at low concentration treatments (0, 5, 100, 1 000 μg·L-1), while CAT activity showed increasing then decreasing trend at higher concentration treatments (10 000, 50 000, 100 000 μg·L-1). With increasing concentrations of PFOS, the reactions of pigment contents were very sensitive. Pigment contents increased in the treatments of low concentrations, while pigment contents increased and then decreased in the treatments of high concentration. Pigment content of Ceratophyllum demersum could be used as a sensitive indicator to assess environmental contamination induced by PFOS. In general, Ceratophyllum demersum showed higher capacity of PFOS bioavailability and expressed sensitive responses to PFOS pollution, thus, Ceratophyllum demersum could be used for bioremediation and bio-indicator for PFOS contaminated waterbodies.
perfluorinated compounds; Ceratophyllum demersum; PFOS bioavailability; antioxidant system; ecological effects
国家自然科学基金项目(41171394);科技基础性工作专项(2013FY11110);中国科学院重点部署项目(KZZD-EW-TZ-12)
孔潇潇(1989-),女,硕士,研究方向为环境植物学,E-mail: kongxiao0705@126.com;
*通讯作者(Corresponding author), E-mail: wangty@rcees.ac.cn
10.7524/AJE.1673-5897.20150116002
2015-01-16 录用日期:2015-3-21
1673-5897(2015)2-445-09
X171.5
A
王铁宇(1973-),男,博士,研究员,主要研究方向为区域污染生态过程与风险管理。近几年重点关注新型污染物的环境行为、生态效应及其风险管理,已在国内外核心刊物发表论文100余篇(其中SCI收录70余篇)。
# 共同通讯作者(Co-corresponding author), E-mail: swxzxj@126.com
孔潇潇, 王铁宇, 张晓军, 等. 全氟化合物对水生植物的生态效应研究Ⅱ-金鱼藻对水中PFOS的生物富集及生理响应[J]. 生态毒理学报, 2015, 10(2): 445-453
Kong X X, Wang T Y, Zhang X J, et al. Ecological effects on aquatic plants induced by perfluorinated compounds II-Bioaccumulation and physiological response of Ceratophyllum demersum in PFOS polluted water [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 445-453 (in Chinese)
