稀有鮈鲫Ras信号通路相关基因的克隆、序列分析及其组织分布
2015-06-05王妙查金苗王子健
王妙,查金苗,王子健
中国科学院生态环境研究中心环境水质学国家重点实验室,北京 100085
稀有鮈鲫Ras信号通路相关基因的克隆、序列分析及其组织分布
王妙,查金苗*,王子健
中国科学院生态环境研究中心环境水质学国家重点实验室,北京 100085
Ras基因是一类在生物进化过程中较为保守的原癌基因,在多种细胞生命活动中起到细胞增殖、分化和细胞骨架构建等重要作用。本文克隆了稀有鮈鲫Ras信号通路相关的k-ras、n-ras、pik3cd、pin1和raf1基因的部分cDNA片段,并分析了其序列。序列分析结果表明,k-ras的氨基酸序列与鲤鱼相对应的氨基酸序列同源性最高,为99%;n-ras、pik3cd、pin1和raf1的氨基酸序列均与斑马鱼相对应的氨基酸序列同源性最高,分别为99%、87%、96%和97%,结果表明稀有鮈鲫与鲤鱼、斑马鱼的亲缘关系较近。组织表达分析表明,k-ras、n-ras、pik3cd、pin1和raf1基因在肝脏、鳃、肾脏、脑和性腺等组织中具有表达差异性。本文为研究环境污染物对鱼类致癌作用机制和安全性评估提供分子生物学基础和科学依据。
稀有鮈鲫;Ras基因;基因克隆
Ras基因是一类在生物进化过程中较为保守的原癌基因,在细胞的增殖、分化和细胞骨架的构建等细胞生命活动中起到重要作用[1-2]。人类Ras基因家族包含3种功能性基因:H-ras、N-ras和K-ras,基因内部的核甘酸序列相差较大,但编码的产物均为p21蛋白(即Ras蛋白)。Ras蛋白是一种细胞信号传递蛋白,其功能主要是调节细胞增殖和分化,对细胞外信息的跨膜传递起重要作用,被称为细胞信号网络传递中的“分子开关”[3]。
Ras基因最常见的激活方式为点突变,约33%的人类恶性肿瘤存在Ras基因的点突变[4-5]。活化的Ras蛋白能结合和激活一系列的效应酶,通过下游的效应因子介导多种生物学功能[6]。Ras下游存在多种信号转导通路,各信号通路之间相互影响和制约,其中Ras/Raf和PI3K/Akt通路是肿瘤发生过程中最重要的2个信号级联因素[7]。目前在临床医学上,Ras相关研究工作主要集中在活化的Ras与各种肿瘤的关系,同时也利用各种模式动物研究Ras信号通路在肿瘤发生过程中的作用,以及Ras通路作为用药靶点的研究。而在水生动物中对于Ras的研究目前主要还在起始阶段,主要集中在基因的测序,以及少量的机理研究。Ren等[8]对斑马鱼胚胎时期血管生成的过程进行了研究,其研究结果表明,激活的N-Ras信号能够调控斑马鱼的动-静脉的分化。此外,Liu等[9]的研究也表明K-ras/PI3K-AKT信号在斑马鱼的造血作用和血管生成的过程中起重要作用。目前关于Ras通路相关基因信息特别是水生生物中相对缺乏,基于水生生物特别是鱼类是肿瘤研究的良好模型,因此亟待开展Ras通路相关基因基础信息学研究。
1 材料与方法(Materials and methods)
1.1 材料与试剂
Trizol reagent购自美国Invitrogrn公司,反转录酶M-MLV、随机引物、DNase I、dNTP、PCR所用Taq DNA聚合酶均为Promega(USA)公司产品。其他常规试剂均为国产分析纯。
1.2 实验鱼饲养
稀有鮈鲫为中国科学院水生生物研究所惠赠,并在本实验室饲养并繁殖后代。使用经过活性炭过滤并曝气的自来水做为养殖用水,控制pH值在7.2~7.6,温度为(25±1) ℃,水的硬度为44.0~61.0 mg·L-1(以CaCO3计算)。人工控制光照周期为16:8(昼:夜)。饲养期间投喂适量颗粒型商品饵料(Trea,德国)和新孵化的丰年虫(Artemia nauplii)早晚各一次。
1.3 总RNA提取与逆转录反应
稀有鮈鲫经低温麻醉后,迅速提取肝脏、鳃、性腺和肾脏等组织,总RNA的提取方法参照动物组织RNA抽提试剂盒进行,提取出的总RNA于-80 ℃超低温冰箱保存备用。
逆转录反应按Promega的M-MLV逆转录说明书进行,所有试剂均来自Promega (USA),加入总RNA 2 μg,随机引物1 μg,补无核酸酶水至15 μL混匀,于70 ℃温育5 min,迅速于冰中冷却。随后加入:5 μL 5xBuffer M-MLV,1.25 μL dNTP mix,1 μL RNAasin,200 U M-MLV Reverse Transcriptase和无核酸酶水1.75 μL,总共25 μL体系,整个过程在冰上进行。然后置于37 ℃温育1 h,之后70 ℃放置10 min,并于-20 ℃保存。
木材泡沫的吸水率很高(图3)。其开孔结构类似于海绵。然而,松木纤维含有疏水性(即防水)成分,与山毛榉相比,可减少松木泡沫的吸水性。其还具有吸收水分的能力,与泡沫密度无关——是纤维的疏水性质,而不是孔隙的大小。一个主要的因素是山毛榉和松木泡沫在水中保持尺寸稳定——冷水中24 h后膨胀小于1%,因此有效地防止膨胀。然而,吸水可能产生的问题,可能促进真菌侵袭。对此可能的解决方案是在纤维混合物中添加混凝土。添加10%的混凝土可将榉木泡沫的吸水率从31 kg/m2降低到2 kg/m2。混凝土赋予泡沫更高的密度。替代的疏水添加剂是硅烷或蜡。然而,这两者都对泡沫的强度具有负面影响。
1.4 目的基因引物设计及PCR扩增
在GenBank上搜索目的基因的同源序列,使用Primer Premier 5.0软件,在目的基因保守区域设计引物,引物序列见表1。分别取稀有鮈鲫雌、雄个体基因组cDNA为模板进行PCR扩增。总反应体系为25 μL,其中含模板DNA 1 μL,正向反向引物各1 μL,12.5 μL GoTaq®Green Master Mix (Promega,Madison,WI,USA),加无核酸酶水补至25 μL。
PCR扩增循环条件为:95 ℃预变性8 min;然后35个循环:94 ℃变性40 s,56 ℃复性30 s,72 ℃延伸30 s;72 ℃延伸10 min,4 ℃保存。取5 μL扩增产物用1.5%琼脂糖凝胶电泳检测,并用凝胶成像系统扫描记录图像。委托北京生工生物工程技术有限公司测序。
1.5 目的基因序列分析
经克隆测序获得扩增片段用DNAman软件进行分析,去除两端引物序列,并进行氨基酸序列推导。将得到的序列在GenBank上进行Blast初步分析,并将分析结果及序列向GenBank提交。从GenBank选取并下载各物种基因的氨基酸序列,用ClustalX1.8软件进行多重序列排列,将排列结果输入Mega5.0软件用NJ法构建系统进化树。
1.6 定量PCR
定量PCR使用7 500 Real-TimePCR System(Applied Biosystems,USA)荧光定量PCR仪,内参基因使用管家基因β-actin,基因定量的引物见表1。扩增体系为20 μL,PCR反应体系包括:10 μL GoTaq®qPCR Master Mix (Promega)、0.4 μL正向引物(forward primer)、0.4 μL反向引物(reverse primer)、2 μL cDNA和7.2 μL无核酸酶水。PCR反应程序为95 ℃,10 min;40个循环:95 ℃ 15 s,57 ℃ 40 s,72 ℃ 30 s;最后一个循环做出熔解曲线:95 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s。每个样品3次重复。目的基因的相对表达量根据2-ΔΔCt法计算。
1.7 数据处理与分析
所有的数据分析均采用SPSS 13.0 和OriginPro 8.0软件,实验结果的数据均为平均值±标准差表示。
2 结果(Results)
2.1 Ras信号通路相关基因的克隆
本文克隆k-ras、n-ras、pik3cd、pin1和raf1共5个稀有鮈鲫Ras信号通路相关基因并测定其相应的序列,序列大小分别为543、462、291、594以及471 bp。克隆的基因片段和相应的氨基酸序列提交至GenBank,获得的登陆号分别为KJ411872、KJ411873、KJ411874、KJ411875和KJ411876。
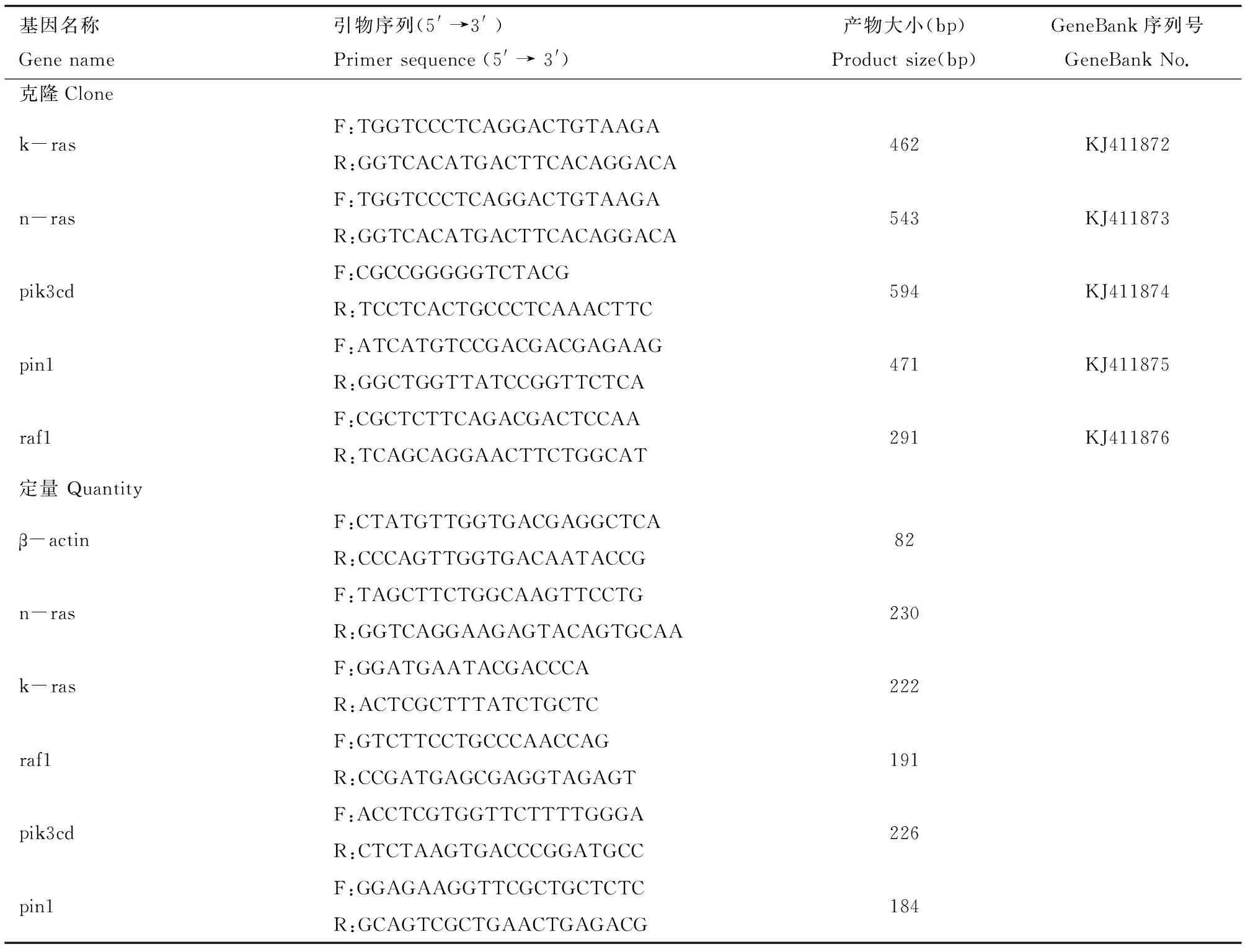
表1 稀有鮈鲫中Ras通路基因克隆和定量所用的PCR引物序列Table 1 Primer sequences used for cloning and quantification of Ras pathway genes in rare minnow
2.2 同源性分析及系统发育分析
BLAST分析获得为各基因Blastp的同源性(表2),发现k-ras氨基酸序列与鲤鱼、罗非鱼、比目鱼以及鲈鱼相对应的氨基酸序列同源性均为99%,
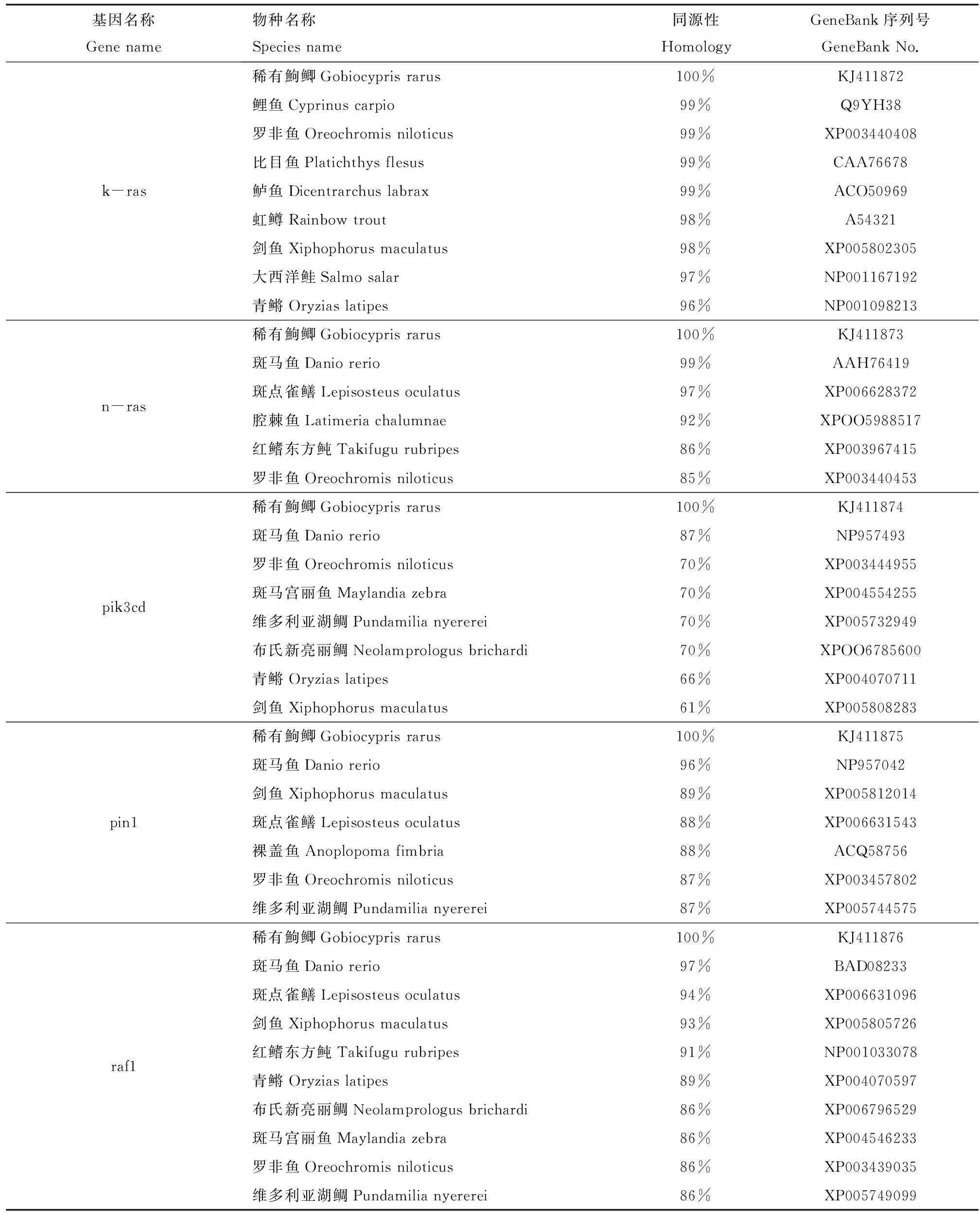
表2 稀有鮈鲫氨基酸序列同其他已知鱼类相应氨基酸序列的同源性比对Table 2 Homology comparison of amino acid sequences between Gobiocypris rarus and other fish species
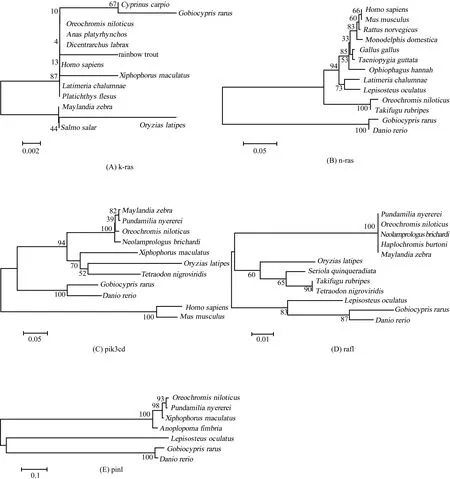
图1 基于NJ(neighbor-joining)法构建的稀有鮈鲫与其他物种的核苷酸进化树Fig. 1 Phylogenetic tree of genes sequence between Gobiocypris rarus and other organisms based on NJ (neighbor-joining) method
表明k-ras是具有较高的保守性。而n-ras、pik3cd、pin1以及raf1的氨基酸序列都与斑马鱼相对应的氨基酸序列同源性最高,分别是99%、87%、96%和97%。聚类分析结果表明,稀有鮈鲫n-ras、pik3cd、pin1和raf1在进化关系上也与斑马鱼最接近(图1)。
2.3 组织分布
荧光定量PCR测定了k-ras、n-ras、pik3cd、pin1和raf1基因在稀有鮈鲫肝脏、鳃、肾脏、脑和性腺5个组织中mRNA表达。在雌鱼中,k-ras基因在脑和性腺中的表达量高于其他组织;在雄鱼中,k-ras在鳃、肾脏、脑和性腺中的表达量均高于其在肝脏中的表达量。n-ras基因在雌鱼和雄鱼的各个组织中表达一致,性腺中的表达量最高,其次为肝脏,而其他组织相对较低。对于pik3cd基因,在雌雄鱼肾脏、脑、性腺中表达量相对较高,在肝脏中表达相对较低;在鳃中的表达具有性别差异性,在雄鱼中表达量较高,而在雌鱼中的表达量较低。pin1基因在雌雄鱼的脑和性腺中表达量高,而其他组织中的表达量相对较低。raf1基因在雌鱼的鳃、肾脏和脑中表达量低于在肝脏和性腺中的表达量;而在雄鱼中,raf1基因在性腺中表达量最高。
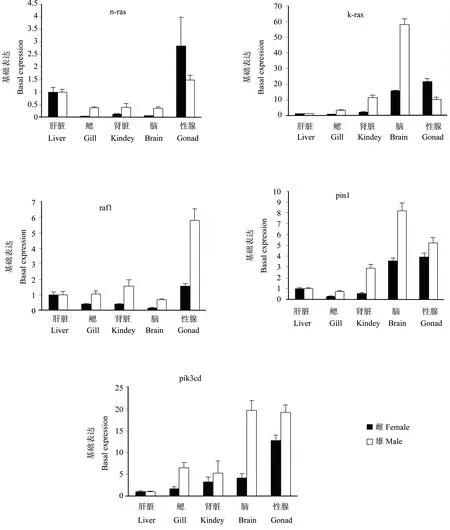
图2 k-ras、n-ras、pik3cd、pin1和raf1基因在稀有鮈鲫组织中的表达Fig. 2 Expression of k-ras, n-ras, pik3cd, pin1 and raf1 mRNA in a panel tissues of rare minnow
3 讨论(Discussion)
稀有鮈鲫是我国特有的小型理科鱼类,近年来已被广泛应用于生态、遗传、生理和环境科学等领域,已成为我国生态毒理研究方面的实验生物[10],然而目前关于分子生物学信息相对缺乏,特别是癌症相关信号通路相关基因等基础信息。Ras基因是一类在生物进化过程中较为保守的原癌基因,在细胞的增殖、分化和细胞骨架的构建等细胞生命活动中起到重要作用[1-2]。本文克隆获得了2个稀有鮈鲫Ras基因,包括k-ras和n-ras,序列比对发现k-ras与鲤鱼的k-ras基因同源性最高,氨基酸序列相似性为99%,而n-ras与斑马鱼相对应的氨基酸序列同源性最高,相似性为99%。组织分布发现n-ras基因主要在肝脏和性腺中高表达,而k-ras主要在脑和性腺中高表达。类似的,Liu等[9]克隆获了斑马鱼的k-ras基因,同源性分析显示k-ras蛋白与人类K-RAS2B和鼠K-RAS2高度相似,表明斑马鱼的k-ras基因与n-ras基因存在很大差别。另外,斑马鱼N-ras蛋白的同源性分析[11]表明Zras-B1编码的蛋白与人类N-ras最相似,相似性为91%,与人类Ha-ras和Ki-ras的相似性分别为84%和85%。k-ras基因在斑马鱼单细胞阶段、整个胚胎时期以及成鱼的大部分组织中均能检测到[9]。Ki-ras在比目鱼卵巢和肝脏中都有表达[12],小鼠HRAS转录组在脑、肌肉、皮肤中高度表达,而在肝脏中的表达量较低;KRAS转录组在肠道,肺以及胸腺中容易检测到,NRAS主要在哺乳动物小鼠睾丸和胸腺中表达[13]。综合以上研究表明k-ras和n-ras在不同物种中存在不同表达,同时组织分布存在较大差异。
Ras下游存在多种信号转导通路,各信号通路之间相互影响[7],pik3cd,raf1和pin1是Ras信号通路下游的关键基因,在信号激活和信号传导过程中具有重要作用。其中pik3cd是PI3K-Akt 信号通路中的一个重要靶点,在细胞内发挥着抑制凋亡、促进增殖的关键作用,并且与人类多种肿瘤的发生发展密切相关[14]。已有报道表明miR-7通过靶向PIK3CD、mTOR和p70S6K能有效地调控PI3K/Akt信号通路,抑制肝癌细胞的生长和转移[15]。而raf1在Ras/Raf1/MAPK(ERK)细胞信号传导途径中具有重要作用[16]。Bokemer等[17]研究发现活化的Ras能激活Raf1,从而激活其下游的激酶(MEK和MAPK),通过对转录调节因子表达的影响而将细胞增殖信号传递到细胞核内,达到调节细胞增殖过程。pin1是一种高度保守的、特异的多肽脯氨酰基顺反异构酶,能特异性地催化磷酸化的丝/苏-脯氨酸基序发生顺反异构,影响磷酸化蛋白的功能,其正常表达水平与细胞分裂紧密相连,在分裂旺盛的细胞中很容易检测到[18]。pin1在多种肿瘤中高表达,可促进CyclinD1 等下游基因的表达,促进细胞的异常增生而导致肿瘤发生[19]。Bao等[20]研究发现在人类前列腺癌、乳腺癌、宫颈癌、脑瘤、肺癌、结肠癌肿瘤组织中pinl的均存在过表达。本文获得了raf1、pin1和pik3cd基因序列信息,将为补充和完善背景生物学信息以及深入研究Ras信号通路的调控机制提供基础。
本文获得了稀有鮈鲫ras信号通路中k-ras,n-ras,pik3cd,raf1以及pin1等相关基因片段和序列的分子生物学信息,且获得了在肝脏、鳃、肾脏、脑和性腺中表达谱,为深入研究化学品致癌作用机制提供了分子生物学基础。
[1] Bos J L. Ras oncogenes in human cancer: A review [J]. Cancer Research, 1989, 49(17): 4682-4689
[2] Schmukler E, Kloog Y, Pinkas K R. Ras and autophagy in cancer development and therapy [J]. Oncotarget, 2014, 5(3): 577-586
[3] Bos J L. The ras gene family and human carcinogenesis [J]. Mutation Research, 1988, 195(3): 255-271
[4] Shin S H, Kim S C, Hong S M, et al. Genetic alterations of k-ras, p53, c-erbB-2, and DPC4 inancreatic ductal adenocarcinoma and their correlation with patient survival [J]. Pancreas, 2013, 42(2): 216-222
[5] Murtaza B N, Bibi A, Rashid M U, et al. Spectrum of k-ras mutations in Pakistani colorectal cancer patients [J]. Brazilian Journal of Medical and Biological Research, 2014, 47(1): 35-41
[6] Cully M, Downward J. SnapShot: Ras signaling [J]. Cell, 2008, 133: 1292-1302
[7] De Luca A, Maiello M R, D'Alessio A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways: Role in cancer pathogenesis and implications for therapeutic approaches [J]. Expert Opinion on Therapeutic Targets, 2012, 16(S2): S17-S27
[8] Ren C G, Wang L, Jia X E, et al. Activated n-ras signaling regulates arterial-venous specification in zebrafish [J]. Journal of Hematology & Oncology, 2013, 6: 34
[9] Liu L, Zhu S, Gong Z, et al. K-ras/PI3K-Akt signaling is essential for zebrafish hematopoiesis and angiogenesis [J]. PLoS ONE, 2008, 3(8): e2850
[10] 曹文宣, 王剑伟. 稀有鮈鲫: 一种新的鱼类实验动物[J]. 实验动物科学与管理, 2003, 20(S1): 96-99
Cao W X, Wang J W. Rare minnow: A new laboratory animal in China [J]. Laboratory Animal Science and Management, 2003, 20(S1): 96-99 (in Chinese)
[11] Cheng R, Bradford S, Barnes D, et al. Cloning, sequencing, and embryonic expression of an n-ras proto-oncogene isolated from an enriched zebrafish (Danio rerio) cDNA library [J]. Molecular Marine Biology and Biotechnology, 1997, 6(1): 40-47
[12] Françoise V H. cDNA cloning and expression of two Ki-ras genes in the flounder, Platichthys flesus, and analysis of hepatic neoplasms [J]. Comparative Biochemistry and Physiology Part B, 2000, 126: 17-27
[13] Leon J, Guerrero I, Pellicer A. Differential expression of the ras gene family in mice [J]. Molecular and Cellular Biology, 1987, 7(4): 1535-1540
[14] Osaki M, Oshimura M, Ito H. PI3K-Aktpathway: Its functions and alterations in human cancer [J]. Apoptosis, 2004, 9(6): 667-676
[15] Fang Y X, Xue J L, Shen Q, et al. MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma [J]. Hepatology, 2012, 55(6): 1852-1862
[16] Magnuson N S, Beck T, Vahidi H, et al. The Raf-1 serine/threonine protein kinase [J]. Seminars in Cancer Biology, 1994, 5(4): 247-253
[17] Bokemer D, Sorokin A, Dunn M J. Multiple intracellular MAP kinase signaling cascades [J]. Kidney International, 1996, 49(5): 1187-1198
[18] Liou Y C, Ryo R, Huang H K, et al. Loss of Pin1 function in the mouse resembles the cyclinD-null phenotypes [J]. Proceedings of the National Academy of Science, 2002, 99(3): 1335-1340
[19] Wulf G M, Ryo A, Wulf G C, et al. Pin1 is overexpressed in breast cancer and potentiates the transcriptional activity of c-Jun towards the cyclinD1 gene [J]. EMBO Journal, 2001, 20(13): 3459-3472
[20] Bao L, Kimzey A, Sauter G, et al. Prevalent overexpression of prolylisomerase Pin1 in human cancers [J]. American Journal of Pathology, 2004, 164(5): 1727-1737
◆
Clone, Sequence Analysis and Distribution of Ras Pathway Genes in Rare Minnow
Wang Miao, Zha Jinmiao*, Wang Zijian
State Key Laboratory of Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Science, Beijing 100085, China
22 October 2014 accepted 12 November 2014
Ras gene is a kind of more conservative proto-oncogenes in the process of evolution, it is very important for cell proliferation and differentiation, and the construction of cytoskeleton. Partial cDNA sequences of k-ras, n-ras, pik3cd, raf1 and pin1, which are involved in Ras signal pathway, were cloned and sequenced from the liver of Gobiocypris rasus. Sequence analysis showed that the k-ras gene shared the highest sequence affinity with the amino acid sequence of Cyprinus carpio (99%), whereas the other four genes showed the highest sequence affinity with those of Danio rerio (99%, 87%, 96% and 97%, respectively). The phylogenetic trees were developed based on amino acid sequences of Gobiocypris rarus and other known species, which showed the closest genetic relationship with Gobiocypris rarus, Cyprinus carpio and Danio rerio. Besides, differential gene expression of k-ras, n-ras, pik3cd, raf1 and pin1 has been demonstrated across a panel of tissues in the rare minnow. It has been shown that all the genes had differential expression in liver, gill, kidney, brain and gonad. The present study offered scientific information for discovering cancer processes and assessing ecological health risk of aquatic xenobiotics of Gobiocypris rarus at molecular level.
Grobiocypris rarus; Ras pathway genes; clone
国家重大863化学品项目课题“化学品毒性高通量生物测试与评价技术”(2012AA06A302);国家水体污染控制与治理科技重大专项“东江流域生物毒性监控与管理技术体系研究及应用示范”(2014ZX07206-005-002)
王妙(1988-),女,硕士,研究方向为水生态毒理学,E-mail: wangmiao8809@126.com;
*通讯作者(Corresponding author), E-mail: zhajinmiao@gmail.com
10.7524/AJE.1673-5897.20141022002
2014-10-22 录用日期:2014-11-12
1673-5897(2015)2-338-08
X171.5
A
查金苗(1975-),男,博士,研究员,主要研究兴趣包括水生模型生物体系的构建和发展、水环境生物毒性测试方法、环境内分泌干扰物的筛选技术研究、环境污染物对水生生物分子毒理机制和水生态系统完整性评估方法等,在国内外学术刊物上发表高水平论文70余篇,SCI论文40余篇。
王妙, 查金苗, 王子健. 稀有鮈鲫Ras信号通路相关基因的克隆、序列分析及其组织分布[J]. 生态毒理学报, 2015, 10(2): 338-345
Wang M, Zha J M, Wang Z J. Clone, sequence analysis and distribution of Ras pathway genes in rare minnow [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 338-345 (in Chinese)
