DNA甲基转移酶Delta 3B在子宫内膜癌细胞系的表达研究*
2015-06-05周勇慧姜树原王光丽张柱霞张颜波闫少春邵国
周勇慧 姜树原 王光丽 张柱霞 张颜波 闫少春 邵国
(1.包头医学院第一附属医院普外科,内蒙古包头014060;2.包头医学院中心实验室生物医学研究中心,内蒙古包头014060; 3.包头医学院基础医学院,内蒙古包头014060;4.丽水学院医学院,浙江丽水323000; 5.泰山医学院附属医院神经内科,山东泰安271000)
DNA甲基转移酶Delta 3B在子宫内膜癌细胞系的表达研究*
周勇慧1姜树原2,3王光丽4张柱霞2,3张颜波5闫少春2,3邵国2,3
(1.包头医学院第一附属医院普外科,内蒙古包头014060;2.包头医学院中心实验室生物医学研究中心,内蒙古包头014060; 3.包头医学院基础医学院,内蒙古包头014060;4.丽水学院医学院,浙江丽水323000; 5.泰山医学院附属医院神经内科,山东泰安271000)
目的检测子宫内膜癌细胞系中DNA甲基转移酶Delta3B(ΔDNMT3B)表达情况,探讨ΔDNMT3B各种异构体在子宫内膜癌发生中的作用。方法分别分离5种子宫内膜癌细胞系ARK-2、HEC-1B、ISHIKAWA、KLE和SPAC-1S的RNA,反转录成cDNA,应用普通PCR和real-time PCR检测ΔDNMT3B1、2、3、4、5、6和7 mRNA的表达及丰度。结果ΔDNMT3B1、2、4、5和7均可以被检测得到,而ΔDNMT3B6均检测不到。在5种细胞系中ΔDNMT3B2是表达的主要形式,而且5种细胞系ΔDNMT3B表达形式不同。结论ΔDNMT3B可能在不同类型子宫内膜癌中起一定的作用。
ΔDNMT3B;子宫内膜癌
子宫内膜癌是一种常见的恶性疾病,其世界范围内的发病率不同[1],根据其病因和病理特征,子宫内膜癌被分为两种类型[2]。DNA甲基化在两种类型的子宫内膜癌的形成和发展中都起到了作用[3]。肿瘤细胞在DNA甲基化水平上出现了与正常细胞的差异:总体的甲基化水平比正常细胞降低而与抑癌基因启动子区CpG岛的甲基化水平比正常细胞升高[4]。
Robertson等研究显示癌症病人样本中DNMTs发生上调,DNMT3A、DNMT1和DNMT3B上调均在50%以上,其中DNMT3B与对照相比,癌症病人平均增加近8倍,因此DNMT3B在癌症的发生中可能有重要作用[5].ΔDNMT3B是Wang等发现的DNMT3B的异构体,ΔDNMT3B在非小细胞性肺癌(non-small cell lung cancer(NSCLC))是主要形式并且可能在肿瘤形成过程中起到重要作用[6]。本研究检测5种子宫内膜癌细胞系中ΔDNMT3B的表达情况及丰度,探讨ΔDNMT3B在子宫内膜癌中的可能作用。
1 材料和方法
1.1 细胞培养
Ark-2、Hec-1B、Ishikawa、KLE和SPAC-1s培养于含5%胎牛血清的DMEM培养基中(各100 U/ml青霉素、100 μg/ml链霉素)。37℃,5%CO2,饱和湿度下培养。
1.2 试剂
RNeasy Mini Kit购于QIAGEN公司;superscripⅡRT酶(1×108U/L)购于英韦创津公司;dNTP(10 mmol/l、0.25 mmol/l),random引物(0.5 g/)和Taq DNA聚合酶(5×106U/L)购于大连宝生物; 2Xreal-time PCR mix购于康为世纪生物科技有限公司。
1.3 引物
根据wang等的研究报道[6]和Genebank序列,用引物设计软件Primer premier 5.0分别设计ΔDNMT3B和内参GAPDH基因的引物。生工生物工程(上海)股份有限公司合成引物,引物序列如下。

用1S和1AS扩增ΔDNMT3B1;用2S和2AS扩增ΔDNMT3B2;用3S和1AS扩增ΔDNMT3B3;用3S和2AS扩增ΔDNMT3B4;用3S和3AS扩增ΔDNMT3B5;用5S和4AS扩增ΔDNMT3B6;用6S和5AS扩增ΔDNMT3B7。
1.4 RT-PCR、普通PCR及real-time PCR
RT-PCR:按照RNeasy Mini Kit说明书提取总RNA,用nano drop1000分析RNA的含量。反转录PCR:在0.2 ml薄壁PCR反应管中加入总RNA 2 μg,随机引物1 μl,按照SuperscripⅡ试剂盒步骤进行,最后得到20 μl cDNA产物-20℃保存。
PCR反应:按照文献进行PCR反应,PCR结束后利用琼脂糖凝胶电泳和凝胶成像以对PCR产物进行分析。QPCR:反应在ABI 7900 real-time PCR反应仪,按照康为世纪生物科技有限公司2×realtime mix加入模板、引物和mix。反应参数:95℃预变性10 min,再进行95℃,30 s;60℃,60 s(40 cycles),最后60℃延伸5 min停止反应。
1.5 数据分析及统计学处理
Real-time实验中deltaDNMT3B的CT值通过GAPDH的CT值均一化,即ΔCT=CTdeltaDNMTCTGAPDH,而deltaDNMT3B mRNA相对丰度值以ΔΔCT值(DD value)表示,ΔΔCT=2-ΔCT[3]。结果以¯x±s表示,用SPSS10.0数据统计软件ANOVA和Tukey对组间数据进行处理和分析,以P<0.05为显著差别的界限。
2 结果
2.1 普通PCR检测五种细胞系表达deltaDNMT3B的情况
普通PCR结果显示(图1),在5种子宫内膜癌细胞系中,ΔDNMT3B1、2、4、5和7均可以被检测得到,而ΔDNMT3B6均检测不到,ΔDNMT3B3在ARK和SAPC-1S中检测不到,ΔDNMT3B3在HEC、ishikawa和KLE细胞中可以被检测得到。

图15 种子宫内膜癌细胞系ΔDNMT3B PCR产物电泳图
2.2real-time PCR检测deltaDNMT3B Real-time PCR结果显示(图2),在5中子宫内膜癌细胞系中,ΔDNMT3B2为ΔDNMT3B的主要异构体,比其他的ΔDNMT3B要高。
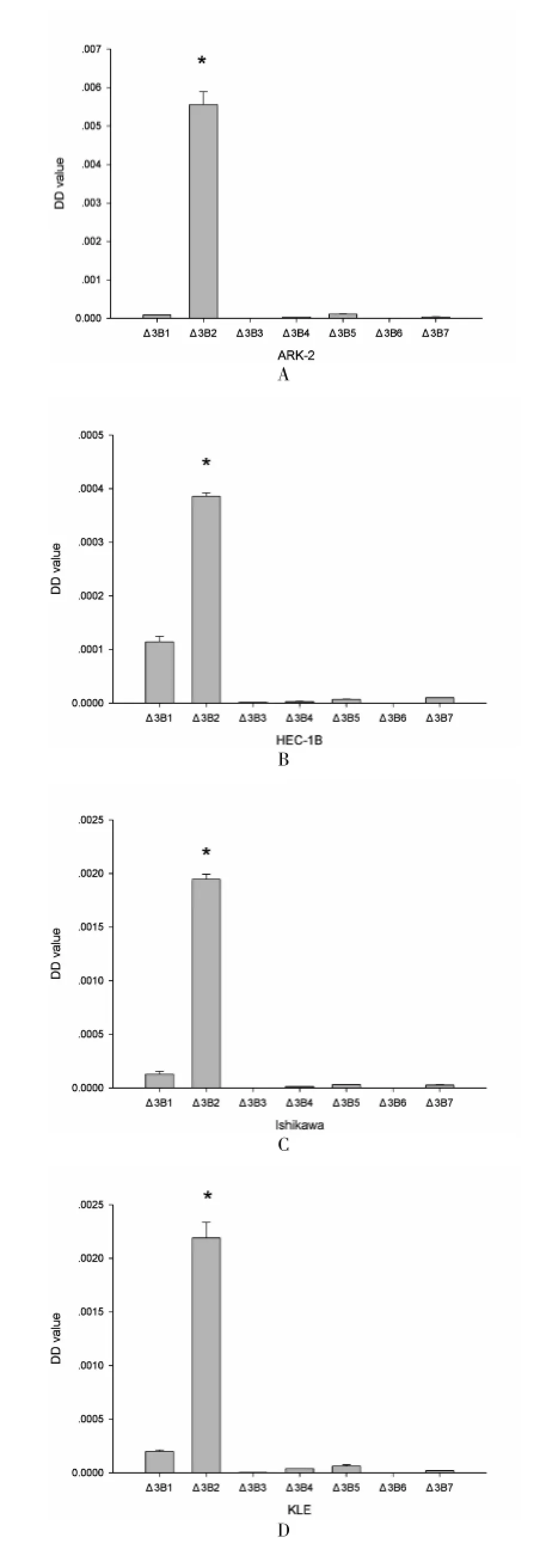

图2 ΔDNMT3B mRNA在5种子宫内膜癌细胞系表达水平图
3 讨论
异常的DNA甲基化在肿瘤的发生发展中扮演了重要角色,研究显示肿瘤细胞中整体甲基化水平呈现降低同时伴随着修复基因/抑癌基因启动子区CpG岛的DNA甲基化水平升高,整体基因组DNA甲基化水平降低会增加染色体不稳定性及癌基因的活化,修复基因/抑癌基因启动子区CpG岛的DNA甲基化组会导致它们转录活性降低或丧失而造成基因损伤增加与肿瘤抑制丧失。催化DNA中CpG岛中二核苷酸中C发生甲基化的酶为DNA(胞嘧啶-C5)甲基转移酶(DNA methyltranferase,DNMT),到目前为止共有DNMT1、DNMT3A和DNMT3B三种有催化活性的DNMT被发现[7]。DNMT1是持续性甲基化酶,其底物是半甲基化的DNA,而DNMT 3A和DNMT 3B都有从头催化DNA甲基化的能力,而无催化活性的DNMT3L可以和DNMT3A或DNMT3B相互作用,改变其活性[4]。
Okano等克隆到DNMT3B基因时他们同时克隆到了3个基因,即DNMT3B1、DNMT3B2和DNMT3B3共3种异构体[8],时至今日,近40种DNMT3B异构体被发现[6,9-11]。Wang等在NSCLC中发现了7个新的DNMT3B的异构体,这7个异构体从内含子4开始转录并且保留了外显子5的一组异构体,他们命名为ΔDNMT3B1-7[6]。ΔDNMT3B的表达与RASSF1A基因promotor的甲基化密切相关,下调ΔDNMT3B4直接影响RASSF1A基因promotor的甲基化。由于RASSF1A基因是一种新的肿瘤抑制基因,在肿瘤中甲基化程度最高,大量研究表明RASSF1A表达缺失和启动子区高甲基化有着广泛的肿瘤谱与,多种人类肿瘤有关,因此ΔDNMT3B在NSCLC可能起到重要作用[9]。
Wang等检测了13个NSCLC细胞系,其ΔDNMT3B1-7表达各不相同,其中ΔDNMT3B1和ΔDNMT3B2在每种NSCLC细胞系都表达,ΔDNMT3B4在12种NSCLC细胞系表达,ΔDNMT3B6在7个细胞系中表达[6]。在我们的实验中,检测了5中子宫内膜癌细胞系,结果显示ΔDNMT3B1、2、4、5和7在5中细胞系中都表达。在所检验的5个子宫内膜癌细胞系中,与Wang相似的是ΔDNMT3B1和ΔDNMT3B2在5中细胞系中都检测得到,同时DNMT3B4、ΔDNMT3B5和DNMT3B7也都检测得到。而ΔDNMT3B6在所检验的子宫内膜癌细胞系中均不表达。从结果可以看到,不同组织的癌症细胞系其ΔDNMT3B1-7表达情况不同,即使同为子宫内膜癌,其ΔDNMT3B1-7表达也不尽相同。因此可以推论,ΔDNMT3B1-7在不同组织及类型的癌症中所扮演角色应该不同。
DNMT3B在肿瘤细胞系及肿瘤组织中的表达要高于正常组织[5],ΔDNMT3B的转录起始区相当于DNMT3B1的外显子5,而其转录起始点相当于DNMT3B1的外显子6的位置。因此推断与DNMT3B1相比,ΔDNMT3B的预测的翻译产物要少200个左右的氨基酸残基,由于ΔDNMT3B1-4保留了PWWP结果域而ΔDNMT3B 5-7没有保留了PWWP结果域,同时ΔDNMT3B 5-7缺少了甲基转移酶的催化结构域,所以与DNMT3B1相比,其生物学功能可能有较大差异。因此,进一步研究ΔDNMT3B在各种肿瘤细胞和组织中的表达规律和变化,对于研究DNMT3B在肿瘤发生和发展中的作用有重要意义。
[1]Xu S,Ren J,Chen HB,et al.Cytostatic and apoptotic effects of DNMT and HDAC inhibitors in endometrial cancer cells[J].Curr Pharm Des,2014,20:1881-1887.
[2]Bokhman JV.Two pathogenetic types of endometrial carcinoma[J].Gynecol Oncol,1983,15:10-17.
[3]Xiong Y,Dowdy SC,Xue A,et al.Opposite alterations of DNA methyltransferase gene expression in endometrioid and serous endometrial cancers[J].Gynecol Oncol,2005,96:601-609.
[4]Shao G,Zhang R,Zhang S,et al.Splice variants DNMT3B4 and DNMT3B7 overexpression inhibit cell proliferation in 293A cell line[J].In Vitro Cell Dev Biol Anim,2013,49:386-394.
[5]Robertson KD,Uzvolgyi E,Liang G,et al.The human DNA methyltransferases(DNMTs)1,3a and 3b:coordinate mRNA expression in normal tissues and overexpression in tumors[J].Nucleic Acids Res,1999,27:2291-2298.
[6]Wang L,Wang J,Sun S,et al.A novel DNMT3B subfamily,DeltaDNMT3B,is the predominant form of DNMT3B in nonsmall cell lung cancer[J].Int J Oncol,2006,29:201-207.
[7]Bestor TH.The DNA methyltransferases of mammals[J].Hum Mol Genet,2000,9:2395-2402.
[8]Okano M,Xie S,Li E.Cloning and characterization of a family of novel mammalian DNA(cytosine-5)methyltransferases[J].Nat Genet,1998,19:219-220.
[9]Wang J,Bhutani M,Pathak AK,et al.Delta DNMT3B variants regulate DNA methylation in a promoter-specific manner[J].Cancer Res,2007,67:10647-10652.
[10]Wang J,Walsh G,Liu DD,et al.Expression of Delta DNMT3B variants and its association with promoter methylation of p16 and RASSF1A in primary non-small cell lung cancer[J].Cancer Res,2006,66:8361-8366.
[11]Gopalakrishnan S,Van Emburgh BO,Shan J,et al.A novel DNMT3B splice variant expressed in tumor and pluripotent cells modulates genomic DNA methylation patterns and displays altered DNA binding[J].Mol Cancer Res,2009,7:1622-1634.
The expression of ΔDNMT3B in endometrial cancer cell lines
ZHOU Yong-hui1JIANG Shu-yuan2,3WANG Guang-li4ZHANG Zhu-xia2,3ZHANG Yan-bo5YAN Shao-chun2,3SHAO Guo2,3
(1.Dept.of general surgery,the First Affiliated Hospital of Baotou Medical College,Baotou 0140606,China; 2.Biomedicine research center of center lab,BaoTou medical college,Baotou 014060,China; 3.Basci medical department,Baotou medical college,Baotou 014060,China; 4.Medical school,Lishui University,Lishui 323000,China; 5.Dept.of Neurology,Affiliated Hospital of Taishan Medical College,Taian 271000)
Objective:This work aims at investigating the expression of ΔDNMT3B in endometrial cancer cell lines. Methods:The RNA of 5 cell lines were separated and were reverse transcribed to cDNA.The expression and the abundant of ΔDNMT3B were detected by regular PCR and real-time PCR.Results:ΔDNMT3B1、2、4、5 and 7 all can be detected and ΔDNMT3B6 can not be detected in 5 cell lines.Conclusion ΔDNMT3B may play a role in endometrial cancer.
ΔDNMT3B;endometrial cance
10.3969/j.issn.1004-7115.2015.8.001
2015-6-18)
国家自然科学基金(81060212,81160244,81360316,81460283);内蒙古自然科学基金资助项目(2010BS1104;2014MS0810);中国博士后基金项目(20080430851);内蒙古自治区高等学校青年科技英才支持计划资助(NJYT-13-A10);研究生科研创新项目(S201410127(Y02));教育部留学回国人员科研启动基金(46批)。
周勇慧(1978—),男,主治医师。
邵国,博士,教授,Email:shao_guo_china@163.com;闫少春,博士,教授,Email:yanshaochunby@163.com
