携带SLC基因的Birc5-siRNA质粒载体的构建及鉴定*
2015-06-05朱慧芬孙媛丽万京华
舒 榕,王 强,朱慧芬,孙媛丽,贺 琪, 万京华
1湖北省中山医院麻醉科,武汉 430033
2武汉科技大学医学院基础医学院病原生物与免疫学系,武汉 430065
3华中科技大学同济医学院基础医学院免疫学系,武汉 430030
实验研究
携带SLC基因的Birc5-siRNA质粒载体的构建及鉴定*
舒 榕1,王 强2△,朱慧芬3,孙媛丽3,贺 琪3, 万京华2
1湖北省中山医院麻醉科,武汉 430033
2武汉科技大学医学院基础医学院病原生物与免疫学系,武汉 430065
3华中科技大学同济医学院基础医学院免疫学系,武汉 430030
目的 构建携带SLC基因的Birc5-siRNA质粒载体,为肿瘤靶向治疗研究提供基础。方法 使用Ambion公司siRNATarget Finder设计的Birc5mRNA干扰序列,将Birc5-siRNA插入载体PEGFP6-1后转化大肠埃希菌扩增培养,提取质粒;将SLC插入质粒pGenesil-8后转化细菌扩增培养,提取质粒;挑取酶切鉴定正确的质粒转化菌液测序鉴定;采用分子克隆技术构建特异性沉默Birc5且携带SLC基因的质粒,命名为pgsiRNA-Birc5+SLC。结果 质粒Birc5能被EcoRⅠ酶切出1条约400bp的DNA条带,说明Birc5-siRNA已插入质粒载体PEGFP6-1;pGenesil-8-SLC能被BglⅡ+XbaⅠ酶切出1条约430bp的DNA条带,说明SLC插入正确;酶切鉴定正确的质粒转化菌液Birc5-siRNA和SLC测序结果显示均为插入正确的克隆质粒;经酶切鉴定分析显示pgsiRNA-Birc5+SLC符合酶切鉴定结果,表明携带SLC基因的Birc5-siRNA质粒载体构建成功。结论 成功构建了携带SLC基因的Birc5-siRNA质粒,为进一步研究靶向沉默肿瘤Birc5基因并趋化淋巴细胞抗肿瘤研究提供了工具和基础。
次级淋巴组织趋化因子; Birc5; siRNA; 肿瘤
Birc5选择性高表达于多种肿瘤,与肿瘤的耐药、高复发率和患者的低存活率相关联,沉默其表达可作为诱导肿瘤细胞凋亡的策略,然而通过沉默Birc5的表达诱导肿瘤细胞凋亡并未取得满意的效果[13]。次级淋巴组织趋化因子(secondary lymphoid-tissue chemokine,SLC)为重要的CC族趋化因子成员,在生理状况下,SLC在T细胞向淋巴结迁移和定位中发挥重要作用,并可通过促进肿瘤细胞免疫,或者抑制血管的生成而间接抑制肿瘤的生长[45]。基于此,本研究构建了携带SLC基因的Birc5-siRNA质粒载体,为靶向沉默肿瘤Birc5基因并趋化淋巴细胞增强抗肿瘤免疫研究提供基础。
1 材料与方法
1.1 材料与试剂
E.coli DH5α菌株由华中科技大学同济医学院免疫学系保存;线性化质粒PEGFP6-1、PEGFP6-3载体和质粒pGenesil-8载体购自Genesil公司、Wizard®基因组DNA纯化试剂盒、质粒提取、纯化试剂盒购自Qiagen公司;所用酶类BamHⅠ、HindⅢ、T4DNA连接酶、EcoRⅠ、SalⅠ、BglⅡ、MluⅠ、XbaⅠ、Ex Taq聚合酶、PstⅠ购自TaKaRa公司;Birc5引物、SLC引物和β-actin引物均购自上海英骏生物技术有限公司。常用试剂中电泳及分离试剂均为分析纯试剂配制。
1.2 siRNA序列的设计与合成
目的基因:SLC和Birc5。使用Ambion Target finder软件设计针对Birc5的siRNA序列。利用BLAST搜索选择针对人类Birc5mRNA(GenBank accession no.NM_001168.1)外显子3(5′-AGCATTCGTCCGGTTGCGCTT-3′)的21核苷酸系列,构建针对Birc5的干扰质粒,命名为pgsiRNA-Bir。构建能特异性沉默Birc5且携带SLC基因的质粒,命名为pgsiRNA-Birc5+SLC。
引物结构:BamHⅠ+Sense+Loop+Antisense+终止信号+EcoRⅠ/SalⅠ+HindⅢ
1.3 载体的构建
流程见图1。
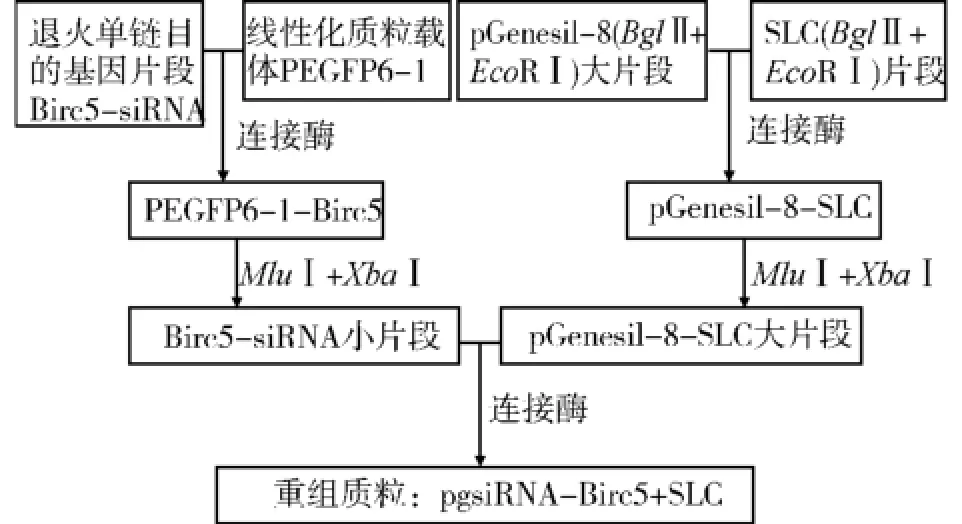
图1 载体构建流程图Fig.1 The flow chart of vector construction
1.3.1 Birc5-siRNA载体的构建 退火单链目的基因片段Birc5-siRNA与线性化质粒载体PEGFP6-1连接。取5μL过夜连接产物转化感受态细胞DH5α,涂布于含Kanar抗性(终浓度30μg/mL)的LB平板上选择培养。用试剂盒小量提取质粒,用EcoRⅠ做酶切鉴定,挑取酶切鉴定正确的质粒转化菌液Birc5-siRNA测序,命名为PEGFP6-1-Birc5。
1.3.2 SLC载体的构建 分别以SLC-f、SLC-r为上下游引物,以质粒SLC-RFP为模板,体外PCR扩增基因SLC片段。1%Agarose凝胶电泳回收约430bp基因SLC PCR产物。BglⅡ+EcoRⅠ双酶切pGenesil-8、SLC,分别回收载体大片段和SLC目的基因片段,通过连接酶连接。取5μL过夜连接产物转化感受态细胞DH5α,分别涂布于含Kanar抗性(终浓度30μg/mL)的LB平板上选择培养。用试剂盒小量提取质粒,并分别用BglⅡ+EcoRⅠ做酶切鉴定。挑取酶切鉴定正确的质粒转化菌液pGenesil-8-SLC测序,命名为pGenesil-8-SLC。
1.3.3 Birc5-siRNA+SLC载体的构建 MluⅠ和XbaⅠ双酶切质粒pGenesil-8-SLC、Birc5-siRNA,分别回收大片段和小片段。1%Agarose凝胶电泳分别回收质粒pGenesil-8-SLC MluⅠ和XbaⅠ大片段、质粒Birc5-siRNA MluⅠ和XbaⅠ小片段,通过连接酶连接质粒Birc5-siRNA回收小片段与pGenesil-8-SLC回收大片段。取5μL过夜连接产物转化感受态细胞DH5α,分别涂布于含Kanar抗性(终浓度30μg/mL)的LB平板上选择培养。用试剂盒小量提取质粒,并分别用EcoRⅠ和MluⅠ和XbaⅠ做酶切鉴定,命名为pgsiRNA-Birc5+SLC。大规模提取质粒pgsiRNABirc5+SLC,储存在4℃备用。
2 结果
2.1 Birc5-siRNA载体的构建与鉴定
Birc5-siRNA目的基因插入载体PEGFP6-1,经转化细菌、扩增培养、提取质粒与酶切鉴定(图2)。质粒PEGFP6-1的多克隆位点(MCS)如下:
-MluⅠ-HindⅢ-ShRNA-BamHⅠ-U6Promoter-EcoRⅠ-SalⅠ-XbaⅠ-PstⅠ-
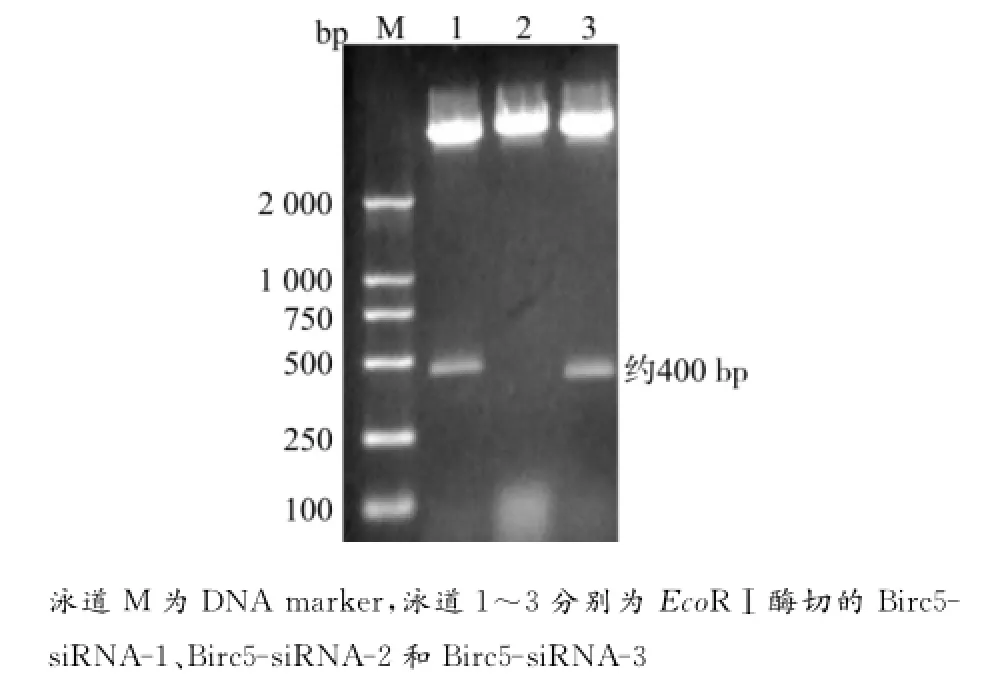
图2 EcoRⅠ酶切质粒PEGFP6-1-Birc5后1%琼脂糖凝胶电泳图谱Fig.2 1%Agarose gel electrophoretogram of the PEGFP6-1-Birc5 digested by EcoRⅠ
因为质粒载体PEGFP6-1只含有1个EcoRⅠ的酶切位点,而Birc5的ShRNA序列我们设计了1个EcoRⅠ的酶切位点,故质粒Birc5-siRNA-1和Birc5-siRNA-3均能被EcoRⅠ酶切出1条约400bp的DNA条带,说明目的基因片段Birc5-siRNA已经插入到质粒载体PEGFP6-1。
挑取酶切鉴定正确的质粒转化菌液Birc5-siRNA送公司测序,测序结果见图3。经测序分析:均为插入正确的克隆质粒,而且质量均符合设计要求。
图3 Birc5-siRNA质粒转化菌液测序结果Fig.3 The sequencing results of the plasmid Birc5-siRNA
2.2 SLC载体的构建与鉴定
目的基因SLC插入质粒pGenesil-8,经转化细菌、扩增培养、提取质粒与酶切鉴定。质粒pGenesil-8的多克隆位点(MCS)如下:
-CMV Promoter-NheⅠ-BglⅡ-XhoⅠ-EcoRⅠ-PstⅠ-IRES-EGFP-SV40polyA-MluⅠ-ShRNAU6Promoter-XbaⅠ-
基因SLC插入在质粒pGenesil-8的BglⅡ和EcoRⅠ之间,如若插入正确,就能被BglⅡ+XbaⅠ酶切出1条约430bp的DNA条带;经酶切鉴定分析:pGenesil-8-SLC-2和pGenesil-8-SLC-3均符合酶切鉴定结果(图4)。
挑取酶切鉴定正确的质粒转化菌液pGenesil-8-SLC送公司测序,测序结果见图5。经测序分析:均为插入正确的克隆质粒,而且质量均符合设计要求。

图4 BglⅡ和EcoRⅠ酶切质粒pGenesil-8-SLC后1%琼脂糖凝胶电泳图谱Fig.4 1%Agarose gel electrophoretogram of the pGenesil-8-SLC digested by BglⅡand EcoRⅠ
图5 pGenesil-8-SLC质粒转化菌液测序结果Fig.5 The sequencing results of the plasmid pGenesil-8-SLC
2.3 pgsiRNA-Birc5+SLC载体的构建与鉴定
MluⅠ和XbaⅠ双酶切质粒pGenesil-8-SLC、Birc5-siRNA,连接质粒Birc5-siRNA回收小片段与pGenesil-8-SLC回收大片段,抗性培养筛选,小提质粒并分别用EcoRⅠ和MluⅠ+XbaⅠ做酶切鉴定。质粒pGenesil-8的多克隆位点(MCS)如下:
-CMV Promoter-NheⅠ-BglⅡ-XhoⅠ-EcoRⅠ-PstⅠ-IRES-EGFP-SV40polyA-MluⅠ-ShRNAU6Promoter-XbaⅠ-
片段Birc5插入在质粒pGenesil-8的MluⅠ和XbaⅠ之间,如若插入正确,就能被EcoRⅠ酶切出1条约1 600bp的DNA条带;经酶切鉴定分析: pGenesil-8-Birc5和pGenesil-8-SLC-Birc5均符合酶切鉴定结果(图6)。
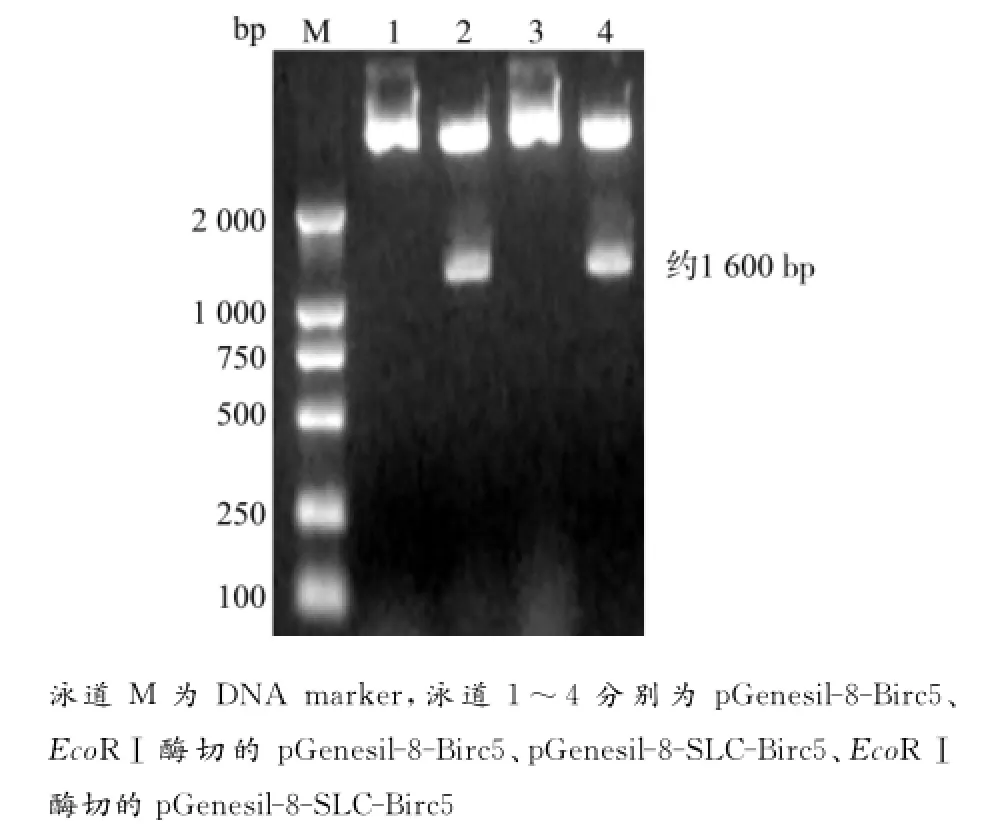
图6 EcoRⅠ酶切质粒pgsiRNA-Birc5+SLC后1%琼脂糖凝胶电泳图谱Fig.6 1%Agarose gel electrophoretogram of the plasmid pgsiRNA-Birc5+SLC digested by EcoRⅠ
3 讨论
凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)是近年来发现的一凋亡调控蛋白家族,在许多物种中广泛存在,包括病毒、真核生物、哺乳动物等。Birc5是由142个氨基酸组成的胞质蛋白,分子量为16.5kD,是IAP家族中分子量最小的一个成员,具有抑制细胞凋亡和调节细胞分裂的重要功能。1997年Birc5由耶鲁大学的Altieri等[6],用效应细胞蛋白酶受体1(effector cell protease receptor 1,EPR-1)cDNA在人类基因组库的杂交筛选中首次分离出来,自从被发现以来,Birc5就逐渐成为生物靶向治疗的重要分子,对其在恶性肿瘤治疗中的应用研究也日趋深入。
本课题组前期研究工作证明,以Birc5作为抗肿瘤的靶点,采用反义寡聚核苷酸、核酶、Birc5突变体、干扰RNA等策略具有沉默其表达与诱导肿瘤细胞凋亡的效应,但其效应有待增强。本课题采用RNA干扰技术,利用针对Birc5编码基因的siRNA重组质粒,即pgsiRNA-Bir,导入肝癌细胞株HepG2中,结果显示siRNA能抑制肿瘤细胞Birc5的表达,诱导肿瘤细胞的凋亡。此外,我们发现Birc5在临床肝细胞癌组织(与癌旁组织相比)、肝癌细胞系HepG2(与正常肝细胞L02相比)中均高表达[7],这提示Birc5是肝癌细胞存活、抵抗凋亡的重要因子。
SLC是唯一的具有抗血管形成作用的CC类趋化因子,它可以抑制血管生成进而抑制肿瘤生长。注入SLC后,VEGF、PGE2、TGF-β这些促进血管生成因子的量均明显下降,INF-γ升高,继而引起抑制血管生成的MIG和IP-10的升高,最终起到抑制肿瘤血管生成的作用。SLC亦可通过诱导树突状细胞(DC)及淋巴细胞抑制肿瘤。研究发现肺癌小鼠注射转染有SLC的DC比仅注射DC的小鼠根治率要高,向SLC缺乏的plt小鼠经皮注射SLC,能使T细胞有效地向淋巴结迁移[8]。DC从肿瘤部位迁移向引流淋巴结的过程中,区域淋巴内SLCmRNA增高,说明在诱导DC及淋巴细胞的抗瘤免疫反应中SLC起到重要作用[5,9]。
基于此,我们设计与构建了携带SLC基因的Birc5-siRNA质粒载体,为进一步探讨靶向沉默肿瘤Birc5基因并趋化淋巴细胞增强抗肿瘤免疫研究提供了基础。
[1] Nigam J,Chandra A,Kazmi H R,et al.Expression of serum survivin protein in diagnosisand prognosis of gallbladder cancer:a comparative study[J].Med Oncol,2014,31(9):167.
[2] Ghanbari P,Mohseni M,Tabasinezhad M,et al.Inhibition of survivin restores the sensitivity of breast cancer cells to docetaxel and vinblastine[J].Appl Biochem Biotechnol,2014,174(2):667-681.
[3] Or Y Y,Chow A K,Ng L,et al.Survivin depletion inhibits tumor growth and enhances chemosensitivity in hepatocellular carcinoma[J].Mol Med Rep,2014,10(4):2025-2030.
[4] LemstrováR,Sou^cek P,Melichar B,et al.Role of solute carrier transporters in pancreatic cancer:a review[J].Pharmacogenomics,2014,15(8):1133-1145.
[5] Li R,Hu H,Ma H,et al.The anti-tumor effect and increased tregs infiltration mediated by rAAV-SLC vector[J].Mol Biol Rep,2013,40(10):5615-5623.
[6] Ambrosini G,Adida C,Altieri D C.A novel anti-apoptosis gene,Birc5,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[7] Wang Q,Shu R,Lei P,et al.Co-silencing of Birc5(survivin)and Hspa5(Grp78)induces apoptosis in hepatoma cells more efficiently than single gene interference[J].Int J Oncol,2012,41(2):652-660.
[8] Levavasseur E,Metharom P,Dorban G,et al.Experimentalscrapie in plt mice:an assessment of the role of dendritic-cell migration in the pathogenesis of prion diseases[J].J Gen Virol,2007,88(8):2353-2360.
[9] Xue G,Cheng Y,Ran F,et al.SLC gene-modified dendritic cells mediate T cell-dependent anti-gastric cancer immune responses in vitro[J].Oncol Rep,2013,29(2):595-604.
(2014-09-18 收稿)
Construction and Identification of Birc5-siRNA Vector Carrying SLC Gene
Shu Rong1,Wang Qiang2△,Zhu Huifen3et al
1Department of Anesthesiology,Hubei Zhongshan Hospital,Wuhan 430033,China
2Department of Pathogenic Biology and Immunology,School of Basic Medical Science,Medical College of Wuhan University of Science and Technology,Wuhan 430065,China
3
Department of Immunology,School of Basic Medical Science,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To construct the Birc5-siRNA vector carrying SLC in order to provide a basis for the research on tumor biological targeted therapy.Methods Interfering sequences of Birc5were designed by using Ambion Target Finder.The Birc5-siRNA was inserted into PEGFP6-1,and then transformed and cultured with E.coli.Afterwards,the plasmid was extracted and identified.SLC was inserted into pGenesil-8,which was transformed,cultured with E.coli,followed by the extraction and identification of the plasmid.The bacterial transformation solution was selected after identification with enzyme digestion.The plasmid that silenced Birc5and carried SLC was constructed by molecular cloning technology and named pgsiRNABirc5+SLC.Results The plasmid Birc5was cleaved by EcoRⅠ,resulting in a 400bp DNA strip,indicating that Birc5-siRNA was inserted into PEGFP6-1.Plasmid pGenesil-8-SLC was cleaved by BglⅡ+XbaⅠto form a 430bp DNA strip,which suggested that SLC was inserted into pGenesil-8.The sequences of the recombinant plasmid were proved to be completely correct.Restriction enzyme analysis showed the Birc5-siRNA plasmid carrying SLC was successfully constructed.Conclusion The Birc5-siRNA plasmid carrying SLC was successfully constructed,which provides a tool and basis for further study of tumor targeted therapy aimed at SLC and Birc5.
secondary lymphoid-tissue chemokine; Birc5; siRNA; tumor
Q872
10.3870/j.issn.1672-0741.2015.01.014
*湖北省教育厅科学研究计划重点项目(No.D20131103)
舒 榕,女,1977年生,医学硕士,副主任医师,E-mail:1154586369@qq.com
△通讯作者,Corresponding author,E-mail:251204399@qq.com
