腺苷酸活化蛋白激酶通过抑制mTOR信号通路缓解糖尿病大鼠肾脏细胞外基质沉积*
2015-06-05邓玲艳许文娟程黎明
罗 霞,邓玲艳,许文娟,程黎明
华中科技大学同济医学院附属同济医院检验科,武汉 430030
腺苷酸活化蛋白激酶通过抑制mTOR信号通路缓解糖尿病大鼠肾脏细胞外基质沉积*
罗 霞,邓玲艳,许文娟,程黎明△
华中科技大学同济医学院附属同济医院检验科,武汉 430030
目的 高糖高脂饮食加小剂量链脲佐菌素(streptozocin,STZ)诱导大鼠糖尿病模型,尾静脉注射人重组腺相关病毒介导的截断突变型腺苷酸活化蛋白激酶基因AMPK-CA(AMPKα1312,T172D),观察AMPK基因治疗对糖尿病大鼠肾脏的保护作用并进行相关机制研究。方法 24只雄性Wistar大鼠随机分为糖尿病组(n=16)和普通饮食组(n=8),糖尿病组以高糖高脂饮食加小剂量STZ诱导糖尿病模型,8周后再将其随机分为两组,分别经尾静脉导入表达持续激活型AMPK-CA的重组腺相关病毒rAAV2-AMPK-CA和rAAV2-GFP作为对照,观察12周后处死实验动物,留取肾脏组织。PAS染色观察比较各组大鼠肾脏的病理改变,Real-time PCR法检测各组细胞外基质的mRNA水平变化,Western blot法检测Ⅳ型胶原蛋白α1(Col4α1)、腺苷酸活化蛋白激酶(AMPK)及磷酸化AMPK、磷酸化的乙酰辅酶A羧化酶(p-ACC)、雷帕霉素靶蛋白(mTOR)、磷酸化的mTOR及其下游分子磷酸化水平改变。结果 与正常对照组(C组)相比,转染rAAV2-GFP组(GFP组)糖尿病大鼠肾脏内p-AMPK和p-ACC蛋白水平显著降低(均P<0.05);与rAAV2-GFP组相比,转染rAAV2-AMPK-CA的糖尿病大鼠(CA组)体内p-ACC表达活性显著升高,肾重/体重、肾小球体积、肾小球系膜基质增生等指标有明显改善,细胞外基质纤维连接蛋白(FN)、Col4α1、Col4α5mRNA表达水平,以及Col4α1、信号分子p-mTOR、磷酸化的真核延伸因子激酶2(p-eEF2K)及磷酸化的起始因子4E结合蛋白1(p-4EBP1)蛋白表达水平显著降低(均P<0.05)。结论 rAAV2介导的AMPK-CA基因治疗可能通过增加糖尿病大鼠肾脏AMPK活性,抑制mTOR信号通路,缓解基质沉积,对糖尿病大鼠肾脏起保护作用。
腺苷酸活化蛋白激酶; 糖尿病肾病; 雷帕霉素靶蛋白
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见而严重的并发症之一,也是西方国家终末期肾脏疾病最主要的病因[1]。腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)由1个催化亚基α(63kD)和2个非催化亚基β(40kD)、γ(38kD)构成[2]。目前有研究表明一些治疗糖尿病的药物,如5-氨基咪唑-4-甲酰胺核糖核苷酸(AICAR)、二甲双胍等,可激活AMPK,抑制雷帕霉素靶蛋白(mTOR)信号通路,从而减少蛋白合成[3-4],因此我们推测AMPK在治疗糖尿病肾病,抑制蛋白合成,缓解肾脏细胞外基质沉积方面起着重要作用。但鉴于这些药物并非AMPK特异性的激动剂,本研究将以一种无毒、无显著免疫原性、能介导基因在体内长期稳定表达的重组腺相关病毒为载体,将持续激活型AMPK基因导入糖尿病大鼠体内,观察AMPK对糖尿病的治疗作用。
1 材料与方法
1.1 试剂与仪器
表达持续激活型AMPKα1312(T172D)基因的质粒pcDNA3.1-AMPK-CA,由D.Carling教授(英国伦敦)惠赠;重组腺相关病毒rAAV2-AMPK-CA包装由北京本元正阳公司提供技术支持;链脲佐菌素(Sigma,美国);Bayer血糖检测仪及试纸;Trizol核酸提取试剂盒(Invitrogen,美国);逆转录试剂盒(Fermentas,加拿大);Real-time PCR试剂盒(Thermo Scientific,美国);RIPA组织蛋白提取液及蛋白酶抑制剂和磷酸酶抑制剂(碧云天,中国);兔抗大鼠单克隆抗体抗β-actin(Santa Cruz,美国);兔抗大鼠单克隆抗体抗AMPKα、抗p-AMPKα(Thr172)、抗雷帕霉素靶蛋白(mTOR)、抗phosphmTOR(Ser2448)、抗磷酸化的起始因子4E结合蛋白1(p-4EBP1,Thr37/46)、抗磷酸化的真核延伸因子激酶2(p-eEF2K,Ser366)、抗磷酸化的乙酰辅酶A羧化酶(p-ACC,Ser79),辣根过氧化物酶标记羊抗兔IgG抗体(Cell Signaling Techology,美国);兔抗大鼠Ⅳ型胶原蛋白α1(Col4α1)多克隆抗体(武汉博士德公司);增强的化学发光试剂(Pierce,美国);PVDF膜(Bio-Rad,美国);SDS-PAGE蛋白质分子量标准(Thermo Scientific公司);Western blot设备(Bio-Rad公司),其他化学试剂均为国产分析纯试剂。
1.2 实验模型建立、分组、病毒感染
24只成年雄性SPF级Wistar大鼠购自湖北省疾控中心,体重180~200g,在华中科技大学同济医学院实验动物学部SPF级屏障系统饲养,自由饮食饮水,保持垫料干燥,适应性喂养1周后随机分为正常组(C组,n=8)和糖尿病组(n=16)。糖尿病组高脂高糖饮食(15%脂肪、15%糖、2%胆固醇、0.5%胆酸钠和67.5%正常基础饲料)喂养4周后尾静脉单次注射STZ(30mg/kg,用前溶于枸橼酸-枸橼酸钠缓冲液,pH4.5),每2周测定体重、血糖、24h尿蛋白,观察模型稳定性。糖尿病肾病大鼠模型成功的标准包括:①随机血糖大于16.7mmol/L;②与正常对照组相比尿蛋白显著升高。STZ注射加上持续高脂高糖喂养8周后,糖尿病大鼠模型稳定,且出现了明显的蛋白尿(表1)。将糖尿病肾病大鼠随机分为2组,分别经尾静脉注射腺相关病毒:①转染rAAV2-GFP组(GFP组):n=8,高脂高糖饮食+30 mg/kg STZ+rAAV2-GFP(1×1012v.g./mL);②转染rAAV2-AMPK-CA的糖尿病大鼠(CA组):n=8,高脂高糖饮食+30mg/kg STZ+rAAV2-AMPK-CA(1×1012v.g./mL)。重组腺相关病毒感染12周后,禁食12h,自由饮水,处死动物,留取肾脏标本,称重。肾组织部分保存于10%中性甲醛溶液,部分保存于-80℃冰箱用于后续检测。
表1 注射腺相关病毒治疗前各组大鼠生理指标(s,n=8)Table1 Biochemical parameters of rats before rAAV2injection in each groups,n=8)

表1 注射腺相关病毒治疗前各组大鼠生理指标(s,n=8)Table1 Biochemical parameters of rats before rAAV2injection in each groups,n=8)
C组:正常大鼠;GFP组:注射rAAV2-GFP的糖尿病大鼠;CA组:注射rAAV2-AMPK-CA的糖尿病大鼠。与C组比较,*P<0.05
?
1.3 尿蛋白检测
记录24h尿量,采用免疫比浊法测定尿总蛋白,严格按Roche Cobas 8000全自动生化分析仪及原装试剂说明书测定。
1.4 肾脏组织形态学观察及病理评估
肾组织经10%中性甲醛溶液固定、石蜡包埋、切片(4μm)、作PAS染色,进行镜下观察并进行病理评估。①肾小球体积:评估肾小球肥大情况,肾小球体积=(肾小球面积1.5×1.38)/1.01。②系膜/肾小球面积比:每只大鼠随机选择10个肾小球(至少2张切片),测定PAS阳性染色面积/肾小球面积比值,评估系膜基质增生(mesangial matrix expansion)情况。③肾小管损害及肾间质纤维化评分采用肾间质显微镜半定量评分系统(400倍镜下观察至少40个视野)。0级:正常,肾小管无明显改变,间质中无或有少量炎症细胞,无纤维组织增生;1级:肾小管上皮细胞轻度萎缩变性、坏死轻,呈灶状分布,间质少量炎症细胞浸润,纤维组织增生呈小灶状,影响范围小于25%;2级:肾小管上皮细胞中度萎缩变性、坏死轻,呈灶状分布,炎症细胞浸润,纤维组织中度增生,病变范围26%~50%;3级:肾小管上皮细胞萎缩变性、坏死严重,呈片状分布,大量弥散或聚集成灶的炎症细胞浸润,纤维组织增生呈束状、多灶或网状成片,病变范围大于50%。
1.5 细胞外基质蛋白指标mRNA表达的检测
取80mg肾脏组织,提取总RNA,紫外分光光度计定量RNA浓度及纯度,逆转录成cDNA。Real-time PCR检测细胞外基质蛋白mRNA表达水平如纤维连接蛋白(fibronectin,FN),胶原蛋白(collagen,Col)Col1α1,Col4α1,Col4α5,层粘连蛋白(lamininγ1)。Real-time PCR由Light Cycler 480系统完成,过程如下:95℃,7min;在95℃10s,60℃15 s条件下40个循环,循环完后温度升高至95℃作熔解曲线,数据采用2-ΔΔCt方法来进行分析。
Real-time PCR引物采用软件Primer Premier 5.0设计,NCBI比对其特异性,由Invitrogen公司合成。引物序列分别如下:β-actin,上游:5′-CACCCGCGAGTACAACCTTC-3′,下游:5′-CCCATACCCACCATCACACC-3′;FN,上游:5′-CCGGAGCCTTCACACATCAC-3′,下游:5′-GGTGGTGAAGTCAAAGCGAGT-3′;Col1α1,上游:5′-TCACCTACAGCACGCTTG-3′,下游:5′-GGTCTGTTTCCAGGGTTG-3′;Col4α1,上游:5′-CAACATCCGGCCCTTCATT-3′,下游:5′-GTGGGCTTCTTGAACATCTCG-3′;Col4α5,上游:5′-AGGCGAAATGGGTATGATGG-3′,下游:5′-TAATCCCTGGTAGCCTTTTGG-3′;lamininγ1,上游:5′-AACCGGACCATAGCTGAAGC-3′,下游5′-CATCATCATGTCCTGGTCGG-3′。
1.6 免疫印迹检测蛋白质水平
肾脏组织剪碎后加RIPA裂解液及蛋白酶抑制剂和磷酸酶抑制剂,提取总蛋白,BCA法测定蛋白质浓度。Western blot检测AMPKα,p-AMPKα,p-ACC,mTOR,p-mTOR,p-4EBP1,p-eEF2K,Col4α1,β-actin蛋白表达水平。过程如下:40μg蛋白加上样缓冲液煮沸变性,10%或8%SDS聚丙烯酰胺凝胶电泳分离蛋白,将分离后的蛋白转膜至PVDF膜上,用含5%小牛血清白蛋白的TBST溶液室温封闭3h,再分别与特异性蛋白一抗4℃孵育过夜,TBST溶液洗涤后分别与相应的二抗室温孵育2h,TBST溶液洗涤,ECL发光剂发光,Bio-Rad成像系统采集图片,Image-pro plus软件对图片进行吸光度分析。
1.7 统计学分析
2 结果
2.1 rAAV2-AMPK-CA能显著改善糖尿病大鼠肾脏病理变化
光镜下观察肾组织PAS染色可见,正常饮食组大鼠肾组织结构正常,糖尿病大鼠肾小球直径明显增大,毛细血管袢扩张呈分叶状,肾小球系膜基质增多,系膜区扩张,肾小球基底膜及囊壁增厚,部分肾小管上皮细胞空泡变性、脱落,间质区可见大量炎症细胞浸润。与C组相比,GFP组、CA组大鼠的肾重/体重比、肾小球体积、系膜/肾小球面积比、肾小管损害及肾间质纤维化评分均有显著差异。与GFP组相比,CA组肾重/体重比,肾小球体积,系膜/肾小球面积比明显改善,肾小管损害及肾间质纤维化评分没有统计学差异(图1和表2)。
2.2 rAAV2-AMPK-CA介导AMPK-CA在糖尿病大鼠体内表达
乙酰辅酶A羧化酶(ACC)是AMPK下游分子,p-ACC检测可反映AMPK活性[56]。与对照组(C组)相比,糖尿病大鼠(GFP组和CA组)p-AMPK水平显著降低,GFP组p-ACC水平显著降低,CA组p-ACC有降低趋势,但差异无统计学意义。与GFP组相比,CA组p-ACC水平显著升高,提示AMPK-CA具有生物学功能,可以提高AMPK的活性(图2)。
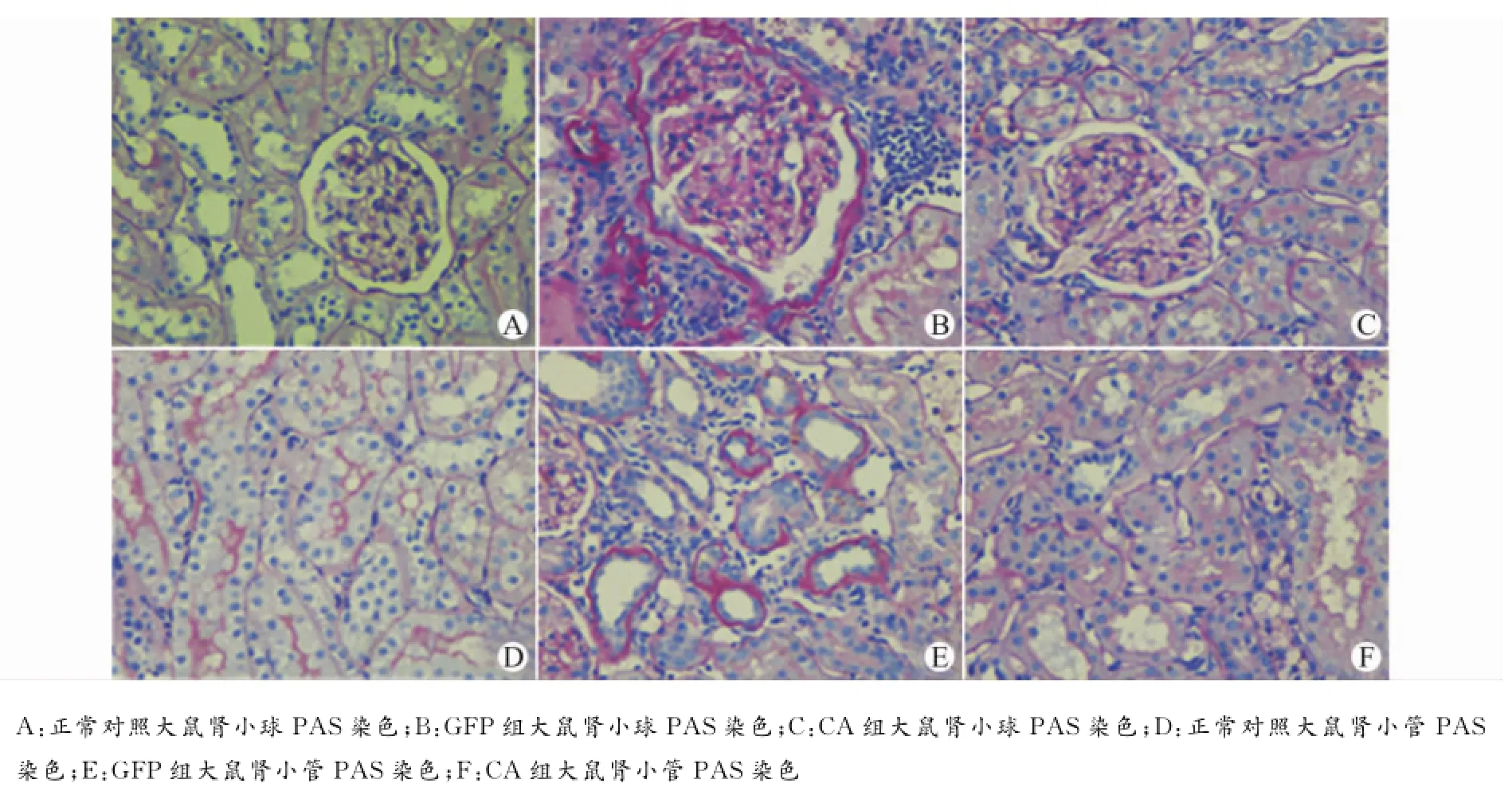
图1 大鼠肾脏组织PAS染色(×400)Fig.1 PAS staining of kidney tissues of rat(×400)

表2 rAAV2-AMPK-CA治疗12周后肾脏病理指标评估(¯x±s,n=8)Table2 Evaluation of renal pathological parameters of diabetic rats after treatment with rAAV2-AMPK-CA for 12weeks(¯x±s,n=8)

图2 rAAV2-AMPK-CA介导AMPK-CA在糖尿病大鼠体内表达Fig.2 Expression of AMPK-CA in diabetic rats treated with rAAV2-AMPK-CA
2.3 rAAV2-AMPK-CA显著降低糖尿病大鼠肾组织细胞外基质表达
与正常对照组相比,GFP组大鼠细胞外基质FN、Col1α1、Col4α1、Col4α5、lamininγ1mRNA显著升高,与GFP组相比,CA组FN、Col4α1、Col4α5 mRNA表达显著降低,Col1α1和lamininγ1虽差异无统计学意义,但表现出下降趋势(表3)。
表3 rAAV2-AMPK-CA治疗12周后肾脏细胞外基质蛋白指标mRNA表达降低,n=8)Table3 Decreased mRNA levels of ECM proteins in rats treated with rAAV2-AMPK-CA for 12weeks,n=8)

表3 rAAV2-AMPK-CA治疗12周后肾脏细胞外基质蛋白指标mRNA表达降低,n=8)Table3 Decreased mRNA levels of ECM proteins in rats treated with rAAV2-AMPK-CA for 12weeks,n=8)
Real-time PCR检测各组肾脏组织细胞外基质mRNA变化。C组:正常大鼠;GFP组:注射rAAV2-GFP的糖尿病大鼠;CA组:注射rAAV2-AMPK-CA的糖尿病大鼠。与C组比较,*P<0.05;与GFP组比较,#P<0.05
?
Western blot检测结果显示,与C组相比,GFP组Col4α1蛋白水平显著升高;与GFP组相比,CA组Col4α1表达显著下降;CA组与C组差异无统计学意义(图3A)。
2.4 rAAV2-AMPK-CA抑制mTOR信号通路
与C组相比,GFP组大鼠p-mTOR、p-eEF2K及p-4EBP1水平显著升高(均P<0.05);CA组较GFP组显著下降,与C组差异无统计学意义(图3B~D)。提示糖尿病肾病大鼠肾组织中AMPK活性被抑制,导致其下游mTOR信号通路分子(包括peEF2K、p-4EBP1等)活化,促使细胞外基质蛋白合成增加;引入外源性有活性的AMPK,可能通过抑制mTOR信号通路活化,从而减少基质蛋白合成,缓解基质沉积,减轻肾脏损害。
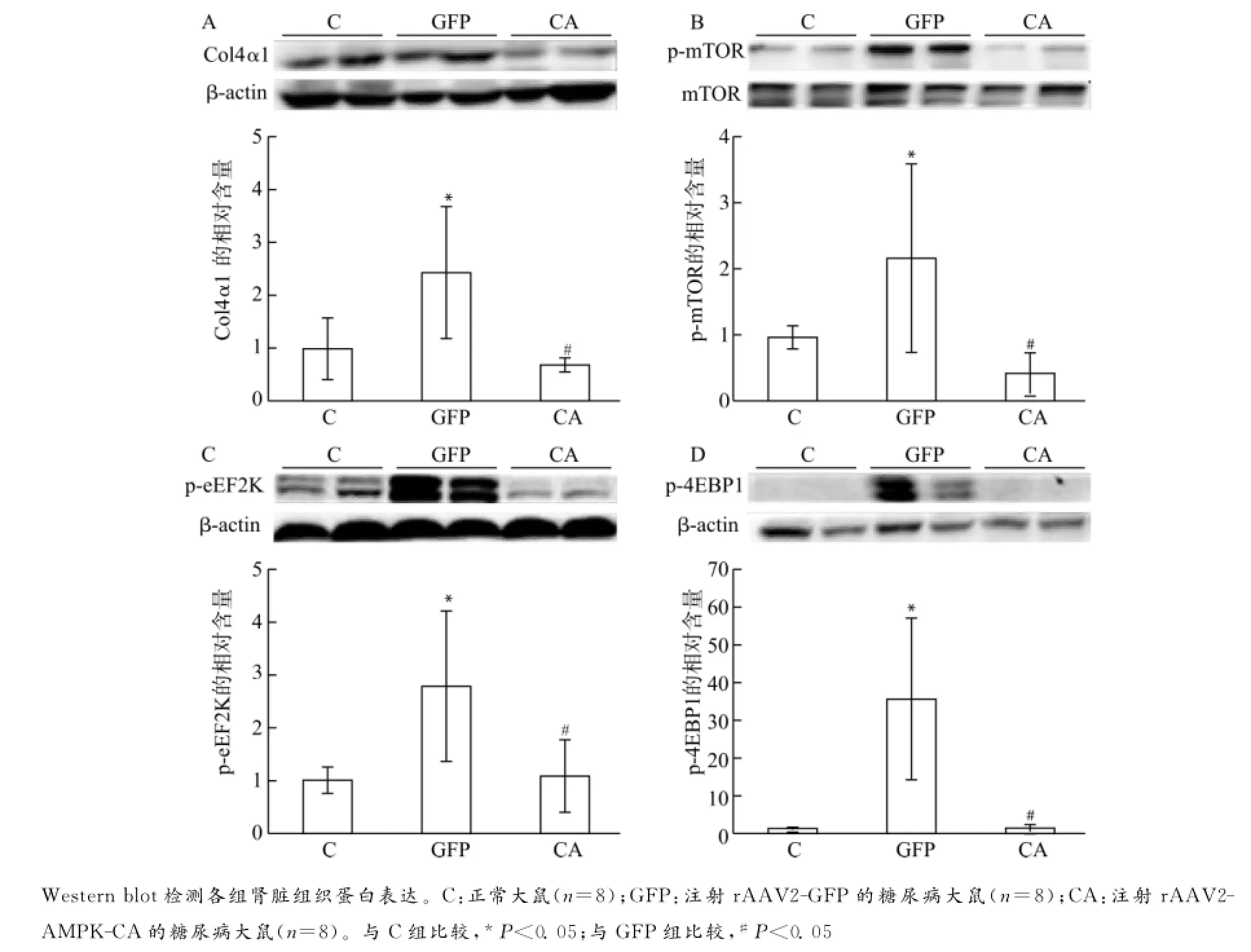
图3 rAAV2-AMPK-CA抑制mTOR信号通路降低Col4α1蛋白表达Fig.3 rAAV2-AMPK-CA suppressed the protein expression of Col4α1by inhibiting the mTOR signaling pathway
3 讨论
糖尿病肾病发病机制复杂,与基因、代谢、血流动力学等因素改变有关,其主要的病理学特征是肾小球肥大和细胞外基质沉积。细胞外基质过度合成和进行性沉积导致肾小球硬化和肾间质纤维化,最终发展至肾脏功能衰竭。蛋白质的合成,尤其是mRNA的翻译需要消耗大量能量,AMPK作为重要的能量调节器,激活后能够调控mRNA翻译并抑制蛋白质的合成。之前也有研究发现,白藜芦醇可以通过激活AMPK的活性而降低肾小球上皮细胞中纤维连接蛋白的合成,硫化氢(H2S)可以通过激活AMPK信号分子而抑制高糖诱导的肾小管上皮细胞外基质的合成[78]。因此,AMPK可能在缓解糖尿病基质蛋白沉积中起到重要作用。
本实验中,我们通过尾静脉注射小剂量STZ加高糖高脂饮食成功地构建了糖尿病大鼠模型,糖尿病大鼠体内p-AMPK和p-ACC表达水平大大降低;而将rAAV2介导的持续激活型AMPK-CA基因导入糖尿病大鼠体内,p-ACC的表达水平又有所升高,表明AMPK-CA基因能够在糖尿病大鼠体内稳定地表达,显著增加AMPK的总活性,可以用于后续AMPK对糖尿病肾病保护作用机制研究。此外,我们还发现GFP组大鼠肾脏细胞外基质FN、Col1α1、Col4α1、Col4α5和lamininγ1mRNA表达水平明显增高,Col4α1蛋白升高趋势与其mRNA变化趋势相一致。转染rAAV2-AMPK-CA后Col4α1、Col4α5、Fn mRNA和Col4α1蛋白表达水平显著降低。大鼠肾脏的形态学分析也提示糖尿病大鼠肾脏系膜基质沉积,肾脏肥大较严重,给予AMPK-CA基因治疗后基质沉积,肾脏肥大得到一定改善。说明AMPK可以抑制细胞外基质的合成,缓解肾脏肥大。
mTOR作为细胞内重要的信号通路,能够调节蛋白质合成起始和延长阶段中一些关键分子如核糖体S6蛋白激酶(S6K),起始因子4E结合蛋白1(4EBP1)和真核延伸因子激酶2(eEF2K),控制蛋白质的合成,其活性改变对糖尿病肾脏结构改变,包括肾小球肥大,基底膜增厚及细胞外基质沉积也起着重要的作用[3,7,9]。AMPK的大多数生物学作用是通过抑制mTOR信号通路来实现的。事实也表明了抑制LKB1/AMPK信号可以引起mTOR/p70 S6K信号通路的活化从而引起心脏肥大和心功能失常[1011];AMPK通过抑制mTOR信号通路而抑制肌肉组织中蛋白的合成[4]。本实验结果发现糖尿病组肾脏组织中mTOR信号通路活化,p-mTOR、p-eEF2K、p-4EBP1蛋白分子的磷酸化水平明显升高,但经AMPK-CA基因治疗后mTOR通路中的信号分子的磷酸化水平又明显降低。这些动物体内实验结果提示AMPK可通过mTOR信号通路抑制蛋白质合成,减少基质沉积,缓解肾脏肥大。
综上所述,AMPK通过抑制mTOR信号通路减轻细胞外基质沉积,缓解肾脏肥大,对糖尿病肾脏疾病的发生发展具有保护作用。AMPK及其信号通路极有可能成为治疗糖尿病的一个新的药理学靶点。
[1] Gonzalez Suarez M L,Thomas D B,Barisoni L,et al.Diabetic nephropathy:Is it time yet for routine kidney biopsy[J].World J Diabetes,2013,4(6):245-255.
[2] Stein S C,Woods A,Jones N A,et al.The regulation of AMP-activated protein kinase by phosphorylation[J].Biochem J,2000,345(3):437-443.
[3] Lee M J,Feliers D,Mariappan M M,et al.A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy[J].Am J Physiol Renal Physiol,2007,292(2):F617-F627.
[4] Bolster D R,Crozier S J,Kimball S R,et al.AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin(mTOR)signaling[J].J Biol Chem,2002,277(27):23977-23980.
[5] Hardie D G.AMPK:a target for drugs and natural products with effects on both diabetes and cancer[J].Diabetes,2013,62(7):2164-2172.
[6] LüZ M,Liu Y,Zhang P J,et al.The role of AMPK alpha in high-glucose-induced dysfunction of cultured rat mesangial cells[J].Ren Fail,2012,34(5):616-621.
[7] Lee M J,Feliers D,Sataranatarajan K,et al.Resveratrol ameliorates high glucose-induced protein synthesis in glomerular epithelial cells[J].Cell Signal,2010,22(1):65-70.
[8] Lee H J,Mariappan M M,Feliers D,et al.Hydrogen sulfide inhibits high glucose-induced matrix protein synthesis by activating AMP-activated protein kinase in renal epithelial cells[J].J Biol Chem,2012,287(7):4451-4461.
[9] Ding D F,You N,Wu X M,et al.Resveratrol attenuates renal hypertrophy in early-stage diabetes by activating AMPK[J].Am J Nephrol,2010,31(4):363-374.
[10] 冀倩倩,李永霞,金文敏,等.糖原合成酶激酶-3α/β在糖尿病肾病小鼠肾组织中的分布和表达[J].华中科技大学学报:医学版,2014,43(2):130-136.
[11] Ikeda Y,Sato K,Pimentel D R,et al.Cardiac-specific deletion of lkb1leads to hypertrophy and dysfunction[J].J Biol Chem,2009,284(51):35839-35849.
(2014-08-27 收稿)
AMP-activated Protein Kinase Alleviates the Accumulation of Renal Extracellular Matrix in Diabetic Rats through Inhibiting mTOR Signaling Pathway
Luo Xia,Deng Lingyan,Xu Wenjuan et al
Department of Laboratory Medicine,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To investigate the protective effect of adenosine 5’-monophosphate(AMP)-activated protein kinase(AMPK)on the kidneys of diabetic rats and the involved mechanism after recombinant adeno-associated viruses(rAAVs)encoding constitutively active AMPK-CA(AMPKα1312,T172D)were injected into the diabetic rat models(via tail veins)which were established by using streptozocin(STZ)as well as diets enriched in both glucose and fat.Methods A total of 24male Wistar rats were randomly divided into normal control(n=8)and experimental groups(n=16).Rats in the experimental group were fed on high-glucose and high-fat diets and were injected with STZ to induce diabetes mellitus(DM).They were allocated to two subgroups randomly after 8weeks.Diabetic rats in the two subgroups were injected with rAAV2expressing AMPK-CA gene(CA subgroup)or GFP gene(GFP subgroup,as controls)through tail veins.Rats were killed and the kidneys removed after another 12weeks.PAS staining was performed to evaluate the renal pathological changes.The expression of extracellular matrix mRNA was detected by Real-time PCR and protein levels of collagenⅣα1(Col4α1),AMPK,p-AMPK,phospho-acetyl-CoA carboxylase(p-ACC),mammalian target of rapamycin(mTOR),p-mTOR and its downstream targets were measured by Western blot.Results The expressions of p-AMPK and p-ACC proteins were significantly declined in GFP subgroup compared with normal control group.rAAV2-AMPK-CA treatment could elevate p-ACC expression and improve the pathological changes of diabetic nephropathy(kidney weight/body weight,mean glomerular volume,mesangial matrix area)in comparison with GFP subgroup.Furthermore,rAAV2-AMPK-CA reversed the mRNA expressions of FN,Col4α1and Col4α5and protein levels of Col4α1,p-mTOR,p-eEF2Kand p-4EBP1which were increased in the GFP group.Conclusion rAAV2-AMPK-CA gene treatment could protect the kidney in diabetic rats by increasing the activity of AMPK in the kidney of diabetic rats,inhibiting the ac-tivation of mTOR signaling pathway and alleviating the extracellular matrix deposition.
adenosine 5’-monophosphate-activated protein kinase(AMPK); diabetic nephropathy; mammalian target of rapamycin(mTOR)
R692.3
10.3870/j.issn.1672-0741.2015.01.002
*国家自然科学基金(青年基金)资助项目(No.81000331)
罗 霞,女,1988年生,医学硕士,E-mail:luoxiaha@126.com
△通讯作者,Corresponding author,E-mail:chengliming2002@163.com
