宫颈癌患者外周血髓源性抑制细胞的比例及其临床意义*
2015-06-05韩凌斐郭晓青胡家昌孔繁飞何拉曼朱建龙
韩凌斐,郭晓青,胡家昌,孔繁飞,何拉曼,李 芳,朱建龙,孙 静
同济大学附属第一妇婴保健院妇科,上海 200040
宫颈癌患者外周血髓源性抑制细胞的比例及其临床意义*
韩凌斐,郭晓青,胡家昌,孔繁飞,何拉曼,李 芳,朱建龙△,孙 静△
同济大学附属第一妇婴保健院妇科,上海 200040
目的 比较分析髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)在健康人、宫颈上皮内瘤变患者、宫颈癌患者及其术后外周血中的比例,初步探讨其临床意义。方法 采用流式细胞术检测36例宫颈癌患者、52例宫颈上皮内瘤变患者及20例健康志愿者外周血中MDSCs、调节性T细胞(Treg)的比例。检测20例宫颈癌患者术前术后外周血中MDSCs、Treg的比例及MDSCs产生的精氨酸酶和一氧化氮(NO)的变化情况。结果 宫颈癌组外周血中MDSCs、Treg的比例最高,分别为[(3.85±0.85)%,(7.82±1.04)%],其次是宫颈上皮内瘤变组[(1.52±0.53)%,(3.32± 0.48)%],健康对照组最低[(0.61±0.17)%,(2.02±0.26)%],各组间差异均有统计学意义(均P<0.05);手术后,患者外周血中MDSCs、Treg的比例明显下降,MDSCs产生的精氨酸酶和NO下降,与术前比较差异均有统计学意义(均P<0.05)。结论 外周血MDSCs比例的升高可能与肿瘤免疫功能低下及宫颈癌的发生发展密切相关。
髓源性抑制细胞; 肿瘤逃逸; 宫颈肿瘤
全球范围内宫颈癌发病率在女性恶性肿瘤中居第2位,仅次于乳腺癌,占所有女性恶性肿瘤发病的13%。据世界卫生组织(WHO)报道,全世界每年大约有50万宫颈癌新发病例,其中80%的病例发生在发展中国家[1]。我国每年新发病例14万,约占世界宫颈癌新发病例的28.8%,为我国妇女生殖道恶性肿瘤的第1位[2]。目前美国食品与药品管理局(FDA)批准的宫颈癌预防性疫苗已经上市,但该疫苗对宫颈癌前病变和患有宫颈癌的妇女无效,其中重要的原因就是肿瘤抗原产生的免疫逃避现象抑制了机体免疫功能,使肿瘤免疫治疗效果欠佳。因此,如何重新激活机体免疫系统,是目前众多研究者们关注的重点。
髓系来源的抑制细胞(myeloid-derived suppressor cells,MDSCs)是近年研究发现的一类具有免疫调节功能的免疫细胞亚群,是参与肿瘤免疫逃逸和免疫耐受的重要机制之一。许多研究表明,多种肿瘤患者外周血和肿瘤组织内出现MDSCs的聚集,这群细胞在肿瘤的免疫逃逸机制中发挥重要作用[3]。但目前国内外尚缺乏宫颈癌患者MDSCs的研究报道,本研究以健康志愿者、宫颈上皮内瘤变及宫颈癌患者外周血为样本,观测MDSCs、Treg比例变化,初步探讨其临床意义。
1 资料与方法
1.1 研究对象
收集2013年11月至2014年8月期间宫颈癌、宫颈上皮内瘤变患者及健康志愿者外周血标本共108份。根据受试者病理学检查结果,宫颈癌组36例(31例鳞癌,5例腺癌),宫颈上皮内瘤变组52例(CINⅠ16例,CINⅡ15例,CINⅢ21例),健康组20例。所有受试对象均为首次诊断且未行治疗,并已排除伴有其他疾病及服用过特殊药物。
1.2 主要试剂
PE标记的鼠抗人CD33抗体购自BD公司;FITC标记的鼠抗人CD11b抗体、PECy5标记的鼠抗人HLA-DR抗体、人Treg染色试剂盒及同型对照抗体均购自美国eBioscience公司。精氨酸检测试剂盒、一氧化氮(Nitric Oxide,NO)检测试剂盒购自美国BioAssay Systems公司。
1.3 流式细胞术检测
患者于治疗前后分别用抗凝管留取静脉血4 mL用于流式细胞术检测。MDSCs检测:取静脉血100μL置于流式管中。每管加入荧光标记抗体HLA-DR-PECy5、CD33-PE、CD11b-FITC各2μL,2~8℃孵育30~60min。加入2mL红细胞裂解液,避光4℃孵育30min,PBS洗涤后适量流式染色缓冲液重悬染色细胞并行流式细胞术分析。Treg检测:取2mL静脉血用淋巴细胞分离液收集单核细胞,取100μL细胞悬液,细胞数约为l×106个,按人Treg染色试剂盒说明步骤操作,透化缓冲液洗涤后适量流式染色缓冲液重悬染色细胞并行流式细胞术分析。
1.4 分选CD11 b+CD33+HLA-DR-的MDSCs
收集患者静脉血30mL,分离外周血单个核细胞后用CD11b-FITC,CD33-PE,HLA-DR-PECy5标记染色,BD InfluxTM流式细胞分选仪分选CD11b+CD33+HLA-DR-的MDSCs。
1.5 精氨酸酶活性测定
收集分选的2组MDSCs,离心,去上清,加入100μL的细胞裂解液裂解细胞,将裂解液12 000r/min,4℃离心10min,取上清进行精氨酸酶(Arginase)活性的测定,按试剂盒说明步骤操作后,562 nm测定各组反应的吸光度值(A)。按照公式精氨酸酶活性(U/L)=(A样本-A对照)/(A尿素-A空白)× 10.4计算样品精氨酸酶活性。
1.6 一氧化氮浓度测定
收集分选的2组MDSCs于1.5mL离心管中,置于冰上,于4℃预冷的PBS液洗涤2次,收集细胞沉淀,置于冰上。向细胞沉淀中加入150μL细胞裂解液,冰上裂解30min。按试剂盒说明操作后,540 nm测定各组的吸光度值(A)。绘制标准曲线,按照公式c(μmol/L)=(A样本-A空白)/0.003计算样品NO浓度。
1.7 统计学处理
2 结果
2.1 各组MDSCs占外周血单个核细胞(PBMC)比例的变化
如图1所示,术前宫颈癌组MDSCs比例为(3.85±0.85)%,高于宫颈上皮内瘤变组(1.52± 0.53)%及健康对照组(0.61±0.17)%,而宫颈上皮内瘤变组MDSCs比例又高于健康对照组,各组间差异均有统计学意义(P<0.05或P<0.01)。
2.2 各组Treg占PBMC比例的变化
如图2所示,术前宫颈癌组Treg比例为(7.82 ±1.04)%,明显高于宫颈上皮内瘤变组(3.32± 0.48)%及健康对照组(2.02±0.26)%,差异均有统计学意义(P<0.05或P<0.01),而宫颈上皮内瘤变组Treg比例高于健康对照组,差异有统计学意义(P<0.05)。
2.3 外周血MDSCs比例与Treg比例的关系
采用Pearson相关分析发现,外周血中MDSCs比例与Treg比例呈正相关(r=0.748,P<0.01)。
2.4 手术治疗对宫颈癌患者外周血MDSCs及Treg的影响

图1 宫颈上皮内瘤变、宫颈癌患者及健康对照者外周血MDSCs比例的比较Fig.1 Comparison of the proportion of MDSCs in the peripheral blood among CIN patients,cervical cancer patients and healthy volunteers

图2 宫颈上皮内瘤变、宫颈癌患者及健康对照者外周血Treg比例的比较Fig.2 Comparison of the proportion of Treg in the peripheral blood among CIN patients,cervical cancer patients and healthy volunteers
如图3所示,本研究检测了20例宫颈癌患者术前及术后30d左右外周血MDSCs及Treg的比例变化。手术前该20例患者MDSCs及Treg细胞占PBMC的比例分别为(3.34±0.52)%,(5.74± 0.13)%,而手术后MDSCs及Treg比例分别下降为(0.73±0.16)%和(2.33±0.45)%,差异均具有统计学意义(P<0.05或P<0.01)。
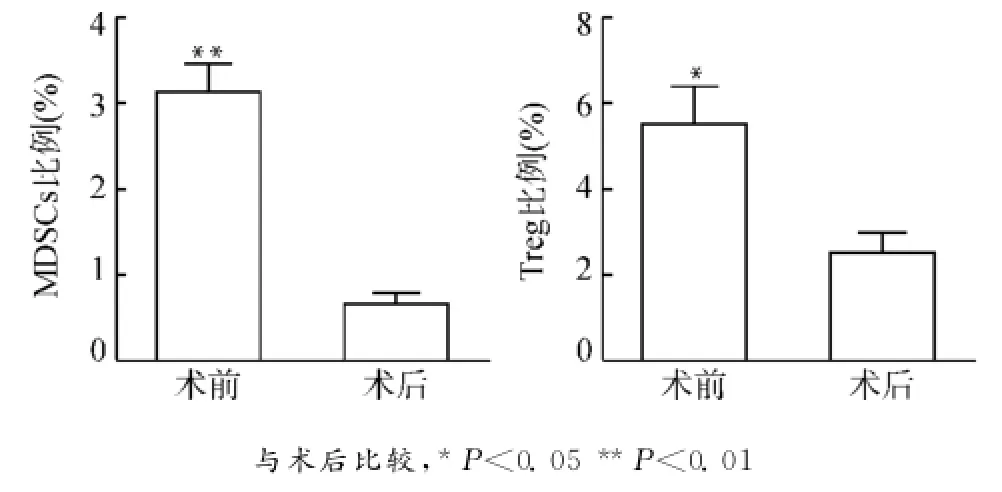
图3 宫颈癌患者术前术后外周血MDSCs、Treg比例的比较Fig.3 Comparison of the proportions of MDSCs and Treg in the peripheral blood in cervical patients before and after operation
2.5 精氨酸酶活性及NO浓度检测结果
精氨酸酶活性及NO浓度是体现肿瘤相关MDSCs免疫抑制功能的重要指标。如图4所示,精氨酸酶活性检测结果显示,术前宫颈癌组MDSCs所产生的精氨酸酶为(28.48±4.38)U/L,术后组MDSCs精氨酸酶为(8.42±1.92)U/L,较前者显著降低,两组间比较差异有统计学意义(P<0.05)。NO检测结果显示术前宫颈癌组MDSCs中NO浓度为(132.45±27.00)μmol/L,术后组MDSCs中NO浓度为(34.78±9.54)μmol/L,两组间差异有统计学意义(P<0.05)。

图4 宫颈癌患者术前术后外周血MDSCs精氨酸酶活性及NO浓度比较Fig.4 Comparison of argininase activity and nitric oxide production in MDSCs in the peripheral blood in cervical patients before and after operation
3 讨论
虽然机体的免疫系统能对某些肿瘤抗原产生免疫应答,并消除部分肿瘤细胞,但仍有一部分原发性肿瘤在宿主体内生长,并易于转移和复发,这些肿瘤能通过多种途径抑制机体的免疫应答,逃避机体免疫系统的攻击,实现肿瘤免疫逃逸[4]。近年来的研究发现,MDSCs在肿瘤组织、淋巴结或血液循环中的聚集是肿瘤逃避免疫攻击的一个重要机制[5],为获得有效的免疫治疗效果,必须消除这些免疫抑制细胞的免疫抑制作用。
MDSCs来源于骨髓祖细胞和未成熟髓细胞,是一类未成熟、异质性的细胞群体,包括髓系前体细胞、不成熟的粒细胞、单核巨噬细胞、树突状细胞等,该群细胞约占髓系细胞的1%~5%,可以通过多种途径抑制机体的获得性和天然抗肿瘤免疫,使肿瘤细胞逃避机体的免疫监视和攻击,促进肿瘤发展[4,6]。MDSCs首先从骨髓募集到外周,并在外周被激活后才能发挥促肿瘤免疫逃逸功能。在肿瘤、炎性反应等病理情况下,均可以检测到MDSCs在体内的扩增;在肿瘤患者的外周血及肿瘤组织中MDSCs比例均有大幅度的增加,贯穿肿瘤发生的整个过程,且与肿瘤的大小和恶性程度有一定的相关性[7]。
MDSCs可通过多种机制抑制免疫应答,包括产生精氨酸酶、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、活性氧(reactive oxygen species,ROS)和多种可溶性抑制因子,激活和扩增Treg,部分机制已在癌症患者中得到证实。活化的MDSCs能促进2种参与L-精氨酸代谢的酶的产生和增强其活性,这2种酶包括诱导NO产生的iNOS和分解微环境中精氨酸的精氨酸酶1(ARG-1),通过消耗L-精氨酸,造成精氨酸饥饿的内环境,从而抑制抗原提呈细胞、T淋巴细胞增殖,在免疫应答和T细胞功能调节上发挥作用。此外,MDSCs还能够诱导Treg的产生,研究发现多种实体肿瘤和血液恶性肿瘤患者体内Treg比例皆明显增高,且与患者肿瘤进展程度和预后呈负相关,是肿瘤免疫逃逸和抗肿瘤免疫治疗难以成功的重要原因之一[89]。
在小鼠体内,MDSCs被定义为共同表达髓系抗原Gr-1和CD11b的细胞。根据Ly6C和Ly6G的表达,Gr-1+CD11b+细胞可进一步分为粒细胞样MDSCs和单核细胞样MDSCs两种亚型[10]。人MDSCs缺少特异性标志物,没有与小鼠Gr-1对等的抗原,通常采用各种表面分子(CD14、CD15、CD34、CD11b、CD33、Lin和HLA-DR等)的组合界定,因此在不同癌症患者中得到了各种MDSCs表型[3]。目前普遍认为,人MDSCs表达共同髓系标志物CD33,但不表达成熟髓系标志物HLA-DR[11]。与小鼠一样,人MDSCs也可分为粒细胞样和单核细胞样两个主要亚群,单核细胞样MDSCs表达CD14,而粒细胞样MDSCs表达CD15,两者都为HLA-DR-/lowCD33+[1213]。
随着对人MDSCs了解的增加,越来越多的注意力集中到检测肿瘤患者外周血循环MDSCs的临床意义上。但由于MDSCs在不同肿瘤患者体内的标志物并不完全相同,对机体免疫调节机制也不是十分清楚。而目前国内外尚缺乏关于宫颈癌MDSCs的研究报道。本研究尝试采用较严格的人MDSCs标志物(HLA-DR-CD33+CD11b+),初步探讨这群细胞在宫颈癌及癌前病变患者中诱导免疫逃逸的作用。本研究结果显示,在宫颈上皮内瘤变、宫颈癌患者外周血中MDSCs比例较健康者均有大幅度的增加,可能是肿瘤细胞产生的细胞因子诱导MDSCs前体细胞大量进入外周血并且增殖、分化,抑制机体免疫功能,使机体不能有效地清除体内的肿瘤细胞。
MDSCs行使功能需要经历两个阶段,第一个阶段是MDSCs的扩增和集聚,第二个阶段是在肿瘤因子的持续作用下MDSCs活化形成具有免疫抑制剂功能的细胞。MDSCs的扩增和活化主要受肿瘤细胞、肿瘤基质细胞分泌的多种因子的调节[1416]。本研究分析比较20例宫颈癌患者手术前后外周血MDSCs比例的变化发现,手术后患者外周血的MDSCs比例相比术前明显降低,提示肿瘤负荷除去以后,促使MDSCs前体细胞进入外周血的诱导因素随之减弱,MDSCs数量逐渐降低;进一步比较术前术后MDSCs细胞所产生的精氨酸酶活性及NO后发现,术后MDSCs产生的精氨酸酶活性及NO较术前显著降低,提示宫颈癌患者的MDSCs可能同样通过调控精氨酸酶活性及NO水平而发挥免疫抑制功能,这群细胞的免疫抑制功能受体内肿瘤负荷的影响显著,当肿瘤负荷降低时,其免疫抑制功能随之下降。
宫颈癌的发生发展是一个多阶段、多步骤的复杂过程,而机体的免疫系统与这一过程密切相关,因此免疫治疗是最有潜力的一种辅助治疗措施。近年关于肿瘤免疫和免疫逃逸机制的深入探讨发现,免疫逃逸可能是影响免疫治疗疗效的主要原因。由于MDSCs在机体免疫调控中的负向调控作用至关重要,我们有理由相信靶向MDSCs进行肿瘤免疫治疗的新策略将会给宫颈肿瘤患者带来福音。
[1] Ferlay J,Shin H R,Bray F,et al.Estimates of worldwide burden of cancer in 2008:Globocan 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] Parkin D M,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2000[J].Int J Cancer,2001,94(2): 153-156.
[3] Almand B,Clark J I,Nikitina E,et al.Increased production of immature myeloid cells in cancer patients:a mechanism of immunosuppression in cancer[J].J Immunol,2001,166(1):678-689.
[4] Nagaraj S,Gabrilovich D I.Tumor escape mechanism governed by myeloid-derived suppressor cells[J].Cancer Res,2008,68(8):2561-2563.
[5] Gabrilovich D I,Ostrand-Rosenberg S,Bronte V.Coordinated regulation of myeloid cells by tumours[J].Nat Rev Immunol,2012,12(4):253-268.
[6] Marigo I,Dolcetti L,Serafini P,et al.Tumor-induced tolerance and immune suppression by myeloid derived suppressor cells[J].Immunol Rev,2008,222(1):162-179.
[7] Montero A J,Diaz-Montero C M,Kyriakopoulos C E,et al.Myeloid-derived suppressor cells in cancer patients:a clinical perspective[J].J Immunother,2012,35(2):107-115.
[8] Zoso A,Mazza E M,Bicciato S,et al.Human fibrocytic myeloid-derived suppressor cells express IDO and promote tolerance via Treg-cell expansion[J].Eur J Immunol,2014,44(11):3307-3319.
[9] Yang Z,Zhang B,Li D,et al.Mast cells mobilize myeloid-derived suppressor cells and Treg cells in tumor microenvironment via IL-17pathway in murine hepatocarcinoma model[J].PLoS One,2010,5(1):e8922.
[10] Martin F,Apetoh L,Ghiringhelli F.Role of myeloid-derived suppressor cells in tumor immunotherapy[J].Immunotherapy,2012,4(1):43-57.
[11] Kusmartsev S,Su Z,Heiser A,et al.Reversal of myeloid cellmediated immunosuppression in patients with metastatic renal cell carcinoma[J].Clin Cancer Res,2008,14(24):8270-8278.
[12] Solito S,Falisi E,Diaz-Montero C M,et al.A human promyelocytic-like population is responsible for the immune suppression mediated by myeloid-derived suppressor cells[J].Blood,2011,118(8):2254-2265.
[13] Raychaudhuri B,Rayman P,Ireland J,et al.Myeloid-derived suppressor cell accumulation and function in patients with newly diagnosed glioblastoma[J].Neuro Oncol,2011,13(6): 591-599.
[14] 石小燕,张亚东,赵良平,等.早期宫颈癌组织中VEGF-C与COX-2的表达及相关性[J].华中科技大学学报:医学版,2013,42(3):307-310.
[15] Dolcetti L,Marigo I,Mantelli B,et al.Myeloid-derived suppressor cell role in tumor-related inflammation[J].Cancer Lett,2008,267(2):216-225.
[16] Condamine T,Gabrilovich D I.Molecular mechanisms regulating myeloid-derived suppressor cell differentiation and function[J].Trends Immunol,2011,32(1):19-25.
(2014-09-15 收稿)
High Proportion of Myeloid-derived Suppressor Cells in the Peripheral Blood of Patients with Cervical Cancer and Its Clinical Significance
Han Lingfei,Guo Xiaoqing,Hu Jiachang et al
Department of Gynecology,Shanghai First Maternity and Infant Hospital,Tongji University School of Medicine,Shanghai 200040,China
Objective To investigate the proportion of circulating myeloid-derived suppressor cells(MDSCs)in the peripheral blood of healthy volunteers,patients with cervical intraepithelial neoplasia,patients with cervical cancer before and after operation.Methods Flow cytometry was used to evaluate the proportion of MDSCs and Treg in the peripheral blood of 36patients with cervical cancer,52patients with intraepithelial neoplasia and 20healthy people.The proportions of MDSCs and Treg were evaluated in 20patients with cervical cancer before and after operation as well as the changes of argininase activity and nitric oxide(NO)production.Results The proportions of circulating MDSCs and Tregs were(3.85±0.85)%and(7.82±1.04)%,respectively,in patients with cervical cancer,which was highest among the subjects.Those in patients with cervical intraepithelial neoplasia were(1.52±0.53)%and(3.32±0.48)%,respectively,significantly lower than those in cervical cancer patients but much higher than in healthy volunteers[(0.61±0.17)%,(2.02±0.26)%].The differences between groups were statistically significant(P<0.05).The proportions of MDSCs and Treg were conspicuously decreased,and the argininase activity and nitric oxide production were also reduced in patients with cervical cancer after the operation when compared with those before the operation.The differences were statistically significant(P<0.05).Conclusion The increased proportion of MDSCs in the peripheral blood of patients with cervical cancer may closely correlate with the poor antitumor immune function of patients and the development of cervical cancer.
myeloid-derived suppressor cells; tumor escape; cervical cancer
R737.33
10.3870/j.issn.1672-0741.2015.01.006
*国家自然科学基金资助项目(No.81001153,No.81372305);上海市青年科技启明星计划资助项目(No.11QA1405200);上海市卫生局资助项目(No.2010Y150,No.20114150,No.20124111);上海市自然科学基金资助项目(No.15ZR1433300)
韩凌斐,男,1979年生,主治医师,E-mail:lingfeihan@126.com
△通讯作者,Corresponding author,孙静,E-mail:sunjing@126.com;朱建龙,E-mail:zhujl999@126.com
