HPV血清学阳性协同ATM基因的变体增加饮酒人群中食管鳞状细胞癌的发病风险*
2015-06-05于倩倩熊慧华胡广原
于倩倩,邱 红,熊慧华,李 雯,杨 菊,胡广原
华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030
HPV血清学阳性协同ATM基因的变体增加饮酒人群中食管鳞状细胞癌的发病风险*
于倩倩,邱 红,熊慧华,李 雯,杨 菊,胡广原△
华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030
目的 探讨毛细血管扩张性共济失调症突变(ATM)基因的多态性和人乳头瘤病毒16(HPV16)感染对于食管鳞状细胞癌发病风险的协同作用。方法 对303例食管鳞状细胞癌患者和304例无癌对照者的外周血标本进行ATM基因分型和HPV16的血清学检测。ATM的单核苷酸多态性(SNP)位点(rs373759,rs189037)通过荧光定量Taq-Man技术进行基因分型,HPV16的血清学状态通过酶联免疫吸附实验(ELISA)检测。危险因素与食管鳞状细胞癌发病风险的相关性采用非条件Logistic回归模型进行统计分析。结果 在饮酒人群中,rs373759的基因型与食管鳞状细胞癌的发病风险存在明显的相关性(Ptrend=0.006),相比于CC型,CT型的发病风险提高了1.82倍(95%CI 1.10,3.01),TT型的发病风险提高了2.50倍(95%CI1.15,5.45);相比于rs189037的GG基因型,rs189037AG/AA型人群中食管鳞状细胞癌的发病风险有轻度提高(OR值1.64;95%CI 1.00,2.68)。HPV16血清学阳性是饮酒人群(OR值1.92;95%CI1.20,3.07)和吸烟人群(OR值1.96;95%CI1.26,3.50)中食管鳞状细胞癌的易感因素。rs373759的基因型和HPV16血清学状态对于食管鳞状细胞癌的发病风险有交互作用(PG×E=0.009,OR值2.04;95%CI 1.19,3.48)。相比于HPV16阴性且rs373759CC型的人群,HPV阴性且rs373759CT/TT型的人群发病风险增高(OR值2.43;95%CI 1.25,4.72),HPV阳性且rs373759CC型的人群发病风险进一步增高(OR值2.51;95%CI 1.23,5.13),HPV16阳性且rs373759CT/TT型的人群食管鳞状细胞癌发病风险增加了3.83倍(95%CI 1.93,7.61)。结论 HPV16血清学阳性协同ATM rs373759的突变基因型增加了饮酒人群中食管鳞状细胞癌的发病风险。
食管鳞状细胞癌; ATM; 基因多态性; HPV16; 饮酒
Key words esophageal squamous cell carcinoma; ATM; polymorphism; HPV16; drinking
DNA损伤修复和细胞周期调控的紊乱在肿瘤的发病过程中扮演着重要的角色[1]。毛细血管扩张性共济失调症突变(ATM)基因作为下游多个细胞周期检测点的触发因素,掌控着基因组稳定性的命脉[2]。人乳头瘤病毒(HPV)可以与细胞周期通路上相关的位点结合,引起凋亡和(或)转录通路的功能异常[34]。ATM的基因多态性和HPV的感染均与多种肿瘤的发病相关[58]。我们以往的研究表明HPV16可协同凋亡相关的基因促进食管鳞状细胞癌的发病[9]。那么,ATM的基因多态性和HPV感染对于食管鳞状细胞癌的发病是否有协同作用?
为此,我们将在受试者人群中检测ATM的单核苷酸多态性(SNP)位点rs373759和rs189037的基因型和HPV16的血清学状态,并分析二者对食管鳞状细胞癌发病的联合作用。
1 资料与方法
1.1 研究分组
食管鳞状细胞癌病例组人群(n=303)和对照组人群(n=304)均是出生在湖北省的中国汉族人群。病例组是病理报告确诊为食管鳞状细胞癌的患者,2009至2012年期间就诊于华中科技大学同济医学院附属同济医院。病例组的排除标准包括患者存在第2原发肿瘤、原发食管以外的肿瘤、起源不明的肿瘤、或组织病理学诊断为鳞状细胞癌以外的病理类型的肿瘤。无癌对照组来源于2009至2012年期间在同济医院体检中心接受了全面健康检查的人群。304例健康对照组的受试者与病例组的受试者在年龄(±5岁)和性别的频率上匹配良好。
我们以采访的形式对受试者进行信息采集,包括年龄、性别、民族、籍贯、疾病史、家族史、吸烟史和饮酒史等。对于每天至少吸1支卷烟且至少持续1年的受试者被定义为“吸烟者”,其余为“非吸烟者”;饮酒每周至少1次且持续1年以上的受试者被定义为“饮酒者”,其余为“非饮酒者”。
本研究方案得到同济医院伦理委员会的批准,所有受试者均签署了知情同意书。我们在征得受试者同意的情况下每人留取了2mL的新鲜血液标本。
1.2 基因分型
基因组DNA采用日本FUJIFILM公司的QG DNA全血试剂盒从外周血标本中提取,并储存在-80℃冰箱。使用7900HT型实时荧光定量PCR仪(Applied Biosystems,Foster City,CA,USA)通过TaqMan方法对ATM的SNP(rs373759和rs189037)进行基因分型,具体方法见既往的研究[10]。rs373759和rs189037的探针从Applied Biosystems公司订购,基因分型结果应用SDS 2.3等位基因分析软件(Applied Biosystems)分析。将基因分型结果随机抽样10%进行验证,得到100%的重复率。
1.3 HPV16血清学检测
考虑HPV16是食管鳞状细胞癌患者中最常感染的HPV亚型[8],我们按照武汉华美公司HPV16 L1-衣壳抗体酶联免疫吸附试验(ELISA)试剂盒说明书,检测所有受试者血清中抗HPV16L1-衣壳蛋白的免疫球蛋白G(IgG)的水平。阳性结果的判定参照说明书的标准。实验人员仅负责检测打乱编码的样品,对样品来自病例组还是对照组并不知晓。随机抽取5%的样品复核,得到100%的一致率。
1.4 统计分析方法
应用SPSS 16.0软件进行统计学分析。人口统计学特征(年龄和性别)和暴露因素(吸烟、饮酒和HPV16血清学状态)以及ATM的基因型在病例组和对照组的分布差异采用Pearsonχ2检验,比值比(OR)和95%可信区间(CI)基于单因素和多因素的Logistic回归模型来计算。ATM的基因型与食管鳞状细胞癌发病风险的潜在关系通过多因素Logistic回归来确定OR值和95%CI。不同基因型与食管鳞状细胞癌发病风险相关性的Trend检验在回归分析中调节了年龄、性别、吸烟、饮酒和HPV16血清学状态。HPV16和ATM的基因型对于食管鳞状细胞癌发病风险的联合作用在多因素Logistic回归模型中评估。变量间的交互作用采用单一交互参数的1-自由度的基于多因素Logistic回归模型的Wald检验[11]。对照组中基因型分布的Hardy-Weinberg平衡采用拟合优度的χ2检验。利用SHEsis软件对rs373759和rs189037进行连锁不平衡分析。所有显著性检验均采用双侧概率检验,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般特征和暴露因素的分布
303例食管鳞状细胞癌病例组和304例无癌对照组的人口统计学特征和暴露因素的分布见表1。在病例组中,平均年龄为(58.7±8.5)岁,且85.1%是男性;在对照组中,平均年龄为(57.8±12.0)岁,且83.2%是男性。两组年龄行t检验P=0.315,年龄按表1分组,χ2检验P<0.001;性别χ2检验P=0.516。分析时将年龄分为<51岁,51~岁和>70岁,主要参考食管鳞状细胞癌高发年龄的区间。病例组人群吸烟和饮酒的比例均高于对照组人群(吸烟70.6%vs.50.3%,P<0.001;饮酒63.0%vs.51.0%,P=0.003)。病例组HPV16血清学阳性的比例高于对照组(54.8%vs.43.4%,P=0.005;在多因素Logistic回归模型中,调节OR值1.69;95%CI 1.20,2.38)。

表1 人口统计变量和危险因素在食管鳞状细胞癌病例组和无癌对照组的分布[例(%)]Table1 Distribution of demographic variables and risk factors in ESCC group and cancer-free control group[n(%)]
2.2 在研究人群中ATM的基因型和食管鳞状细胞癌发病风险的相关性
ATM rs373759和ATM rs189037在病例组和对照组中的分布和与食管鳞状细胞癌发病风险的相关性如表2所示。rs373759和rs189037的基因型在对照组人群中的频率均符合Hardy-Weinberg平衡(rs373759,P=0.652;rs189037,P=0.920)。不论是rs373759(CC,CT和TT)还是rs189037(GG,AG和AA)的基因型在两组人群中的分布均无统计学差异(rs373759,P=0.162;rs189037,P=0.358)。rs373759的CT型和TT型的频率在病例组均高于对照组(CT型44.2%vs.44.1%;TT型13.9%vs.9.2%),但是食管鳞状细胞癌的发病风险在CT型(OR值1.27;95%CI 0.88,1.83),TT型(OR值1.55;95%CI 0.88,2.73)以及CT+TT型(OR值1.33;95%CI 0.94,1.87)的人群中均没有明显增高。rs189037的AA型的频率在病例组高于对照组(19.1%vs.14.8%),但是食管鳞状细胞癌的发病风险在AA型(OR值1.33;95%CI 0.80,2.19)的人群中没有明显增高。
2.3 在饮酒人群中ATM的基因型和HPV16血清学状态与食管鳞状细胞癌发病风险的相关性
ATM rs373759和ATM rs189037在饮酒人群中的分布和与食管鳞状细胞癌发病风险的相关性如表3所示。在饮酒人群中,rs373759的基因型在对照组和病例组中的分布有统计学差异(CC型50.5%vs.37.7%;CT型40.0%vs.47.1%;TT型9.7%vs.15.2,P=0.046),且食管鳞状细胞癌的发病风险在CT型(OR值1.82;95%CI 1.10,3.01),TT型(OR值2.50;95%CI 1.15,5.45)以及CT/TT型(OR值1.95;95%CI 1.21,3.14)的人群中均明显增高。rs189037的AG型和AA型的频率在病例组均高于对照组(AG型50.3%vs.45.2%;AA型19.9%vs.15.5%),但是差异无统计学意义(P=0.160)。相比于rs189037的GG基因型,在AG/AA型人群中食管鳞状细胞癌的发病风险有轻度提高(OR值1.64;95%CI 1.00,2.68)。同时,在饮酒人群中,HPV16血清学阳性使食管鳞状细胞癌发病风险提高(调节OR值1.92;95%CI 1.20,3.07)。
我们在非饮酒人群中也进行了类似的分析,发现rs373759和rs189037的基因型在病例组和对照组的分布无显著性差异,不同基因型与食管鳞状细胞癌的发病风险亦无相关性;HPV16的血清学状态与食管鳞状细胞癌的发病风险无相关性,数据未列出。
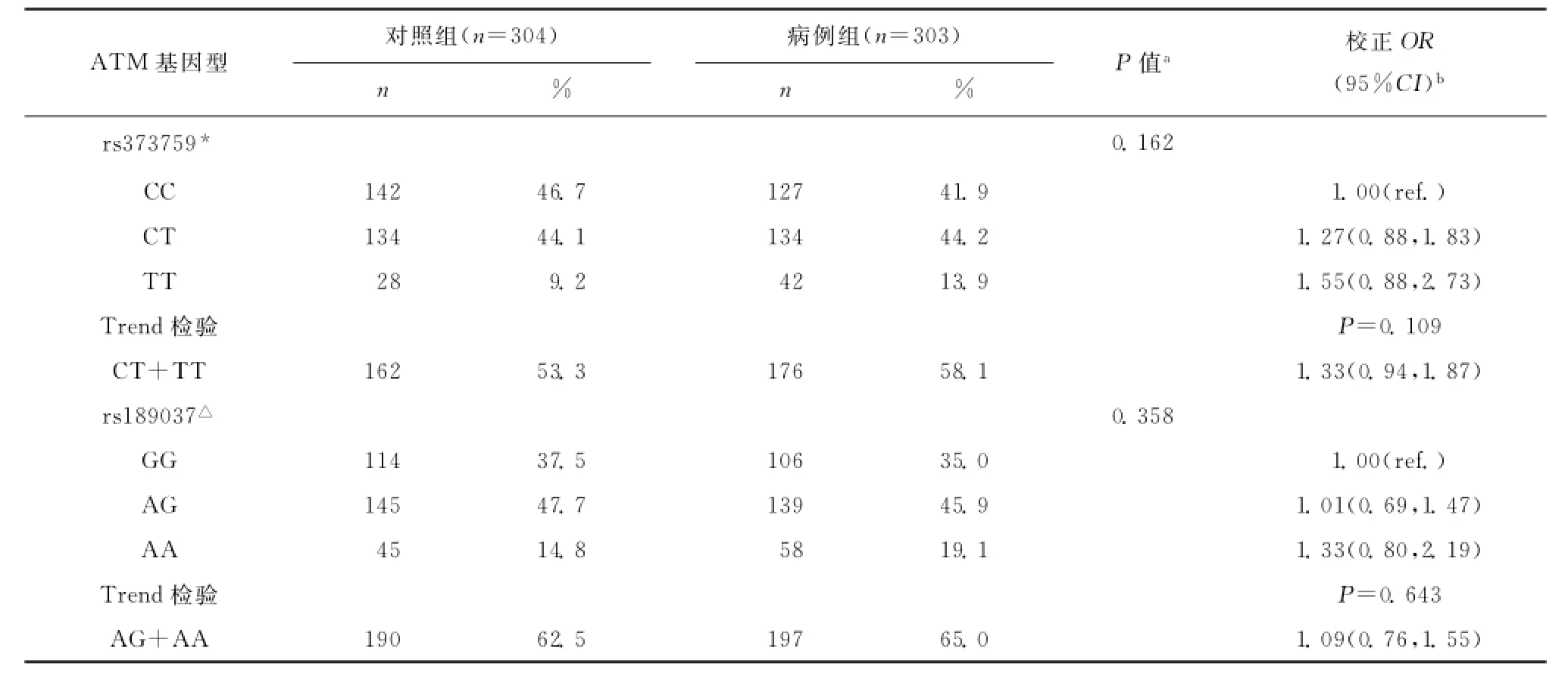
表2 ATM基因型在对照组和病例组中的分布以及与食管鳞状细胞癌发病风险的相关性Table2 Distribution of ATM genotypes in control and case groups and the association of ATM polymorphism with risk of ESCC

表3 ATM基因型和HPV16血清学状态在饮酒人群中的分布以及与食管鳞状细胞癌发病风险的相关性Table3 Distribution of ATM genotypes and HPV16serologic status and their associations with risk of ESCC in drinkers
2.4 在吸烟人群中ATM的基因型和HPV16血清学状态与食管鳞状细胞癌发病风险的相关性
如表4所示,在吸烟人群中,rs373759的CT型和TT型在病例组中的比例均高于对照组,但是分布差异无统计学意义(CT型43.5%vs.39.2%,TT型15.0%vs.11.8%,P=0.341),CT/TT型与食管鳞状细胞癌的发病风险(调节OR值1.47;95%CI 0.94,2.30)无相关性(P=0.089)。rs189037的基因型在吸烟人群中的分布无统计学差异(P=0.557),不同基因型与食管鳞状细胞癌的发病风险亦无明显相关性。然而,HPV16血清学阳性使吸烟人群的食管鳞状细胞癌的发病风险增高(调节OR值1.96;95%CI 1.26,3.05)。
在非吸烟人群中,rs373759和rs189037的基因型以及HPV16的血清学状态在病例组和对照组的分布无明显统计学差异。数据未列出。
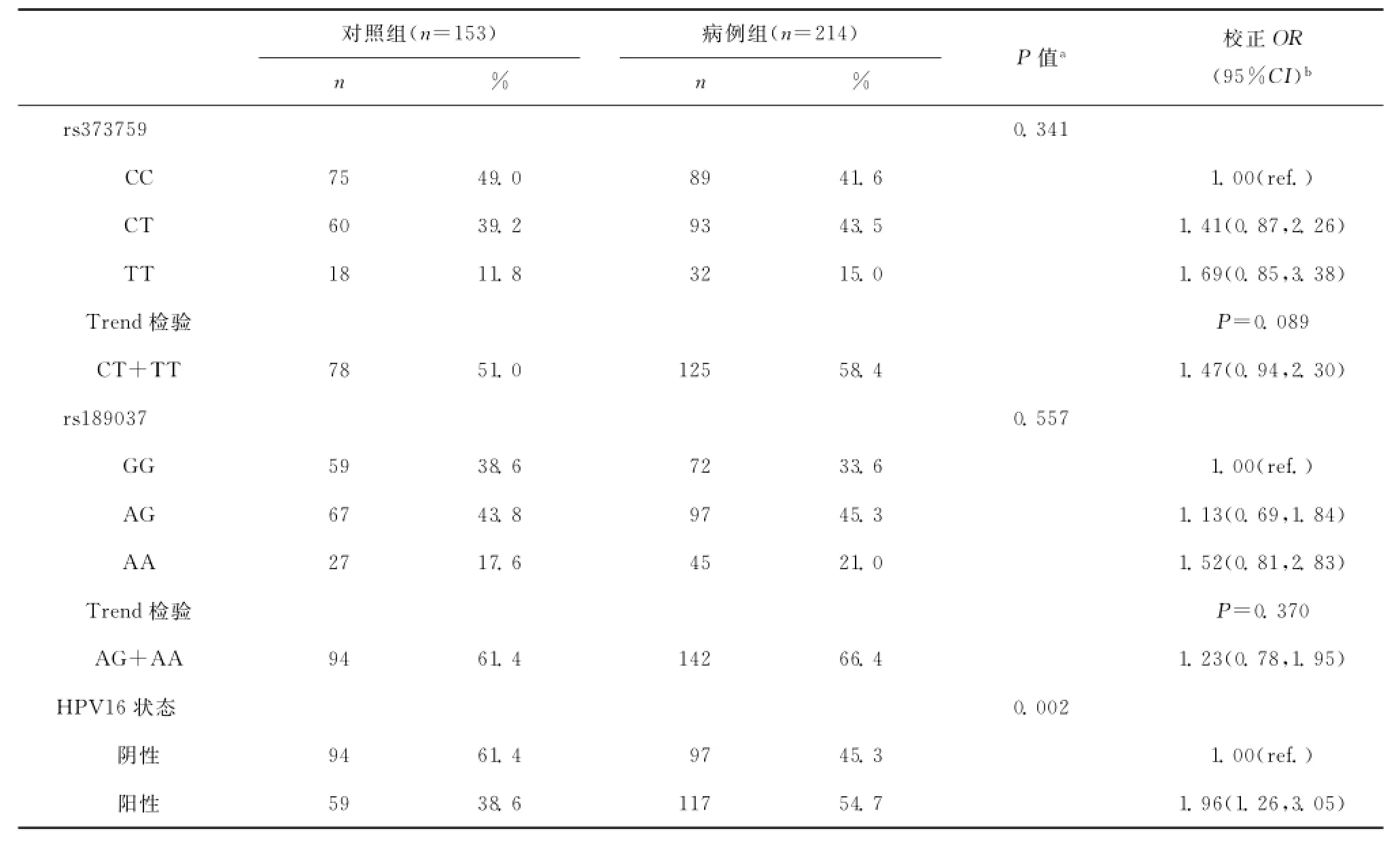
表4 ATM基因型和HPV血清学状态在吸烟人群中的分布以及与食管鳞状细胞癌发病风险的相关性Table4 Distribution of ATM genotypes and HPV16serologic status and their associations with risk of ESCC in smokers
2.5 ATM的基因型和HPV16血清学状态在饮酒人群中对食管鳞状细胞癌发病风险的联合作用
ATM基因编码的蛋白对于细胞周期起到重要的监控作用;而HPV可以作用于细胞周期调控相关通路的蛋白,引起通路的功能异常。考虑到基因和暴露因素功能上的关联,我们联合分析了二者与食管鳞状细胞癌发病风险的相关性,如表5所示。在rs373759和HPV16的联合分析中,以HPV16阴性且rs373759CC型的人群为参照,HPV阴性且rs373759CT/TT型的人群发病风险增高(P=0.009,调节OR值2.43;95%CI 1.25,4.72),HPV阳性且rs373759CC型的人群发病风险进一步增高(P=0.012,调节OR值2.51;95%CI 1.23,5.13),HPV阳性且rs373759CT/TT型的人群发病风险最高(P<0.01,调节OR值3.83;95%CI 1.93,7.61)。同时,rs373759的基因型和HPV16的血清学状态对于食管鳞状细胞癌的发病风险有交互作用(P=0.009,调节OR值2.04;95%CI 1.19,3.48)。
在rs189037和HPV16的联合分析中,与HPV16阴性且rs189037GG型的人群相比,HPV16阴性且rs189037AG/AA型的人群食管鳞状细胞癌的发病风险增高(P=0.006,调节OR值2.68;95%CI 1.33,5.37),HPV16阳性且rs189037 GG型的人群食管鳞状细胞癌的发病风险也明显增高(P=0.002,调节OR值3.72;95%CI 1.65,8.42),HPV16阳性且rs189037AG/AA型的人群食管鳞状细胞癌的发病风险增高到3.60倍(P<0.01,95%CI 1.78,7.29)。但是HPV16的血清学状态和rs189037的基因型之间无交互作用(P=0.063,调节OR值1.61;95%CI 0.97,2.66)。
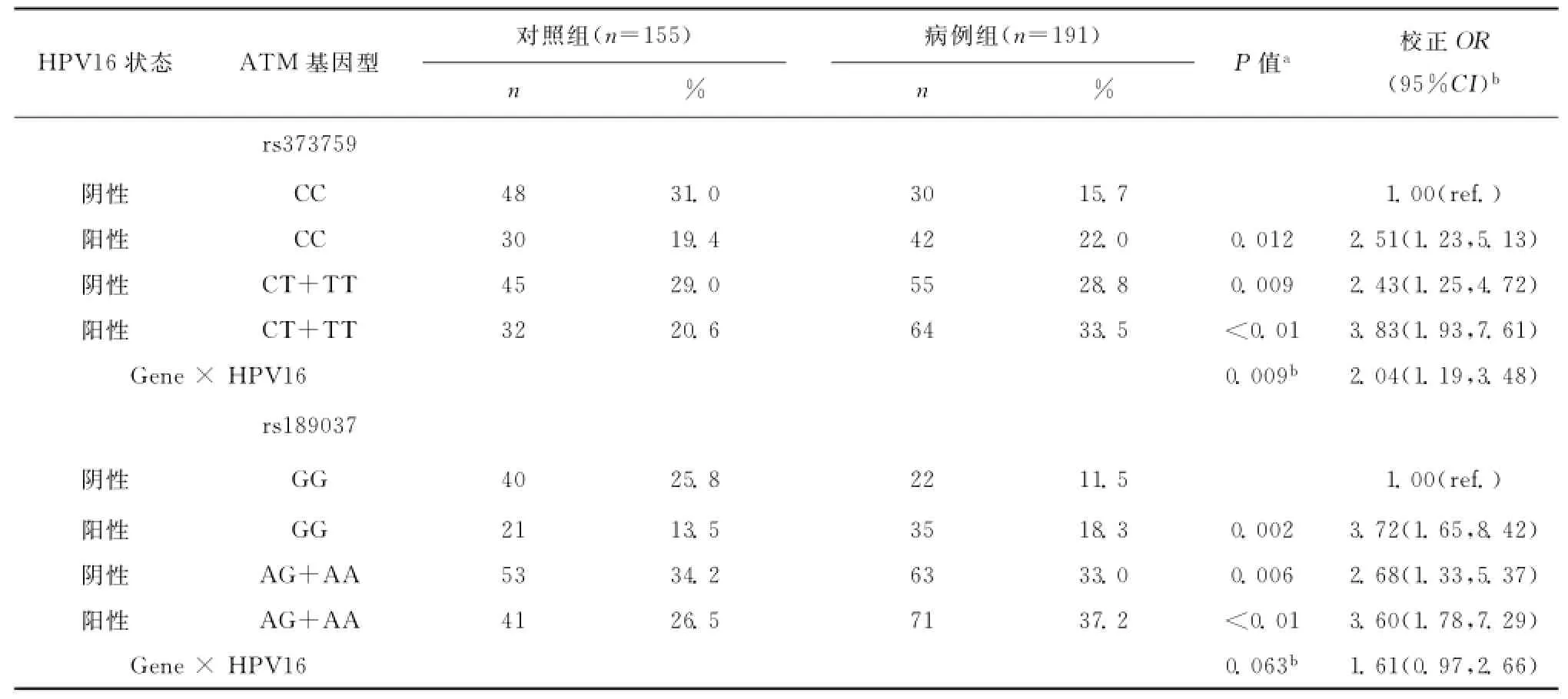
表5 ATM rs373759/rs189037和HPV16在饮酒人群中对于食管鳞状细胞癌发病风险的联合作用Table5 Synergistic effects of ATM rs373759/rs189037genotypes and HPV16serologic status on ESCC risk in drinkers
我们对ATM rs373759和ATM rs189037进行了连锁不平衡分析,发现这两个SNP位点高度连锁不平衡(D’=0.951,图1)。因此,rs373759和rs189037这两个位点对于食管鳞状细胞癌发病风险的联合作用未纳入分析。
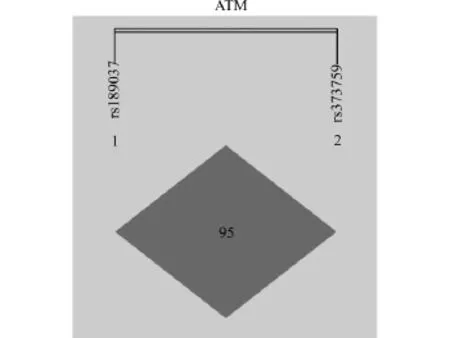
图1 ATM的SNP基因型连锁不平衡分析图Fig.1 Linkage disequilibrium analysis of ATM SNPs
3 讨论
食管癌是全球八大恶性肿瘤之一,其致死率位于肿瘤相关死亡率的第6位。自伊朗北部经过中亚各国延伸到中国中北部,常常被称为——食管癌带,这个区域的病例90%是食管鳞状细胞癌[12]。由于临床上缺乏对于早期食管鳞状细胞癌的诊断方法,导致其在高发地区的5年生存率不到10%[1314]。目前已知的食管鳞状细胞癌的高危因素包括吸烟、过度的酒精摄入、较差的营养状况、蔬菜水果的低摄入和喝高温的饮品[12]。一些研究者认为,高危人乳头瘤病毒(HPV)的感染与食管鳞状细胞癌的发病相关[8],但是没有形成一致性的结论。
关于食管鳞状细胞癌发病相关的遗传标志的探索,在中国人群中有3个基于全基因组关联分析(GWAS)的临床研究[11,1516]。本课题组在既往的研究中选择了其中凋亡通路相关的单核苷酸多态性(SNP)位点进行了验证,并发现其中的某些位点联合HPV的感染对食管鳞状细胞癌的发病有协同促进作用[9]。尽管食管鳞状细胞癌发病风险相关的遗传因素的研究较多,但是可应用于临床诊疗的遗传标志仍然在探索中。
以往的研究表明,恶变细胞获得无限的增殖潜能是肿瘤形成的基本步骤。毛细血管扩张性共济失调症突变(ATM)基因编码磷脂酰肌醇3激酶(PI3K)样丝氨酸/苏氨酸蛋白激酶,在DNA双链的修复和细胞的凋亡与衰老中起到关键性作用[2]。ATM激活后可触发包括p53[17]在内的多条细胞周期检测点相关通路——检测点相关通路对于DNA损伤应答和基因组稳定性的维持是必需的。目前大量的研究表明ATM基因多态性与多种肿瘤的发病相关,如肺腺癌[5]、甲状腺癌[6]、乳腺癌[7]等。ATM基因与食管癌发病风险的研究数据较少,但是有研究表明ATM基因是潜在的食管癌早期诊断的生物学标志之一[18]。
HPV感染与食管癌发病风险的研究可以追溯到1982年。我们之前的研究也表明,HPV16血清学阳性在饮酒的亚组人群中增加食管鳞状细胞癌的发病风险[19]。高危HPV的E6和E7肿瘤蛋白可与抑癌基因p53和Rb相结合,引起细胞凋亡通路的失活和转录通路的激活,为恶变细胞的永生化创造了条件[34]。
我们的研究探索了ATM rs373759和ATM rs189037的基因型与食管鳞状细胞癌的发病风险的相关性,并进一步分析了ATM基因型和HPV16血清学状态对于食管鳞状细胞癌发病风险的联合作用。在全体受试者中,rs373759和rs189037的基因型与食管鳞状细胞癌的发病风险无明显相关性。我们以饮酒状态对全体受试者进行分层,发现在饮酒人群中,rs373759的基因型与食管鳞状细胞癌的发病风险存在明显的相关性(Ptrend=0.006),相比于CC型,TT型的发病风险提高了2.5倍(95%CI 1.15,5.45);rs189037在饮酒人群中的分布未达到统计学差异,但是AG/AA型的人群比GG型的人群发生食管鳞状细胞癌的风险有轻度增高(OR值1.64;95%CI 1.00,2.68)。在非饮酒人群中,rs373759和rs189037的基因型在对照组和病例组中的分布无明显统计学差异,与食管鳞状细胞癌的发病风险亦无相关性。在以吸烟状态分层的不同人群中,rs373759和rs189037的基因型与食管鳞状细胞癌的发病风险亦无明显相关性。HPV16血清学阳性是吸烟或饮酒人群中食管鳞状细胞癌的危险因素,但是在非吸烟或非饮酒的人群中,HPV16的血清学状态与食管鳞状细胞癌的发病风险无相关性。我们进一步在饮酒人群中探讨了ATM基因型与HPV16血清学状态对于食管鳞状细胞癌发病风险的交互作用,发现HPV16阳性和rs373759的CT/TT基因型对于食管鳞状细胞癌的发病风险有协同促进作用(PG×E=0.009),相比于HPV16阴性且rs373759CC型的人群,HPV16阳性且rs373759 CT/TT型的人群食管鳞状细胞癌发病风险增加3.83倍。
ATM基因变异增加了多种肿瘤的发病风险,但是与食管鳞状细胞癌的发病风险是否相关尚待进一步的研究。来自国际癌症基因组联盟(ICGC)的一项研究表明,细胞周期通路上的基因变异与食管鳞状细胞癌的发病有密切的相关性[20]。ATM基因编码的蛋白激酶(属于PI3K家族的成员)是细胞周期维稳的核心监控者。活化的ATM蛋白能够磷酸化多种调控双链DNA损伤应答的蛋白酶。这对于维持下游细胞周期检测点相关通路的正常运作和基因组的稳定性起到不可替代的作用[21]。因此,结合我们的研究发现,ATM的基因变异可能作为食管鳞状细胞癌发病风险的潜在生物标志。
在以往的研究中,HPV16感染与食管鳞状细胞癌的发病风险是否相关仍然存在争议。结果的不一致性可能归结于研究设计的不同,检测方法的不同,人群和种族差异,以及其他相关危险因素的干扰。我们参考以往研究的检测方法[2224],采用ELISA试验来检测血清中抗HPV16L1衣壳蛋白的IgG,发现HPV16感染在吸烟或饮酒的人群中增加了食管鳞状细胞癌的发病风险。我们的研究结果得到了其他临床研究的支持——在近期发表的两项Meta分析中,综合多项研究数据得出——高危HPV感染增加了食管鳞状细胞癌的发病风险[8,25]。
关于HPV16与细胞周期通路相关的基因在口腔鳞癌发病中的交互作用已有研究报道[24]。同时,我们的结果亦得到来自分子生物学研究的支持。高危HPV引发细胞恶变主要通过E6和E7肿瘤蛋白——E6与p53结合导致p53信号通路的失活;E7降解pRB从而引起E2F依赖的转录通道的激活——来影响细胞周期的调控[34],而p53/Rb通路正是ATM下游的调节靶点。因此,HPV16和ATM对食管鳞状细胞癌的发病风险在饮酒的亚组人群中有协同促进作用是有据可循的。
我们的研究仍存在一些缺点和不足。首先,我们仅在饮酒人群中发现了ATM基因型与食管鳞状细胞癌发病风险相关,这可能限制了ATM的基因多态性作为易感标志在全体人群中的适用性。有研究表明乙醇代谢产物可以激活ATM蛋白[26]。因此,我们猜想,饮酒可能在一定程度上放大了ATM在细胞周期调控中的作用,故在饮酒人群中更明显地体现了ATM与食管鳞状细胞癌发病风险的相关性。当然,这种假设需要进一步的验证。其次,我们判断受试者是否感染了HPV16是通过ELISA的方法来检测血清中的抗体水平。我们知道,任何部位HPV16的感染均可引起机体的免疫反应。这对我们的分组可能造成一定的偏倚。
尽管如此,我们的研究仍具有一定的临床意义。虽然食管鳞状细胞癌的治疗策略不断改进,但其预后依然不容乐观,这很大程度上是由于疾病早期无特异性的症状和临床缺乏识别早期食管鳞状细胞癌的方法。而我们以经济微创的方法检测受试者外周血的生物标志,可以帮助识别食管鳞状细胞癌的易感人群。这可能为后续的筛查试验缩窄了目标人群,一定程度上提高了医疗资源的投入效益比。我们的研究是首次发现ATM基因多态性和HPV16对饮酒人群中食管鳞状细胞癌的发病风险有交互作用,为未来的研究提供了良好的线索。
综上所述,我们的研究表明ATM rs373759和ATM rs189037的基因型在饮酒的中国人群中与食管鳞状细胞癌的发病风险相关;HPV16血清学阳性是饮酒或吸烟人群食管鳞状细胞癌的易感因素;HPV16血清学阳性协同ATM的基因型明显增加了饮酒人群中食管鳞状细胞癌的发病风险。
[1] Zhou B,Zhang H,Damelin M,et al.Tumour-initiating cells: challenges and opportunities for anticancer drug discovery[J].Nat Rev Drug Discov,2009,8(10):806-823.
[2] Stagni V,Oropallo V,Fianco G,et al.Tug of war between survival and death:exploring ATM function in cancer[J].Int J Mol Sci,2014,15(4):5388-5409.
[3] McLaughlin-Drubin M E,Munger K.The human papillomavirus E7oncoprotein[J].Virology,2009,384(2):335-344.
[4] Howie H L,Katzenellenbogen R A,Galloway D A.Papillomavirus E6proteins[J].Virology,2009,384(2):324-334.
[5] Shen L,Yin Z,Wu W,et al.Single nucleotide polymorphism in ATM gene,cooking oil fumes and lung adenocarcinoma susceptibility in Chinese female non-smokers:a case-control study[J].PLoS One,2014,9(5):e96911.
[6] Xu L,Morari E C,Wei Q,et al.Functional variations in the ATM gene and susceptibility to differentiated thyroid carcinoma[J].J Clin Endocrinol Metab,2012,97(6):1913-1921.
[7] Wang H C,Chang W S,Tsai R Y,et al.Association between ataxia telangiectasia mutated gene polymorphisms and breast cancer in Taiwanese females[J].Anticancer Res,2010,30(12):5217-5221.
[8] Li X,Gao C,Yang Y,et al.Systematic review with meta-analysis:the association between human papillomavirus infection and oesophageal cancer[J].Aliment Pharmacol Ther,2014,39(3):270-281.
[9] Yang J,Wu H,Wei S,et al.HPV seropositivity joints with susceptibility loci identified in GWASs at apoptosis associated genes to increase the risk of esophageal wquamous cell carcinoma(ESCC)[J].BMC Cancer,2014,14(1):501.
[10] Yang J,Liu B,Li W,et al.Association of p53and MDM2polymorphisms with risk of human papillomavirus(HPV)-related esophageal squamous cell carcinoma(ESCC)[J].Cancer Epidemiol,2013,37(5):629-633.
[11] Wu C,Kraft P,Zhai K,et al.Genome-wide association analyses of esophageal squamous cell carcinoma in Chinese identify multiple susceptibility loci and gene-environment interactions[J].Nat Genet,2012,44(10):1090-1097.
[12] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[13] Aghcheli K,Marjani H A,Nasrollahzadeh D,et al.Prognostic factors for esophageal squamous cell carcinoma-αpopulationbased study in Golestan Province,Iran,a high incidence area[J].PLoS One,2011,6(7):e22152.
[14] Li J,Song Q,Zhou X,et al.Major cancer mortality and changes in Yanting,2004-2009:introduction to cancer challenges in a high risk area[J].Asian Pac J Cancer Prev,2011,12(2): 409-413.
[15] Wang L D,Zhou F Y,Li X M,et al.Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1and C20orf54[J].Nat Genet,2010,42(9):759-763.
[16] Wu C,Hu Z,He Z,et al.Genome-wide association study identifies three new susceptibility loci for esophageal squamouscell carcinoma in Chinese populations[J].Nat Genet,2011,43(7):679-684.
[17] Banin S,Moyal L,Shieh S,et al.Enhanced phosphorylation of p53by ATM in response to DNA damage[J].Science,1998,281(5383):1674-1677.
[18] Jiang Y,Liang Z D,Wu T T,et al.Ataxia-telangiectasia mutated expression is associated with tobacco smoke exposure in esophageal cancer tissues and benzo[a]pyrene diol epoxide in cell lines[J].Int J Cancer,2007,120(1):91-95.
[19] Qi Z,Jiang Q,Yang J,et al.Human papillomavirus(HPV)infection and the risk of esophageal squamous cell carcinoma[J].Dis Esophagus,2013,26(1):61-67.
[20] Song Y,Li L,Ou Y,et al.Identification of genomic alterations in oesophageal squamous cell cancer[J].Nature,2014,509(7498):91-95.
[21] Bakkenist C J,Kastan M B.DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation[J].Nature,2003,421(6922):499-506.
[22] Van Doornum G J,Korse C M,Buning-Kager J C,et al.Reactivity to human papillomavirus type 16L1virus-like particles in sera from patients with genital cancer and patients with carcinomas at five different extragenital sites[J].Br J Cancer,2003,88(7):1095-1100.
[23] Kamangar F,Qiao Y L,Schiller J T,et al.Human papillomavirus serology and the risk of esophageal and gastric cancers: results from a cohort in a high-risk region in China[J].Int J Cancer,2006,119(3):579-584.
[24] Chen X,Sturgis E M,Lei D,et al.Human papillomavirus seropositivity synergizes with MDM2variants to increase the risk of oral squamous cell carcinoma[J].Cancer Res,2010,70(18):7199-7208.
[25] Hardefeldt H A,Cox M R,Eslick G D.Association between human papillomavirus(HPV)and oesophageal squamous cell carcinoma:a meta-analysis[J].Epidemiol Infect,2014,142(6):1119-1137.
[26] Clemens D L,Schneider K J,Nuss R F.Ethanol metabolism activates cell cycle checkpoint kinase,Chk2[J].Alcohol,2011,45(8):785-793.
(2014-08-22 收稿)
HPV Seropositivity Synergized with ATM Variants Increases the Risk of Esophageal Squamous Cell Carcinoma in Drinkers
Yu Qianqian,Qiu Hong,Xiong Huihua et al
Department of Oncology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To investigate the synergistic effects of human papilloma virus 16(HPV16)and the Ataxia telangiectasia mutated(ATM)gene polymorphism on the risk of esophageal squamous cell carcinoma(ESCC).Methods The peripheral blood of 303ESCC patients and 304cancer-free controls was evaluated for the ATM polymorphism and HPV16serology.ATM single nucleotide polymorphism(SNP)loci(rs373759,rs189037)were genotyped by TaqMan fluorescent quantitative techniques.The serum status of HPV16was measured by enzyme-linked immunosorbent assay(ELISA).The associations of risk factors with the ESCC risk were staistically analysized non-conditional Logistic regression models.Results In the drinking population,rs373759genotypes were significantly associated with the risk of ESCC(Ptrend=0.006).People with rs373759CT genotype had a 1.82-fold(95%CI1.10,3.01)increased risk for ESCC and those with rs373759TT genotype had a 2.50-fold(95% CI 1.15,5.45)increased risk for ESCC when compared with rs373759CC genotype.Compared with rs189037GG genotype,the participants with rs189037AG/AA genotypes were associated with a mildly increased risk of ESCC(OR1.64;95%CI 1.00,2.68).HPV16seropositivity was a susceptible factor for ESCC in drinkers(OR1.92;95%CI 1.20,3.07)and smokers(OR 1.96;95%CI1.26,3.50).rs373759genotypes and HPV16serological status had interactions on the risk of ESCC(PG×E=0.009,OR2.04;95%CI1.19,3.48).The risk of ESCC was elevated in the group with negative HPV16and rs373759CT/TT genotypes(OR2.43;95%CI1.25,4.72),the group with positive HPV16and rs373759CC genotype(OR2.51;95%CI 1.23,5.13),and the group with positive HPV16and rs373759CT/TT genotypes(OR3.83;95%CI1.93,7.61)relative to the group of negative HPV16and rs373759CC genotype.Conclusion HPV16synergized with ATM rs373759variants increases the risk of ESCC in drinkers.
R735.1
10.3870/j.issn.1672-0741.2015.01.010
*国家自然科学基金资助项目(No.81272492,No.81372434,No.81071832)
于倩倩,女,1987年生,博士研究生,E-mail:15926200258@163.com
△通讯作者,Corresponding author,E-mai:h.g.y.121@163.com
