干细胞移植,让生命之火重燃
2015-06-04王震元
王震元
“小鼠实验”大发明 茫茫人海觅“知己”
白血病是一种恶性血液病,临床表现为病人血液系统中,不但白细胞数量异常增生,而且形态是不成熟的幼稚细胞,不过血液并没有变成白色。这种恶性肿瘤细胞使人体正常造血组织及功能遭受破坏,最后导致患者因严重贫血、出血及严重感染而死亡。
1845年,英国医生伯纳特和德国医生魏尔啸,分别在爱丁堡和柏林先后报告发现了白血病,前后仅相差6周。自1865年,德国医生利绍尔首先使用一种含砷的福勒液治疗白血病开始,100多年来,虽然有多种化学药物问世,疗效也不断提高,但是,化疗对人体细胞“好坏不分”的杀伤力,往往使病人难以承受。由于骨髓是人体造血的主要组织,因而成为科学家们寻找更好治疗方法的“切入点”。
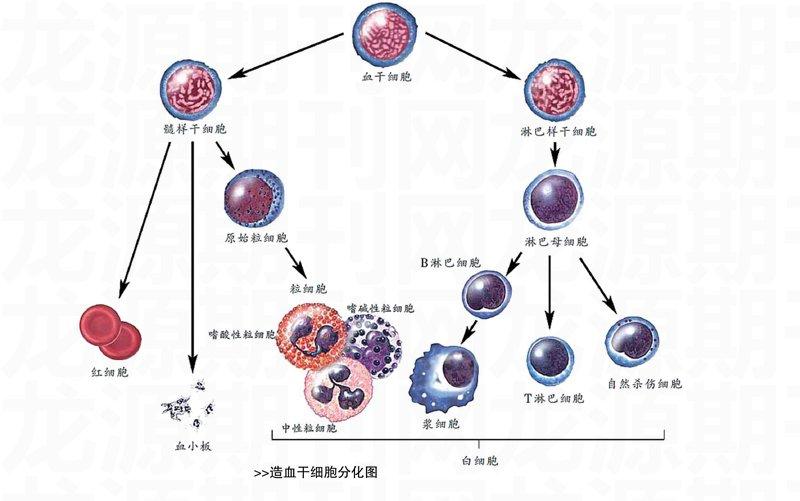
科学家进一步研究发现,骨髓中存在一种造血干细胞。干细胞的“干”,是从英文单词“stem”意译而来,表示“茎”或“起源”,就像插进土壤里的一根柳条那样不断生长。因而,“干细胞”具有一种自我更新能力。造血干细胞能不断为人体补充红细胞、白细胞、血小板……1951年,科学家劳伦斯让实验小鼠受到足够使它的骨髓彻底破坏而死亡的射线照射,然后输注正常小鼠的骨髓,结果该小鼠奇迹般地活了下来。这个实验第一次证实了在同种动物的不同个体之间可以成功地进行骨髓移植。

1958年,挪威生物化学家达赛克发现了人类第一个白细胞抗原HLA,它位于第6号染色体上。HLA系统分为A、B、C、DR、DQ、DP六个子系统,共有130多种,由此产生的组合甚至超过了世界上现有人口总数。因而,从理论上来说,除了同卵双胞胎之外,世界上没有两个人的HLA完全相同。HLA直接决定组织的类型。如果供体和受体的HLA完全相同(如同卵双胞胎),移植后就不会产生排异反应;反之 ,就会产生进行排斥反应。托马斯从1963年开始,经过8年的艰苦努力,在大量动物实验的基础上,终于找到了解决这一难题的方法。在移植前,除了进行严格的组织配型外,对患者进行大剂量的全身射线照射,及应用大剂量的环磷酰胺药物,有助于防止移植后产生宿主抗移植物反应。移植后,还要立即应用氨甲喋呤及环胞素A,继续抑制移植物抗宿主反应。20世纪60年代末,托马斯分别从患者同胞兄妹身上取出骨髓,为100例晚期急性白血病患者进行了移植手术,结果虽然只有10人存活,但他们的生存期不仅大大延长到7~10年,而且无需进行抗白血病药物治疗。紧接着,托马斯又为23例早期急性白血病患者进行了骨髓移植,结果有12例存活。据统计,托马斯的移植手术,使长期以来被认为是绝症的白血病患者的治愈率达到50%,儿童患者治愈率更高达80%。1990年,年已古稀的托马斯因此荣获诺贝尔生理学或医学奖。
骨髓移植的成败,供体与受体的HLA配型是关键。同胞兄弟姐妹之间,相配率为25%。而在没有任何血缘关系的人之间,相配率仅为1/100000。真是人海茫茫觅“知己”,谈何容易!因此,早在1992年,我国就建立了中华骨髓库。该库对志愿者的血液进行HLA分型后,将其资料录入网络计算机数据库中,以便需要骨髓移植的患者进行比对。截至2013年底,总库存量已达到166万多份,成功捐献造血干细胞3308例。中华骨髓库还帮助美国、英国、韩国、瑞士、新加坡和阿富汗,以及我国台湾和香港地区的2000余位白血病患者找到相合的HLA配型,并成功地实现了捐献。
骨髓执行“动员令” 脐血“更上一层楼”
但是,骨髓移植须在麻醉状态下对捐献者进行穿刺或者在骨上凿孔,这不仅会给捐献者造成痛苦,而且可能带来并发症。那有没有更好的采集方法呢?
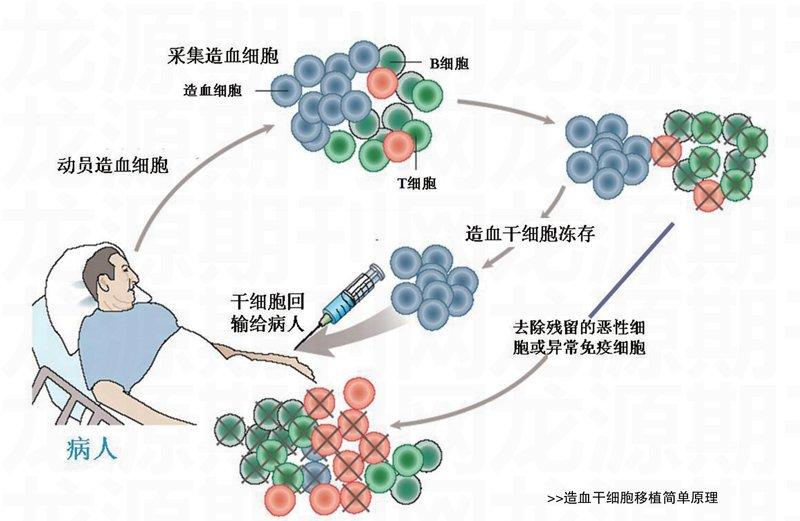
有!这就是目前我国应用的外周血干细胞移植。但是,在人体的正常生理条件下,外周血中的造血干细胞含量极少,必须注射一种细胞“动员剂”,加速骨髓中造血干细胞生成并释放到外周血中,使它的数量激增20~30倍后,才能满足移植使用。
患者在接受外周血干细胞移植前,与接受骨髓移植相同的是,也要进行“清髓”处理。其目的首先是清除其病态骨髓细胞,为正常造血干细胞“入住”腾出空间;其次是彻底抑制免疫系统,避免出现排异反应;最后是要将肿瘤细胞“斩尽杀绝”。
患者“清髓”与捐献者注射细胞“动员剂”要同步进行。捐献者经过连续4天“动员”后,就可开始提取造血干细胞。捐献者需静卧在床上,两只胳膊的静脉血管都插着针管,血液从一只胳膊的血管流入血细胞离心分离机,把造血干细胞提取出来,其余的血液则从另一只胳膊的血管流回体内。全身血液如此循环2次,约4小时后,便可以采集到约100毫升的造血干细胞。这种干细胞悬液要尽快输入患者体内,同时注射造血细胞生长因子,促进造血干细胞在患者骨髓中“安家落户”。如果手术顺利,2~3周内,患者的造血功能就会恢复。1994年,国际上报道的首例急性淋巴细胞白血病,就用这种方法成功治愈。
需要着重指出的是,患者“清髓”以后,由于免疫功能完全丧失,因而必须进入特殊的无菌层流病房(俗称“净化仓”)“与世隔绝”,加之其它的专门设备和进口药物,治疗费用十分昂贵。
后经研究发现,新生儿诞生时,被剪掉的那一段脐带残留的血——脐血中,含有比骨髓细胞更丰富、更原始,以及扩增能力更强的造血干细胞。由于脐血中的淋巴细胞大部分为幼稚型T淋巴细胞,功能不成熟,免疫反应较弱,因而对HLA配型要求不高,配型成功率比骨髓移植高出10倍以上。此外,一半以上成年人的白细胞中存在一种“细胞肥大病毒”。这种病毒对正常人虽然无害,但接受移植者由于免疫系统受到抑制,因而容易受到感染,甚至产生致命危险。而只有1%的新生儿感染这种病毒。由此可见,脐血比其他几种方式的干细胞来源更为纯净和安全。1998年,我国实施首例脐血移植手术,并成功治愈一名“地中海贫血”患儿。2009年4月,世界上库存量最大的脐血库,在北京落成并投入使用。
20世纪90年代,在美国加利福尼亚州,19岁的安妮莎患了白血病,但是她唯一同胞哥哥的HLA与之不匹配,骨髓库里也找不到相同的配型。于是,焦急万分的父母接受医生的建议,采用体外受精的方式,从一群早期胚胎中挑选与安妮莎HLA相符的胚胎植入她母亲的子宫。在这段时间里,继续用化疗缓解安妮莎的病情。安妮莎在母亲生下妹妹2个月后,医生对她实施了从新生儿脐血中提取的造血干细胞移植手术。安妮莎终于获救了。
昔日瘫痪今屹立 前景璀璨征途艰
难道干细胞移植手术只是让白血病患者受益吗?当然不是!干细胞移植手术颠覆了一系列传统的医学观点,科学家们因此发明了相应的治疗方法。
1989年,科学家们先后从成年大鼠和人体大脑中证实了神经干细胞的存在,进而表明损伤或坏死的神经并非是“不可逆转”的。2004年,我国云南省的一位武警战士小董,在一次施工中被一堵坍塌的砖墙意外砸中,造成颈椎骨折、脊髓损伤。虽经及时救治,他保住了生命,但已经全身瘫痪。由于排汗功能丧失,他因此还经常发烧。
2006年,小董住进了武警总医院。医生们首先为小董做了椎管手术,解除其严重粘连的神经根,再将神经干细胞植入受损脊髓中。术后第16天,他右上肢的肌腱开始收缩,手腕可以活动了。出院时,他左上肢更能举起2千克重的哑铃40~50次。半年后,小董进行第二个疗程的移植。经过这次手术,他已可以平推20千克的重物。之后,他萎缩的膀胱也逐渐能够控制,排汗功能以及体温都恢复正常。特别令人惊喜的是,小董竟可以在支具保护下,站立整整1个小时了……
“心脏是不可再生的器官,心肌细胞在人出生后不久,就永远停止了增殖和分裂,即使损伤也无法修复。”但是,近年来,科学家们用聚焦显微镜却观察到,正常心脏中少数干细胞的有丝分裂现象。德国心脏病专家斯特劳尔,为一位46岁心肌大面积梗死的男性患者,进行了干细胞移植手术。术后,患者的心脏功能明显改善。后经相关的化验发现,植入的干细胞已发育为新的心肌细胞和血管。
“糖尿病患者必须终生用药”,这是医学界长期达成的一种共识。但在2009年,美国和巴西的一个联合研究小组利用造血干细胞移植术,给糖尿病患者带来了新的曙光。他们在为14-31岁之间的15名1型糖尿病患者进行了自体造血干细胞移植(可以在胰脏内分化为胰岛细胞),其中14人术后取得良好效果,从此不必每天注射胰岛素就可保持正常血糖水平。我国有几家三甲医院使用同样的方法,对2型糖尿病患者进行治疗,也取得了较好效果,其中一些人甚至可以停用药物。
此外,对帕金森病、老年痴呆症、脑卒中(中风或叫脑血管意外)、小脑萎缩、视网膜黄斑变性、“渐冻人”、肾衰竭、红斑狼疮、股骨坏死以及男性不育等现代医学感到棘手的疾病,运用干细胞移植进行治疗研究,也都获得了不同程度的可喜成果。当然要使这门医疗新技术在临床广泛推广应用,为更多病人造福,还需要科学家们更为艰辛的努力……
HLA:它是目前所知人体最复杂的多态系统。HLA是具有高度多态性的同种异体抗原,其化学本质为一类糖蛋白,由一条α重链(被糖基化的)和一条β轻链非共价结合而成。HLA按其分布和功能分为Ⅰ类抗原和Ⅱ类抗原。
有丝分裂:它又称间接分裂,是真核细胞分裂产生体细胞的过程。其特点是有纺锤体染色体出现,子染色体被平均分配到子细胞,这种分裂方式普遍见于高等动物和植物。
