高氨氮污水的微生物修复初探
2015-06-02吴酬飞谢运昌
吴酬飞,谢运昌,王 芬
(1.湖州师范学院生命科学学院,浙江 湖州 313000;2.中国科学院南海海洋研究所,广东 广州 510275)
水体中的氨氮(NH4—N)污染日趋严重,造成水中鱼虾的中毒死亡[1].高含量NH4—N经微生物作用后可转变成硝氮(NO3—N),而NO3—N又极易被还原成NH4—N或亚硝氮(NO2—N),从而造成水体富营养化,进而使水中藻类及其他浮游生物大量繁殖,严重时会使水中溶解氧下降并释放毒素,造成水生生物中毒或者缺氧死亡,从而影响污染水体的生态平衡,使生物多样性遭到破坏[2-3].人们运用物理修复和化学修复技术进行海水养殖废水的修复治理,但是由于物理与化学方法具有能源消耗大、工艺难控制、容易引发二次污染等不利因素,进而效果不尽如人意[4].在这一形势下,发展有效的修复方法降低水中的NH4—N含量显得尤为重要.
生物修复通过细菌、真菌甚至高等植物以及细胞游离酶的自然代谢过程降解、去除环境中的污染物,具有着低耗、高效和环境安全等优势[5-7].广义来讲,生物修复主要有微生物修复、植物修复和细胞游离酶生物修复等.目前,生物修复已成为一个富有挑战性的前沿领域,并且研究已进入一个相当活跃的时期.学者们比较倾向于采用生物修复中的微生物修复.而微生物修复技术,是利用天然存在的或经培养所得的功能微生物群,因为具备某种生物特性,因此在适宜环境条件下,可促进或强化微生物代谢功能,同时还能降低有毒污染物活性或降解成无毒物质[8-9].
本研究从高密度养殖水体中筛选NH4-N降解微生物,对其进行分子鉴定和降解途径初步分析.在此基础上,进一步将微生物接种至高氨氮污水,进行实际应用研究,为NH4-N污水的微生物处置技术开发奠定物质基础.
1 材料与方法
1.1 NH4—N降解菌的富集培养
取高密度养殖水体50 g,接入装有100 mL富集培养基[葡萄糖 5.0 g,(NH4)2SO42.0 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH 值7.2 ~7.4,MgSO4·7H2O 0.5 g,水 1000 mL]的500 mL三角瓶中,于120 rpm,28℃下摇床培养7 d,且每隔1 d向培养基中加入5%的(NH4)2SO4溶液1 mL,以淘汰不能利用NH+4的微生物.随后,从第一次富集培养基中取出1 mL上清菌液,加到新鲜富集培养基中,进行第二轮富集培养.
1.2 NH4—N降解菌的分离培养
取富集培养基中的上清菌液1 mL,采用十倍稀释法用无菌水将菌液分别稀释成 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9倍原菌液浓度,吸取稀释菌液1 mL,在分离培养基[葡萄糖5.0 g,(NH4)2SO42.0 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH 值 7.2 ~7.4,MgSO4·7H2O 0.5 g,水1000 mL,2% 琼脂]上涂布平板,置 28℃恒温培养箱中培养,观察NH4—N降解菌的生长情况.挑取平板上长出的单菌落进行重复分离纯化培养,直到得到单菌株的纯培养.
1.3 NH4—N 含量的测定
目前,针对NH4—N含量测定,已有多种成熟有效的方法.但是,考虑到减少环境污染和降低成本,因此排除了《纳氏试剂分光光度法》(HJ 535-2009)与《蒸馏-中和滴定法》(HJ 537-2009),采用了同样方法成熟的国标法《水杨酸分光光度法》(HJ 536-2009).水杨酸分光光度法是一种测量饮用水、大部分原水和废水中铵的方法.其原理是:在亚硝基铁氰化钠[Na2Fe(CN)5NO·2H2O]存在下,铵与水杨酸[C6H4(OH)COOH]和次氯酸钠(NaClO)反应生成蓝色化合物,在697 nm处用分光光度法加以测定.同时,在pH值为11.7且有亚硝基五氰络铁酸钠存在时,铵与水杨酸也要发生反应,从而样品中所有的铵都定量地被测定.加酒石酸钾钠可掩蔽阳离子,特别是钙镁离子的干扰.这种方法的最低检出浓度为0.01 mg/L,NH4—N检测上限浓度可达1 mg/L.
1.4 NO3—N及NO2—N含量的测定
为了了解细菌是否将NH4—N转化为NO3—N或NO2—N,作者又将氨氮降解菌接种至相同的培养基中进行培养.
NO3—N含量的测定,采用的是国标法《水质硝酸盐氮的测定 紫外分光光度法》(HJ/T 346-2007)测定NO3—N,该方法利用硝酸根离子(NO-3)在220 nm波长处的吸收而定量测定NO3—N.溶解的有机物在220 nm处也会有吸收,而NO-3在275 nm处没有吸收.因此,在275 nm处作另一次测量,以校正NO3—N值.
NO2—N含量的测定,采用的是经典国标法《水质亚硝酸盐氮的测定分光光度法》(GB 7493-87)测定NO2—N.该方法的原理是,在磷酸介质中,pH值为1.8时,试样中的亚硝酸根离子(NO-2)与4-氨基苯磺酰胺(C6H8N2O2S)反应生成重氮盐,它再与 N—1—萘基—乙二胺二盐酸盐(C12H14N2·2HCl)偶联生成红色染料,在540 nm波长处测定吸光度.
1.5 细菌基因组DNA提取和纯化
从平板培养基的菌落中刮取少许样品,并加入3 mL PBS缓冲液;经3次润洗后,将样品转移至10 mL离心管中;于4℃下13000 g离心5 min后,弃上清;加入500 mg玻璃珠和1 mL Buffer SLX Mlus,涡旋10 min,使细胞充分裂解.按美国Omega公司提供的细菌基因组DNA提取试剂盒操作步骤进行提取和纯化.
1.6 16S rDNA PCR 扩增
以提取的DNA为模板,进行16S rDNA PCR扩增实验.PCR 反应体系(50 μL):1 μL DNA 模板,1 μL dNTP,2 μL 引 物 1(27f),2 μL 引 物 2(1492r),1 μL Super Taq DNA 酶(2.5 U/μL),5 μL 10 × HG PCR buffer,38 μL ddH2O.PCR 反应条件:95℃预变性,5 min,1 个循环;94℃变性30 s,55℃梯度温度退火30 s,72℃延伸40 s,30个循环;最后72℃延伸10 min.
1.7 测序鉴定
将PCR产物进行琼脂糖凝胶电泳,切割获得目标DNA片段,送往上海生工测序,并进行NCBI网上比对分析.
2 结果与分析
2.1 NH4—N降解菌的分离
通过14 d的富集培养,1 d的分离培养,在高密度养殖废水中筛选出3株NH4—N降解菌,命名为GYW1,GYW2和GYW3.三种微生物菌株形态(见图1).
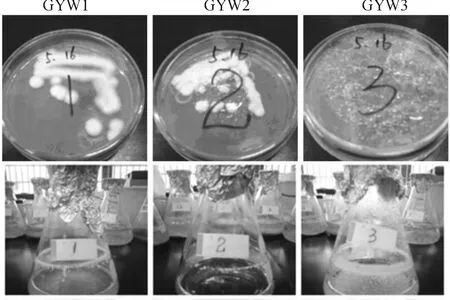
图1 GYW1,GYW2和 GYW3三种NH4—N降解菌的平板和摇瓶培养
2.2 NH4—N降解菌的分子鉴定
以提取的三种细菌基因组DNA为模板,分别进行16S rDNA PCR扩增,扩增产物经1.0%琼脂糖电泳,结果(见图2),从各菌株基因组DNA中均能扩出一条约1400 bp片段,与设计扩增的序列长度一致.
将测序所得到的16S rDNA的序列与NCBI数据进行系统对比.比对结果列于表1.从表1看出,GYW1序列与伯克霍德菌(Burkholderia cepacia)16S rDNA序列的相似度为99%,因而鉴定为伯克霍德菌;GYW2和GYW3与阪崎肠杆菌(Cronobacter sakazakii/Enterobacter Sakazakii)16S rDNA序列的相似度均为99%,因而鉴定为阪崎肠杆菌.
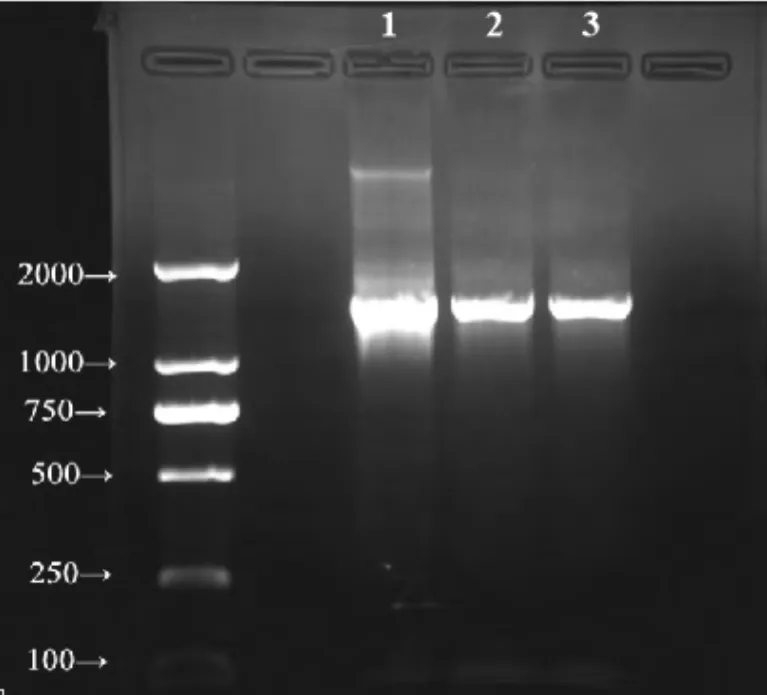
图2 三种细菌的琼脂糖凝胶电泳图谱

表1 经琼脂糖凝胶电泳获得的16S rDNA序列
2.3 NH4—N降解途径分析
对不同NH4—N降解时间的培养液中的NO3—N和NO2—N浓度进行测定分析,结果见表2.由表可见,随着时间的延长,三种微生物的NH4—N降解液中NO3—N和NO2—N含量均有所升高,且同一时间,相同的降解液中NO2—N远高于NO3—N的浓度,表明三种微生物均先将 NH4—N转化为NO2—N,再进一步氧化为 NO3—N.GYW1、GYW2和GYW3三种微生物的16 h NO2—N的浓度分别为:0.3079 mg/L、13.4027 mg/L 和7.0783 mg/L;NO3—N生成量的浓度仅分别为:0.0178 mg/L、1.1596 mg/L和 0.4391 mg/L;同时在 16 h时,GYW1、GYW2和 GYW3三种微生物消耗 NH4—N的浓度分别是:46.718 mg/L、38.803 mg/L 和35.556 mg/L.由此得出,在 NH4—N 降解 16 h时,GYW1将NH4—N转化为NO2—N和NO3—N的转化率分别为0.66%和0.04%,表明 GYW1可在新陈代谢中将NH4—N直接转化为促进其生长的蛋白质、酶等物质,仅产生极其微量的NO2—N和NO3—N,并不会对环境造成二次污染.GYW2的NO2—N和NO3—N的转化率分别为34.54%和2.98%,GYW3的NO2—N和NO3—N的转化率分别为19.91%和1.23%,表明GYW2和GYW3在NH4—N降解过程中,会通过新陈代谢作用生成可致癌的NO2—N 和 NO3—N,且 NO3—N 的生成滞后于NO2—N.因此,GYW2和 GYW3虽具有较强的NH4—N降解能力,但并不适合NH4—N废水的实际修复应用.
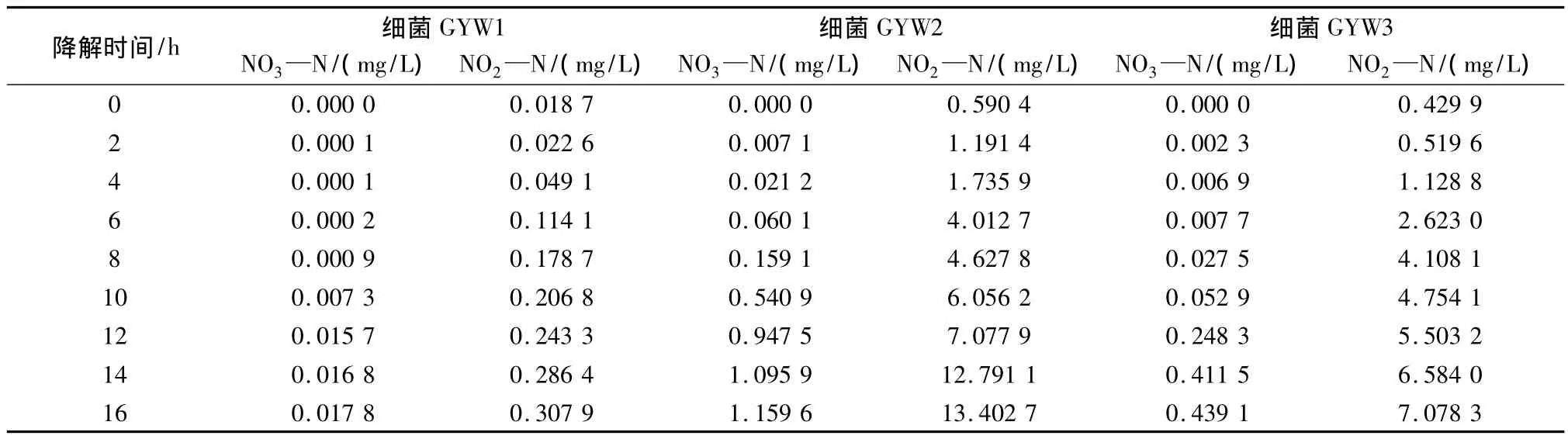
表2 NH4—N降解过程中生成NO3—N和NO2—N的含量
2.4 实际应用研究
将菌液OD值均为0.1的GYW1接种到NH4—N初始浓度为1250 mg/L的污水中,通过观察生长曲线发现,GYW1的适应期为4 h左右,16 h时达到生长稳定期,且该菌生长速度较快(见图3).在NH4—N降解能力方面,该菌能在48 h内将初培养基中始浓度为 1250 mg/L的 NH4—N降低至126.09 mg/L,降解率高达 89.91%(见图 4),意味着该菌在高氨氮污水生物修复具有较大的应用潜力.
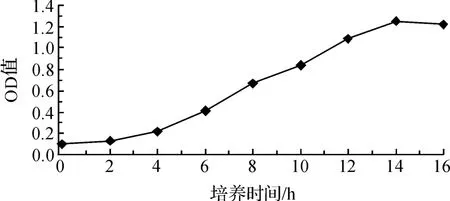
图3 GYW1生长曲线图
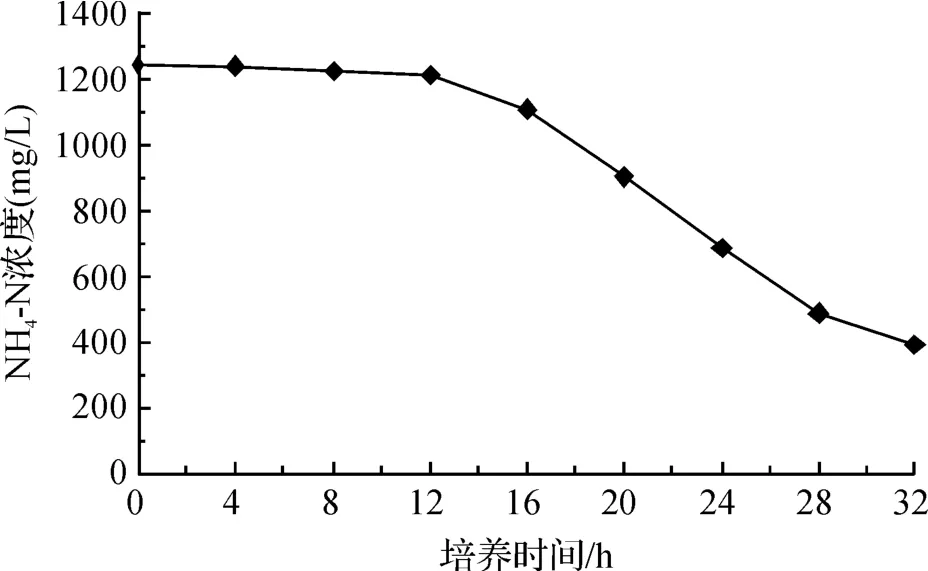
图4 GYW1的NH4—N降解曲线图
3 结论与讨论
综合以上研究,GYW1、GYW2和GYW3在不同浓度NH4—N培养基中,均表现出具有很强的生长能力与NH4—N降解能力.GYW1经16S rDNA鉴定为伯克霍德菌;GYW2和GYW3为阪崎肠杆菌.
伯克霍尔德菌(Burkholderia cepacia)是一种广泛存在于水、土壤、植物和人体中的革兰氏阴性细菌.美国的植物病理学家Burkholder首次发现它可以引起洋葱茎腐烂,称为洋葱假单胞菌[10-12].Yabuuchi et al.[13]正式将该菌及其它 6 个属于rRNA群的假单胞菌归为一个新属,即伯克霍尔德菌属.伯克霍尔德氏菌是由一些在16S rDNA序列相似度大于97.5%的种所构成的群体.目前发现的伯克霍尔德氏菌有17种,分别是:洋葱伯克霍尔德氏菌(B.Cepacia)、鼻疽伯克霍尔德氏菌(B.multivorans)、椰毒伯克霍尔德氏菌(B.Cenocepacia)、越南伯克霍尔德氏菌(B.vietnamiensis)、吡咯伯克霍尔德氏菌(B.Pyrrocinia)、B.stabilis、B.dolosa、B.ambifaria、B.anthina、B.ubomensis、B.latens、B.diffusa、B.arboris、B.seminalis、B.metallica、B.contaminans和 B.lata[14-15].这类菌对营养要求不高,可利用95~105种不同有机物作为碳源,大多数的培养环境下均可生长.伯克霍尔德氏菌具有生物防治、促进植物生长以及生物修复等功能.它可以产生多种具有抗菌活性的代谢产物,如铁载体、吩嗪、硝吡咯菌素、苯基吡咯、单萜生物碱等[16-18].在20世纪80年代,BCC曾作为生物杀虫剂和生物杀菌剂在国外广泛使用,如 Type wisconsin、Deny、Blue circle等.目前,国内外已将其已应用于生物防治,分解有毒物质等领域.而此次试验,首次发现伯克霍尔德菌中的某些细菌(比如GYW1)还具有较强的NH4—N降解能力.
阪崎肠杆菌(Enterobacter Sakazakii)是肠杆菌科的一种.阪崎肠杆菌能引起新生儿脑膜炎、小肠结肠炎以及茵血症等[19].目前,尚没有其生物修复相关报道,而本实验首次发现阪崎肠杆菌的某些细菌具有NH4—N降解能力.
然而,GYW2和 GYW3在降解 NH4—N的同时,其代谢过程会生成NO2—N和NO3—N,产生二次污染,可见这两种细菌并不适合NH4—N废水的实际修复应用.GYW1在降解NH4—N的同时,仅代谢产生极微量的NO2—N和NO3—N,分析其原因可能是在代谢途中细菌将NH4—N直接转化为生长所需的蛋白质、酶等营养物质.因此在有氧条件下,GYW1降解NH4—N作用并不会带来二次污染,且该菌能在48 h内将初培养基中始浓度为1250 mg/L的NH4—N降低至126.09 mg/L,降解率高达89.91%,可见该菌在高氨氮污水生物修复具有较大的应用潜力.
[1]黄 婧,吴若菁,陈 彪,等.畜禽养殖污水中高效氨氮降解菌的筛选、鉴定及生长条件研究[J].环境工程学报,2011,5(8):1779-1784.
[2]JING S R,LIN Y F.Seasonal effect on ammonia nitrogen removal by constructed wetlands treating polluted river water in southern Taiwan[J].Environmental Pollution,2004,127(2):291 -301.
[3]PENG Y,HE G J,JIANG W.Eco-environment quality evaluation of rare earth ore mining area based on remote sensing techniques[M].Geo-Informatics in Resource Management and Sustainable Ecosystem.Springer Berlin Heidelberg,2013:246 -257.
[4]周 鑫,王素英,池凌钰,等.海水养殖废水氨氮降解菌的筛选及培养条件研究[J].安徽农业科学,2009,37(11):4908-4910.
[5]YANG S,YANG F.Nitrogen removal via short-cut simultaneous nitrification and denitrification in an intermittently aerated moving bed membrane bioreactor[J].Journal of Hazardous Materials,2011,195:318 -323.
[6]COREY P,KIM J K,DUSTON J,et al.Bioremediation potential of Palmaria palmata and Chondrus crispus(Basin Head):effect of nitrate and ammonium ratio as nitrogen source on nutrient removal[J].Journal of Applied Phycology,2013,25(5):1349 -1358.
[7]Cycoń M,Z·mijowska A,Wójcik M,et al.Biodegradation and bioremediation potential of diazinon-degrading Serratia marcescens to remove other organophosphorus pesticides from soils[J].Journal of Environmental Management,2013,117:7 -16.
[8]DONG Y,ZHANG Z,JIN Y,et al.Nitrification performance of nitrifying bacteria immobilized in waterborne polyurethane at low ammonia nitrogen concentrations[J].Journal of Environmental Sciences,2011,23(3):366 -371.
[9]NISHIMURA F,HIDAKA T,NAKAGAWA A,et al.Removal of high concentration ammonia from wastewater by a combination of partial nitrification and anammox treatment[J].Environmental Technology,2012,33(13):1485 -1489.
[10]VU H P,MU A,MOREAU J W.Biodegradation of thiocyanate by a novel strain of Burkholderia phytofirmans from soil contaminated by gold mine tailings[J].Letters in Applied Microbiology,2013,57(4):368 -372.
[11]CHUEIRE O,TIEDJE J M,ORME N~O-ORRILLO E E,et al.Genome sequences of Burkholderia sp.[J].Journal of Bacteriology,2012,194(24):6927.
[12]AJAO A T,YAKUBU S E,UMOH V J,et al.Bioremediation of refinery wastewater using immobilised Burkholderia cepacia and Corynebacterium sp.and their transconjugants[J].Journal of Xenobiotics,2013,3(1):19 -23.
[13]JIX,RIPP S A,LAYTON A C,et al.Assessing long term effects of bioremediation:soil bacterial communities 14 years after polycyclic aromatic hydrocarbon contamination and introduction of a genetically engineered microorganism[J].Journal of Bioremediation & Biodegradation,2013.
[14]SHIBATA T F,MAEDA T,NIKOH N,et al.Complete genome sequence of Burkholderia sp.strain RPE64,bacterial symbiont of the bean bug Riptortus pedestris[J].Genome Announcements,2013,1(4):e00441 -13.
[15]SUáREZ-MORENO Z R,CABALLERO-MELLADO J,COUTINHO B G,et al.Common features of environmental and potentially beneficial plant-associated Burkholderia[J].Microbial Ecology,2012,63(2):249 -266.
[16]GASSER I,CARDINALE M,MüLLER H,et al.Analysis of the endophytic lifestyle and plant growth promotion of Burkholderia terricola ZR2-12[J].Plant and Soil,2011,347(1 - 2):125 -136.
[17]LIAO Y,MIN X,YANG Z,et al.Physicochemical and biological quality of soil in hexavalent chromium-contaminated soils as affected by chemical and microbial remediation[J].Environmental Science and Pollution Research,2014,21(1):379 -388.
[18]MITTER B,PETRIC A,SG CHAIN P,et al.Genome analysis,ecology,and plant growth promotion of the endophyte Burkholderia phytofirmans strain PsJN[J].Molecular Microbial Ecology of the Rhizosphere:2013(1-2):865-874.
[19]张雪梅,孙鑫贵,卢 阳,等.阪崎肠杆菌的研究进展[J].中国乳品工业,2008,36(3):42 -46.
