扇贝食品中遗忘性贝毒素的开管电色谱快速检测技术研究
2015-06-01陈清爱林旭聪
陈清爱, 李 琳, 林旭聪
(1. 福建商业高等专科学校旅游系, 福建 福州 350012; 2. 福州大学化学学院, 福建 福州 350116)
扇贝食品中遗忘性贝毒素的开管电色谱快速检测技术研究
陈清爱1, 李 琳2, 林旭聪2
(1. 福建商业高等专科学校旅游系, 福建 福州 350012; 2. 福州大学化学学院, 福建 福州 350116)
基于N-氨乙基-3-氨丙基甲基二甲氧基硅烷(AEPTS)键合开管柱, 研究遗忘性贝类毒素(软骨藻酸, DA)的电色谱分离行为, 建立了DA的毛细管开管柱电色谱(OTCEC)快速分析技术. 考察并优化了缓冲液类型、 缓冲液浓度、 pH值、 分离电压以及进样时间等参数影响, 在最优条件下(20 mmol·L-1NaH2PO4-Na2HPO4缓冲液, pH= 4.00, 电动进样25 s, 进样和分离电压为-18 kV), DA标准溶液在0.12~5.00 μg·mL-1范围内线性良好, 检测限(S/N=3)为0.03 μg·mL-1. 应用于扇贝中DA的快速分析, 扇贝贝肉提取液无需净化即可直接进样, 扇贝中DA线性浓度范围为0.50 ~ 10.00 μg·mL-1, 检测限(S/N=3)为0.25 μg·mL-1(相当于贝肉中DA含量1.0 μg·g-1), 扇贝样品加标回收率为80.5%~83.1%, RSD<8.5%.
遗忘性贝毒素; 开管电色谱; 贝肉; 食品
0 引言
遗忘性贝类毒素, 主要成分为软骨藻酸(domoic acid, DA), 对神经系统海马区和丘脑区可能造成损伤, 导致大脑记忆丧失, 其在食品中的含量有必要进行快速、 准确的监测[1].
软骨藻酸的检测技术主要包括酶联免疫[2]、 放射性免疫[3]、 高效色谱[4]等, 其中高效液相色谱法是软骨藻酸分析中普遍采用的方法, 包括了高效液相色谱-紫外检测、 HPLC-激光诱导荧光、 HPLC-质谱联用等技术, 在实验室确证分析中应用较为广泛. 相对于HPLC技术, 毛细管电色谱(CEC)结合了HPLC选择性好和电泳CE的高效分离的优势, 在色谱微分离应用中发展迅速. Jose[5]基于C18反相填充柱, 开展了软骨藻酸分析, 验证了CEC分离能力, 但在柱塞界面容易产生气泡, 方法不够稳定. Wu等[6]通过引入辅助泵压驱动力, 消除了柱塞产生气泡的问题, 提出了加压毛细管电色谱检测DA的新方法. 随着CEC技术的发展, CEC在软骨藻酸分析中应用潜力越来越受到了重视[7].
开管毛细管电色谱(OT-CEC)是基于开管分离柱的一类CEC技术, 该方法通过键合或涂层吸附在毛细管内壁从而形成固定相, 具有无需柱塞、 制备简单、 平衡时间短等优点, 因此得到了较为广泛的关注[8]. 前期研究发现, N-氨乙基-3-氨丙基甲基二甲氧基硅烷(AEPTS)是一种性能优良的氨基硅烷化试剂[9], 在适当条件下解离带有正电荷, 有助于产生阳离子静电排斥作用, 可以与阴离子产生离子交换作用和同向电渗流. 将OT-CEC和AEPTS键合开管柱的有机结合, 将有助于抑制蛋白质在管壁上的吸附、 含羧基结构化合物的快速分离.
本研究基于AEPTS键合开管柱, 研究软骨藻酸(DA)的电色谱分离行为, 建立DA的毛细管开管柱电色谱(OTCEC)快速分析技术. 考察缓冲液类型、 缓冲液浓度、 缓冲液pH、 电压以及进样时间等参数影响, 并应用于贝肉中DA的快速分析.
1 实验部分
1.1 仪器和试剂
毛细管开管柱电色谱-紫外检测装置(实验室自行组装), 系统包括: ±30 kV/0.3 mA 可调高压电源(上海应用物理研究所研制), 毛细管开管柱(内径50 μm, 长度60 cm), 可变波长紫外检测器(190~ 600 nm); DKB-501A型超声恒温水槽(上海精宏实验设备有限公司); KDC-160HR高速冷冻离心机(安徽中科中佳科学仪器有限公司); 实验室自制AEPTS键合开管柱, 如图1所示.
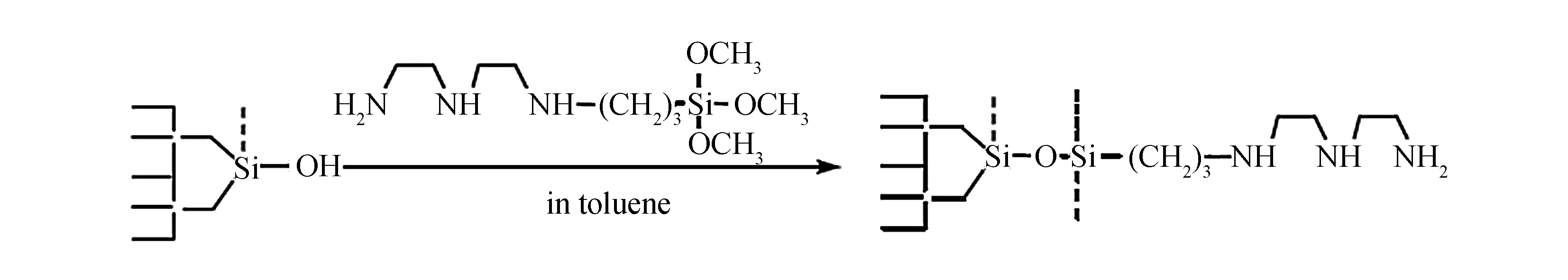
图1 毛细管开管柱制备Fig.1 Scheme of the preparation of open tubular column
软骨藻酸标准品(纯度≥90%, 西格玛化学品公司, 美国), 并于-20 ℃冰箱中避光保存; 乙腈、 甲醇(色谱纯, 上海国药化学试剂有限公司); 磷酸二氢钠、 磷酸氢二钠等其他试剂均为分析纯; 实验所用水为二次蒸馏水; 贝肉样品购自福州的大型超市.
1.2 实验方法
实验开始前依次使用0.1 mol·L-1HCl, 二次蒸馏水, 甲醇水溶液(50%, 体积分数)冲洗AEPTS键合开管柱30 min, 采用缓冲液平衡柱子10 min, 再加高压电平衡20 min. 待基线稳定后可以开始进样, 采集数据. 为了保证实验出峰的稳定性和重现性, 每次运行后需以二次蒸馏水和缓冲液各冲洗5 min. 紫外检测波长为220 nm.
1.3 样品处理
根据文献 [5], 将扇贝贝肉用匀浆机均质, 在提取液和样品比为4∶1(体积质量比)的情况下辅助超声提取, 即准确称取4 g贝肉匀浆于离心试管中, 加入16 mL甲醇水溶液(50%, 体积分数), 混匀后, 3 300 r·min-1离心10 min. 取上层清液1 mL, 用0.22 μm微孔滤膜过滤后, 转移到1 mL塑料容器中, 以8 000 r·min-1离心10 min. 取0.5 mL的上层清液直接用于分析检测; 同上, 扇贝贝肉样品中分别按照40、 20、 4 μg·g-1加入DA标准溶液进行加标回收率实验.
2 结果与讨论
2.1 分离条件优化 2.1.1 缓冲液类型的影响
基于AEPTS开管柱特点, 在酸性条件下, AEPTS基团可能引发较大的电渗流EOF. 考察了NaH2PO4-Na2HPO4缓冲液, 柠檬酸钠-柠檬酸缓冲液, 醋酸钠-醋酸缓冲液等不同体系的影响, 结果表明, 柠檬酸钠-柠檬酸缓冲液和醋酸钠-醋酸缓冲液在同等物质量浓度下, 离子强度较小, 有利于避免产生较大的焦耳热, 使整个缓冲体系较稳定, 但是, 软骨藻酸(DA)的电色谱分离峰形展宽且峰高偏低, 在NaH2PO4-Na2HPO4缓冲体系当中, DA电色谱峰形尖锐不拖尾, 且峰高响应较好. 综合考虑, 选择磷酸盐缓冲液作为实验运行缓冲液.
2.1.2 缓冲液pH值的影响
软骨藻酸(DA)含有三个羧基和一个氨基基团, pKa值分别为2.10、 3.72、 4.93、 9.82, 根据缓冲液pH值的不同, DA拥有不同的荷电状态和电离能力. 如图2所示, 当pH为3.00时, AEPTS正电荷化程度大, 电渗流强度大, 此时DA解离程度低, 负电荷量较少, 电泳速度小, 导致DA与背景中溶剂物质(水峰)合在一起, 峰高响应极弱; pH值为3.50时, AD仍主要处于一级解离, 解离程度有所增强, 与pH 3.00相比峰高有所增加; 当pH值为4.00时, AEPTS正电荷化程度受到弱化, DA分子中有两个羧基解离, 带负电量明显增大, DA电泳速度有所提高, DA峰在水峰之前, 峰高响应明显增强; pH值为4.50时, 流动相洗脱能力随着pH值降低而变弱, DA洗脱减少, 响应信号有所降低; 当pH值增大为5.00和5.50时, AEPTS正电荷化程度受到弱化, DA解离程度加大, 可以带有三个单位负电荷, DA电泳速度大幅增强, 线性速度超过EOF, AD出峰变快(迁移时间约6 min). 由于pH 值为5.00和5.50时, 流动相洗脱能力随着pH值降低而变弱, 固定相表面吸附的DA洗脱减少, 故而DA响应比pH 值为4.00时降低明显. 综上情况, 实验选择pH 值为4.00的条件, 在电泳作用和电渗流作用二者的共同作用下, DA出峰时间较快, 峰响应强度高.
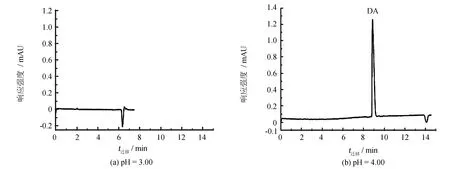

图2 缓冲液pH值对软骨藻酸迁移的影响Fig.2 Effects of pH value of running buffer on migration time of DA
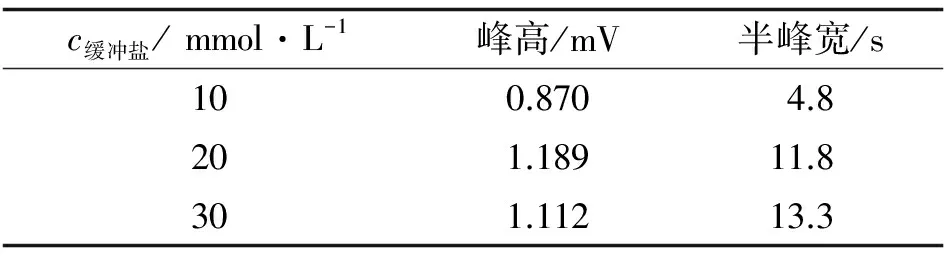
c缓冲盐/mmol·L-1峰高/mV半峰宽/s100.8704.8201.18911.8301.11213.3
2.1.3 缓冲液盐浓度的影响
随着缓冲盐浓度的增加, 焦耳热增大, 电渗流降低, 带电溶质在开管柱内的迁移速率变慢, 迁移时间延长. 实验优化了不同浓度缓冲液(10~30 mmol·L-1), 当缓冲液浓度为30 mmol·L-1时, 缓冲液离子强度大, 表观电流显著增大, 焦耳热增大, 溶质扩散加剧, 峰形展宽; 当使用较低浓度缓冲液(10 mmol·L-1)时, DA迁移时间虽然较快, 但是缓冲液与样品的盐度差异降低, 场放大效应降低, 峰高响应有所降低, DA检出灵敏度下降(见表1). 在20 mmol·L-1的盐浓度条件下, DA峰高响应良好, 且基线噪音也较小, 检测体系较稳定. 同时, 考虑到贝类样品分析时, 提液中背景基质浓度也会相对较高, 实验选择缓冲液盐浓度为20 mmol·L-1.
2.1.4 分离电压的影响
分离电压主要影响分析时间与分离效果两个方面. 分离电压越高, 样品的迁移时间越短, 但分离的效果会下降; 如果分离电压过低, 又会使迁移时间变长. 经过实验考察, 发现当分离电压为-18 kV时, DA分析时间最短, 峰形、 出峰时间最理想. 当电压高于-18 kV时, 由于此时焦耳热效应明显, 基线波动较大, 使整个检测体系较不稳定. 综合考虑分析时间和体系的稳定性, 实验选择了-18 kV为最佳分离电压.
2.1.5 进样时间和进样电压的影响
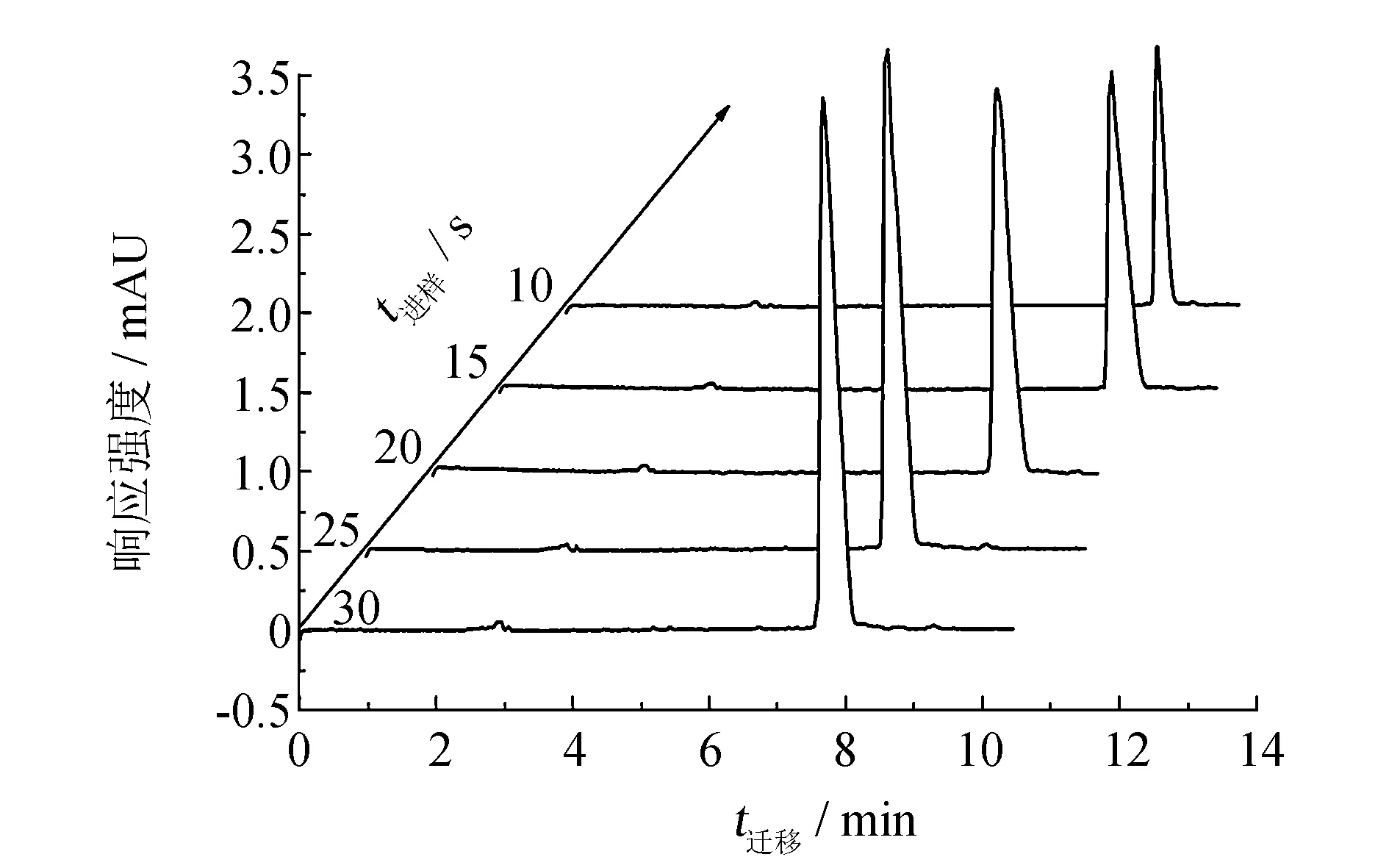
图3 进样时间对软骨藻酸峰高的影响 Fig.3 Effects of injection time on the OTCEC-UV analysis of DA
实验采用电动进样, 进样时间与进样电压的变化与样品峰高的响应大小有关. 在进样电压为-18 kV时, 考察了不同进样时间对DA出峰情况的影响. 如图3所示, 随着进样时间的延长, 峰高响应增强, 峰面积增大, 峰形出现明显的展宽. 当进样时间为30 s时, DA峰形展宽最为严重. 进样时间为10 s时, 峰高响应较弱, 峰形对称, 且无明显展宽. 当进样时间一定(25 s), 如果进样电压小, 则样品的进样量也少, 则峰高响应较弱. 进样电压过大, 虽然会使得峰高增大, 但也会使样品峰出现展宽拖尾情况.
实验考察了进样电压为-13~-18 kV时DA的出峰情况, 结果表明, 当进样时间一定, 进样电压为-18 kV时, DA的峰高响应最好, 当进样电压高于-18 kV时, DA的峰高响应增加不明显, 峰形却严重展宽. 综合考虑DA检测灵敏度和峰形, 实验选择了进样电压为-18 kV、 进样时间为25 s.
2.2 线性范围、 检测限与重现性
在最优条件下, 开管柱电色谱对一系列不同浓度的DA标准混合液进行分析测定, 以谱图上的峰面积所对应的DA质量浓度进行线性回归分析, 所得的线性范围、 线性回归方程、 相关系数和检测限见表2. 由表2可知, DA在0.12~5.00 μg·mL-1范围内线性关系良好, 检测限(S/N=3)为0.03 μg·mL-1. 考察实验的重复性, 将1 μg·mL-1DA标准溶液, 在一天内连续进样5次和连续3 d内分别对相同浓度的DA溶液进行分析, 通过测定相对标准偏差 RSD (%)检测软骨藻酸迁移时间和峰强度的重现性, 测得迁移时间和峰面积的日内相对标准偏差(RSD)分别为3.9%和4.2%, 日间RSD分别为5.2%和6.8%.
在最佳分析条件下, 按照1.3中的扇贝样品处理步骤, 对扇贝未加标的提取液进行分析, 未能检出DA. 采用质谱对照分析, 扇贝未加标的提取液测定结果相同, DA未检出. 实验将此样品视为空白样, 在空白扇贝样中, 对于未经净化的提取液, 盐浓度和背景基质浓度较高, 存在若干氨基酸等杂质峰, 但是并未对DA样品峰产生干扰, 分离情况良好. 为了准确测定实际样品环境中DA的含量, 往此空白提取液中依次加入DA标准溶液, 建立了一系列浓度的样品加标样, 测定了扇贝样品的DA工作曲线, 如表3, DA检出限为0.25 μg·mL-1, 即相当于1 μg·g-1软骨藻酸贝肉.

表2 软骨藻酸线性范围及检测限*
注*:实验条件为: 柱子, 60 cm×50 μm i.d.; 流动相, 20 mmol·L-1NaH2PO4-Na2HPO4(pH4.00); 分离电压, -18 kV; 电动进样 (-18 kV, 25 s)
**:y为峰面积;x为分析物浓度(μg·mL-1)

表3 扇贝提取液中DA测定工作曲线
注: 实验条件同表2
2.3 样品分析
对扇贝提取液直接进行分析, 如图4所示, 在空白扇贝样中, 对于未经净化的提取液, 存在若干杂质峰(具有紫外吸收的色氨酸等氨基酸), 但并未对DA样品峰产生干扰, 分离情况良好. 向提取液中加入10.0、 5.0、 1.0 μg·mL-1(等效于按照40、 20、 4 μg·g-1)的软骨藻酸DA标准样, 通过开管柱电色谱分析检测, 并进行回收率测定. DA实际样品加标的回收率为80.5%~83.1%, RSD<8.5%(见表4), 结果良好.
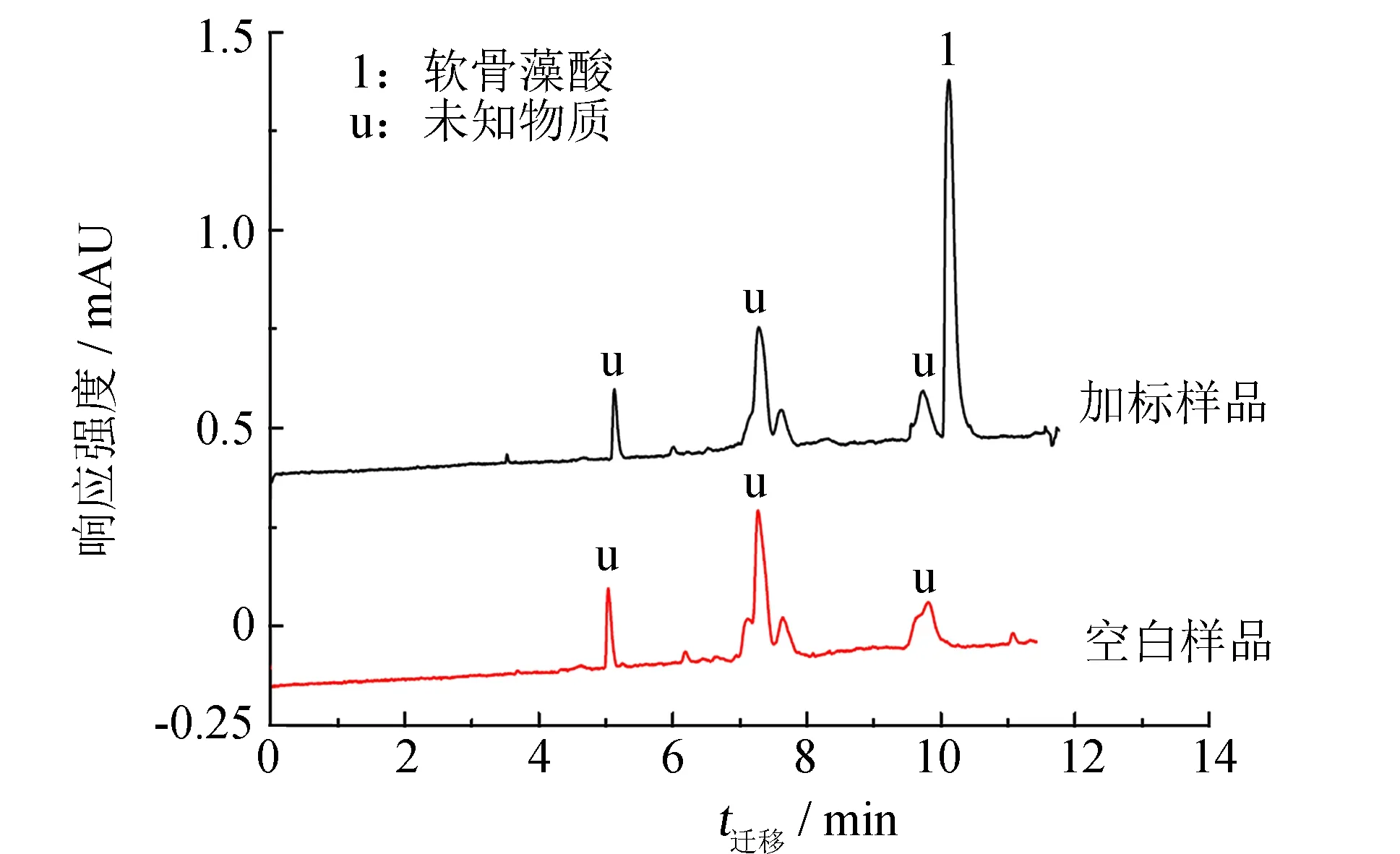
图4 扇贝中软骨藻酸的加标样品OTCEC分析 Fig.4 Electrochromatogram of extracting samples of scallop tissue spiked with DA standard solution
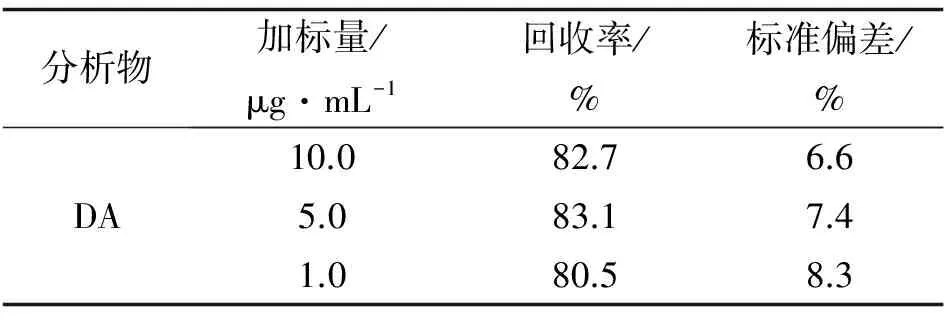
分析物加标量/μg·mL-1回收率/%标准偏差/%DA10.082.76.65.083.17.41.080.58.3
注: 实验条件同表2
3 结语
基于N-氨乙基-3-氨丙基甲基二甲氧基硅烷(AEPTS)键合开管柱, 探索了软骨藻酸DA在AEPTS键合开管柱中的电色谱分离行为, 结合简便的UV检测技术, 建立了遗忘性贝类毒素(软骨藻酸)的OTCEC快速微分离技术, 实现了贝肉食品中软骨藻酸(DA)的快速分析. 所建立的方法中贝肉提取液不必经过净化即可直接进样, DA的检测限为0.25 μg·mL-1(等效于贝肉中DA的浓度1.0 μg·g-1), 低于贝肉中DA的浓度20 μg·g-1的食品安全最大限量, 方法简单, 在10 min左右实现DA实际样品的分析, 速度较快, 加标回收率为80.5%~83.1%, RSD<8.5%, 结果良好. 对于贝类食品中的微量软骨藻酸的监测具有良好意义.
[1] Kreuzer M P, Pravda M, O’Sullivan C K,etal. Novel electrochemical immunosensors for seafood toxin analysis[J]. Toxicon, 2002, 40(9): 1 267-1 274.
[2] Smith D S, Kitts D D. Enzyme immunoassay for the determination of domoic acid in mussel extracts[J]. Journal of Agricultural and Food Chemistry, 1995, 43(4) : 367-371.
[3] Bal-Price A, Brown G C. Inflammatory neurodegeneration mediated by nitricoxide from activated glia- inhibiting neuronal respiration causing glutamate release and excitotoxicity[J]. The Journal of Neuroscience, 2001, 21(17): 6 480- 6 491.
[4] Yang Yuanzhong, Boysen R I, Hearn M T W,etal. Hydrophilic interaction chromatography coupled to electrospray mass spectrometry for the separation of peptides and protein digests[J]. Journal of Chromatography A, 2009, 1 216 (29): 5 518-5 524.
[5] Martins J M L, Gago-Martinez A, Dabek-Zlotorzynsk E,etal. Preliminary results on the application of capillary electrochromatography to the analysis of domoic acid[J]. Journal of Separation Science, 2002, 25(5/6): 342-344.
[6] Wu Weimin, Wu Xiaoping, Xie Zenghong,etal. Quantification of domoic acid in shellfish tissues by pressurized capillary electrochromatography[J]. Journal of Separation Science, 2009, 32(12): 2 117-2 122.
[7] Gago-Martínez A, Pieiro N, Aguete E C,etal. Further improvements in the application of high-performance liquid chromatography, capillary electrophoresis and capillary electrochromatography to the analysis of algal toxins in the aquatic environment[J]. Journal of Chromatography A, 2003, 992(1/2): 159-168.
[8] Liu Zhen, Otsuka K, Terabe S. Evaluation of extended light path capillary and etched capillary for use in open tubular capillary electrochromatography[J]. Journal of Chromatography A, 2002, 961(2): 285-291.
[9] Zhang Xiaowei, Lin Xucong, Chen Zhenbin,etal. Triamine-bonded stationary phase for open tubular capillary electrochromatography[J]. Journal of Separation Science, 2010, 33(20): 3 184-3 193.
(责任编辑: 洪江星)
Rapid profile of amnesic shellfish toxin in shellfish food by open-tubular capillary electrochromatography
CHEN Qing’ai1, LI Lin2, LIN Xucong2
(1.Tourism Department, Fujian Commercial College, Fuzhou, Fujian 350012, China;2. College of Chemistry, Fuzhou University, Fuzhou, Fujian 350116, China)
A rapid profile of amnesic shellfish toxin (viz. domoic acid, DA) in shellfish meat has been gained by open-tubular capillary electrochromatography (OTCEC) using an open-tubular column functionalized by 3-[2-(2-Aminoethylamino-ethylamino]propyl trimethoxysilane (AEPTS). The chromatographic behavior of DA in OTCEC was studied, and the effects of several analytical parameters including the composition, pH value and concentration of the buffer solution, separation voltage, and the injection value were investigated and optimized. Under the optimal conditions (NaH2PO4-Na2HPO4bufffer, 20 mmol·L-1, pH 4.00, injection voltage -18 kV, separation voltage -18 kV, injection time 25 s), a linear relationship between the DA concentration and CE peak intensity could be obtained in the range of 0.12 to 5.00 μg·mL-1with a detection limit (S/N=3) of 0.03 μg·mL-1. Applied to shellfish foods, the extraction samples of scallop meats could be directly detected without any purification treatment. The calibration curve of real extraction samples of scallop tissue was obtained from 0.50 to 10.00 μg·mL-1, and the detection limit (S/N=3)of 0.25 μg·mL-1(equal to the content of DA at 1.0 μg·g-1in total tissues ) . Satisfactory recoveries of fortified samples ranged from 80.5% to 83.1% were obtained with the RSD less than 8.5%.
amnesic shellfish toxin; open-tubular capillary electrochromatography; shellfish meat; food
10.7631/issn.1000-2243.2015.04.0560
1000-2243(2015)04-0560-05
2015-05-08
林旭聪(1976- ), 博士, 教授, 主要从事环境和食品安全分析研究, xulin@fzu.edu.cn
国家自然科学基金资助项目(21277026); 福建省科技计划重点资助项目(2013Y0061)
O657.7
A
