吡格列酮在大鼠放射性肺纤维化中保护作用的研究
2015-06-01孙宇楠张振勇曾越灿
吴 荣,孙宇楠,张振勇,曾越灿,曹 硕
吡格列酮在大鼠放射性肺纤维化中保护作用的研究
吴 荣*,孙宇楠,张振勇,曾越灿,曹 硕
目的 探讨吡格列酮在放射性肺纤维化中的保护作用,以及对AT1R(血管紧张素Ⅱ 1型受体表达的影响。方法 SD大鼠60只,共分为5组。空白组:不接受任何干预;照射+安慰剂组:接受12 Gy照射+安慰剂干预;单独给药组:接受吡格列酮10 mg/(kg·d)干预;照射+吡格列酮a组:接受12 Gy照射+吡格列酮10 mg/(kg·d)干预;照射+吡格列酮b组:接受12 Gy照射+吡格列酮20 mg/(kg·d)干预。采用HE及Masson染色观察大鼠肺组织纤维化情况;采用免疫组化观察AT1R在肺组织中的分布情况;采用蛋白免疫印迹杂交及RT-PCR检测AT1R蛋白及mRNA的表达情况。结果 HE及Masson染色显示,受照射大鼠肺组织细胞出现变性、坏死,肺组织出现明显纤维化;大鼠给予吡格列酮干预后,受照射大鼠的肺组织损伤减轻,肺组织纤维化减轻;免疫组化提示,照射后大鼠肺组织及上皮细胞中AT1R表达较空白组及单独给药组明显,照射+吡格列酮组的AT1R表达较照射+安慰剂组少;Western blot及RT-PCR提示,接受吡格列酮干预的受照射大鼠,AT1R蛋白及mRNA表达水平被明显抑制。结论 吡格列酮在放射性肺纤维化中具有保护作用,其可能通过下调AT1的表达来实现对放射性肺损伤的保护作用。
放射性肺纤维化;吡格列酮;血管紧张素Ⅱ 1型受体;过氧化物酶体增殖物激活受体γ
0 引言
放射治疗是胸部恶性肿瘤的主要治疗方式之一,放射性肺损伤是胸部肿瘤放疗的常见不良反应。放射性肺纤维化是放射性损伤的晚期并发症,可导致呼吸困难,影响患者的生活质量,甚至导致呼吸衰竭,目前尚无特异性的肺纤维化治疗手段[1]。过氧化物酶体增殖物激活受体(PPARs)是核激素受体超家族的配体活化的核转录因子,越来越多的证据表明自然和合成的PPARγ激动剂在体外都具有强大的抗纤维化作用,吡格列酮为合成的PPARγ激动剂[2]。本课题组前期的研究提示,血管紧张素Ⅱ(Angiotensin Ⅱ)是放射性肺纤维化形成的重要因素[3]。Angiotensin Ⅱ的这种作用主要通过血管紧张素Ⅱ 1型受体(Angiotensin type Ⅱ 1 receptor,AT1R)实现[4]。本课题组研究提示[5],PPARγ作为一种保护性蛋白,在未用体外激动剂的情况下,PPARγ生理性升高不足以抑制致纤维化蛋白的活性。目前尚无大鼠放射性肺纤维化模型中PPARγ对AT1R影响的研究。
放射性肺纤维化目前尚缺乏有效的治疗方法,在前期研究证实血管紧张素Ⅱ在放射性肺纤维化中起重要作用的基础上,本文拟研究吡格列酮在放射性肺纤维化中的保护作用,以及对AT1受体表达的影响。
1 材料与方法
1.1 动物分组及干预(动物模型建立) SPF级Sprague Dawley(SD)大鼠60只,雌雄各半,月龄3个月,体重178~245 g,购自中国医科大学实验动物中心。将75只大鼠应用随机数字表法随机分为5组,每组12只。空白组:不接受任何干预;照射+安慰剂组:接受12 Gy照射+安慰剂干预;单独给药组:接受吡格列酮10 mg/(kg·d)干预;照射+吡格列酮a组:接受12 Gy照射+吡格列酮10 mg/(kg·d)干预;照射+吡格列酮b组:接受12 Gy照射+吡格列酮20 mg/(kg·d)干预。大鼠按照100 g/0.3 mL的量给予水合氯醛腹腔注射麻醉,麻醉后右侧胸腔彩超定位,放置于直线加速器下照射。使用6 MV高能X射线,采用前后对穿照射的方法,源皮距100 cm,右侧胸腔(单侧肺)彩超扫描确定照射野大小,照射剂量300 cGy/min。照射完后6 h之内,除空白组外,对所有鼠行第1次灌胃处理,照射+安慰剂组灌入2 mL蒸馏水,单独给药组及照射+吡格列酮组分别灌入相应量的吡格列酮。此后每天灌胃1次,每7天测量1次体重,根据体重调整灌药量,行灌胃处理30 d,分笼饲养至3个月。
照射后3个月标本取材,用水合氯醛过量麻醉法处死大鼠,取其右侧肺组织,用生理盐水洗净血液后,用剪刀将其横断,一半迅速放于4%中性甲醛固定液中固定,48 h后转入70%乙醇中保存;另一半放入-80 ℃深冻冰箱中保存。
1.2 检测指标
1.2.1 肺组织HE、Masson染色观察肺损伤及纤维化情况 免疫组织化学观察AT1表达。HE染色过程:将保存于70%乙醇中的肺组织取出,小心取下约5 mm×5 mm×5 mm大小的肺横断面组织放入包埋盒中,经过脱水、透明、浸蜡、包埋后制成组织蜡块,在切片机上连续切成厚度约4 μm的组织切片,捞片,放入60 ℃烤箱中烘干备用。将片子放入100%二甲苯中脱蜡10 min×2,用无水乙醇洗去二甲苯4 min,后用95%、80%、70%乙醇各洗1 min,PBS和蒸馏水各冲洗1 min。HE特殊染色:0.2%醋酸水溶液洗10 s,5%磷钨酸10 min,0.2%醋酸水溶液浸洗2次,2%苯胺蓝液染色5 min,0.2%醋酸水溶液洗2次,梯度乙醇脱水二甲苯透明,中性树胶封片。在光学显微镜下观察肺组织损伤情况。Masson染色过程:常规石蜡切片脱蜡后,行Masson染色,光镜下观察肺组织细胞呈红色或黄色,胶原纤维呈蓝绿色,拍片,扫描,采用图像分析仪测定肺组织胶原含量。免疫组化过程:SP法免疫组化染色,染色步骤按说明书进行,抗体的工作浓度为1∶100。用磷酸盐缓冲液代替一抗作阴性对照,用预试验中已知的阳性片作阳性对照。
1.2.2 蛋白免疫印迹杂交(Western blotting)法检测AT1表达 提取大鼠肺组织蛋白并测定蛋白浓度,SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶封闭2 h。一抗(小鼠抗AT1单克隆抗体)(1∶3 000)孵育PVDF,4 ℃过夜;1×TBST洗5 min×5次;将二抗(HRP标记山羊抗鼠IgG抗体)(1∶2 000)室温孵育2 h;1×TBST洗5 min×5次;ECL显影;以GAPDH作为内参照物,相同实验重复3次。
1.2.3 RT-PCR(实时荧光定量逆转录聚合酶链反应)法检测AT1 mRNA表达水平 AT1上游引物:5′-CACCTATGTAAGATCGCTT-3′,下游引物:5′-GATGATGATGCAGGTGACT-3′,扩增片段长度:162 bp;GADPH上游引物:5′-TGACATCAAGAAGGTGGTGA-3′,下游引物:5′-TCATACCAGGAAATGAGCTT-3′,扩增片段长度:177 bp。实验步骤按说明书进行。

2 结果
2.1 动物模型建立情况 36只大鼠接受了直线加速器对右侧肺的对穿照射,照射时用铅块(或多叶光栅)挡住除暴露右肺外的其他器官。在饲养过程中,照射+吡格列酮a组有1只大鼠在照射后死亡,照射+吡格列酮b组有1只大鼠在照射后死亡,照射+安慰剂组没有大鼠死亡。所有经过照射的大鼠都出现体重下降明显等症状。空白组没有大鼠死亡。共有58只大鼠完成实验:空白组12只,照射+安慰剂组12只,单独给药组12只,照射+吡格列酮a组11只,照射+吡格列酮b组11只。
2.2 常规HE及Masson染色结果 在×400镜下观察(图1 HE染色部分),接受照射的大鼠肺组织出现较为明显的肺组织损伤,肺泡及支气管上皮细胞排列紊乱,部分细胞出现变性及坏死,细胞核排列不规则,其中照射+安慰剂组(图1c)损伤较其他照射组重,接受吡格列酮干预的大鼠肺组织损伤程度较不接受吡格列酮干预的大鼠轻。Masson染色结果提示,照射后大鼠肺组织纤维化明显(蓝色,见图1 Masson染色部分),照射+安慰剂组纤维化较其他组明显(P<0.05)。接受吡格列酮干预可降低照射所引起的纤维化程度,吡格列酮干预高剂量组此效果更明显(见图1、表1,P<0.05)。
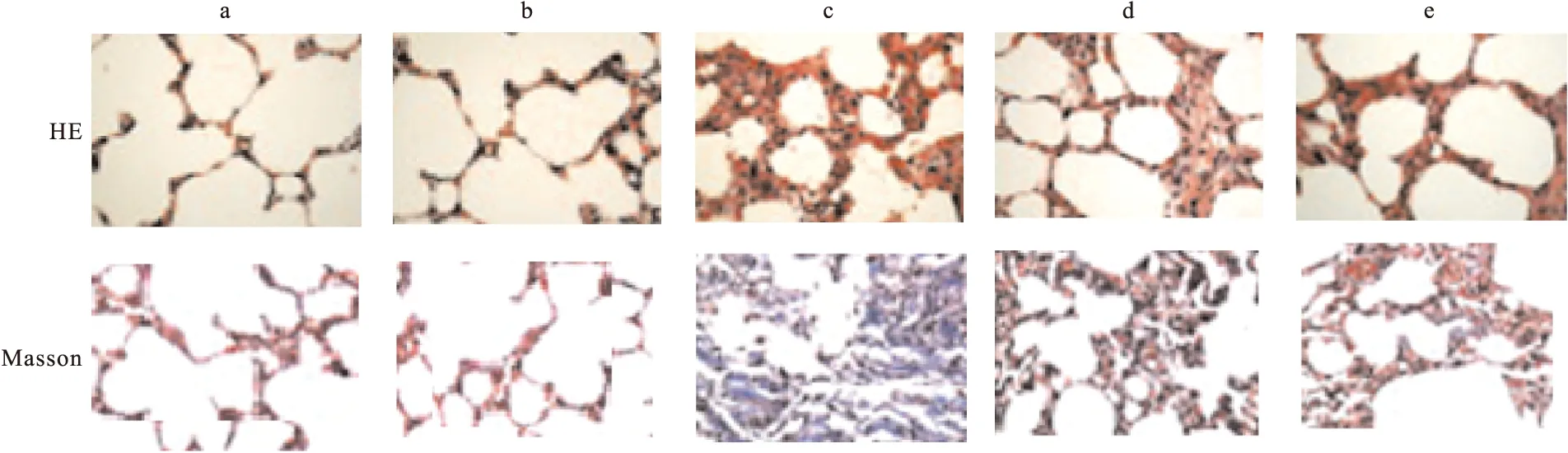
图1 HE、Masson染色结果
注:a.空白组,b.单独给药组,c.照射+安慰剂组,d.照射+氯沙坦a组,e.照射+氯沙坦b组。肺组织HE染色提示,肺组织损伤,肺泡及支气管上皮细胞排列紊乱,部分细胞出现变性及坏死,细胞核排列不规则,其中照射+安慰剂组损伤较其他照射组重,接受吡格列酮干预的大鼠肺组织损伤程度较不接受吡格列酮干预的大鼠轻(×400)。Masson染色结果提示,照射后大鼠肺组织纤维化明显(蓝色),照射+安慰剂组纤维化较其他组明显;接受吡格列酮干预可降低照射所引起的肺纤维化程度(×400)

表1 实验后大鼠肺组织纤维化评分情况
注:*与照射+吡格列酮a或b组比较,P<0.05;#与照射+安慰剂组比较,P<0.05
2.3 免疫组化情况 AT1R免疫组化提示,照射后大鼠肺组织中肺泡及支气管上皮细胞中AT1R表达较空白组及单独药物组明显。照射+吡格列酮a组与照射+吡格列酮b组的AT1R表达较照射+安慰剂组少,提示吡格列酮在放射性肺损伤中具有保护作用。见图2。
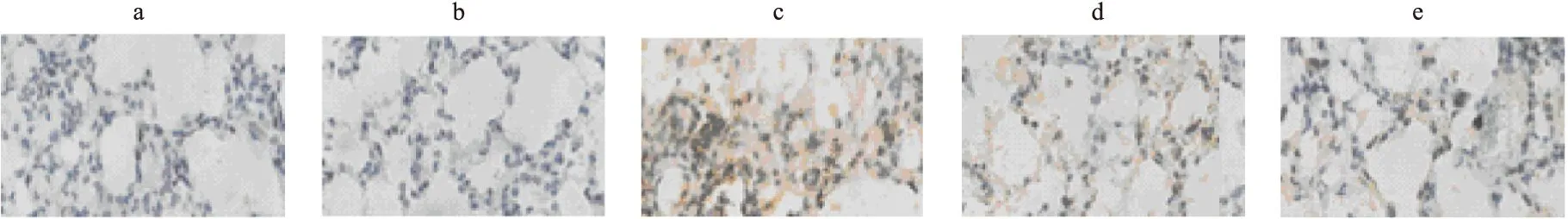
图2 AT1R免疫组化结果
注:a.空白组,b.单独给药组,c.照射+安慰剂组,d.照射+吡格列酮a组,e.照射+吡格列酮b组。肺组织AT1R免疫组化提示,照射后大鼠肺组织及内皮细胞中AT1R表达较空白组及单独药物组明显。照射+吡格列酮a组与照射+吡格列酮b组的AT1R表达较照射+安慰剂组少(×200)
2.4 Western blot结果 AT1R蛋白表达情况,照射+安慰剂组的AT1R蛋白表达较其他组明显;照射+吡格列酮a组的AT1R蛋白表达较照射+吡格列酮b组明显(P<0.05),较空白组及单独给药组也明显。大鼠肺组织接受放射线照射后,AT1R蛋白表达升高,吡格列酮干预可降低照射所引起的AT1R蛋白表达升高,吡格列酮干预高剂量组此效果更明显(见图3、图4,P<0.05)。
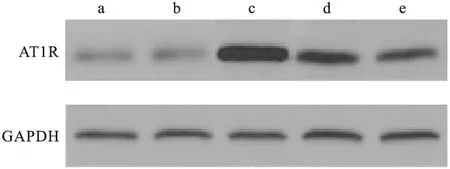
图3 AT1R蛋白表达情况
注:a.空白组,b.单独给药组,c.照射+安慰剂组,d.照射+吡格列酮a组,e.照射+吡格列酮b组。照射+安慰剂组的AT1R蛋白表达较其他组差异有统计学意义(P<0.05);照射+吡格列酮a组的AT1R蛋白表达较照射+吡格列酮b组差异有统计学意义(P<0.05),较空白组及单独给药组差异有统计学意义
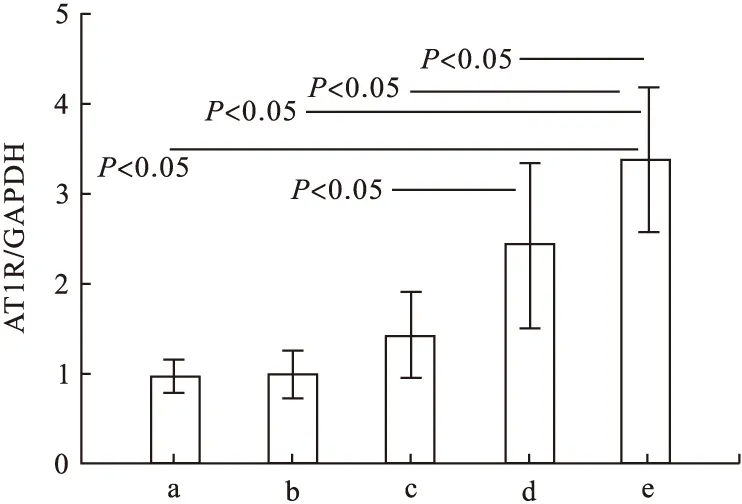
图4 AT1R蛋白相对表达量
注:a.空白组,b.单独给药组,c.照射+安慰剂组,d.照射+吡格列酮a组,e.照射+吡格列酮b组
2.5 RT-PCR结果 照射+安慰剂组的AT1 mRNA表达较其他组明显;照射+吡格列酮a组的AT1 mRNA表达水平较照射+吡格列酮b组明显,较空白组及单独给药组均明显,提示大鼠肺组织接受放射线照射后,AT1 mRNA表达水平升高,吡格列酮干预可降低照射所引起的AT1 mRNA表达升高,吡格列酮干预高剂量组此效果更明显(见图5,P<0.05),这一结论与Western blot结果一致。
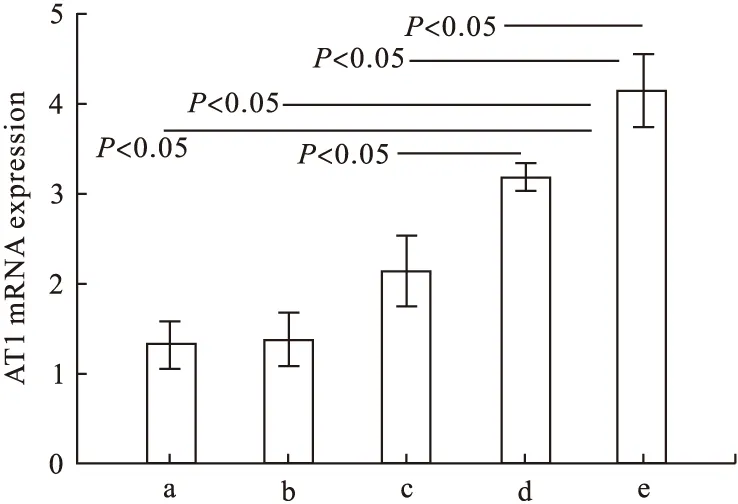
图5 RT-PCR检测AT1 mRNA相对表达水平
注:a.空白组,b.单独给药组,c.照射+安慰剂组,d.照射+吡格列酮a组,e.照射+吡格列酮b组
3 讨论
放射治疗已被广泛用于治疗胸部恶性肿瘤,而放射性肺损伤,特别是放射性肺纤维化是影响患者生活质量甚至威胁生命的常见并发症[6]。成纤维细胞的分化和激活是肺纤维化中的一个关键致病过程[2-7]。放射性肺损伤的现有治疗主要为控制炎症,长期使用糖皮质激素,期望通过对肺炎的控制来延缓肺纤维化的进程。然而这种治疗无明确的益处,激素长期应用后的不良反应是重要挑战[1]。
PPARs是核激素受体超家族的配体活化的核转录因子,参与脂代谢,细胞分化、增殖,细胞凋亡,炎症等多种重要途径[2]。PPARs分为3种亚型:PPARα、PPARβ/δ和PPARγ,而PPARγ在肺部疾病中的作用研究最具前景[8-9]。有研究提示,PPARγ在肺及心脏中具有抗纤维化作用[5,10-13]。
Ang Ⅱ是一种潜在的促纤维化介质,可诱导人肺成纤维细胞增殖和胶原蛋白的合成[14]。前期研究证实,Ang Ⅱ和TGF-β1在放射性肺纤维化中表达升高[3]。研究表明,Ang Ⅱ促进肺成纤维细胞活化增殖的作用是通过AT1R实现的[15]。AT1R信号的沉默可抑制Ⅰ型胶原蛋白的表达[16]。
某些血管紧张素受体抑制剂(ARBs),如替米沙坦,也是PPARs的部分激动剂,表明体内AT1R的作用部分是通过PPARγ介导的[17]。血管平滑肌细胞(VSMC)的体外研究显示,激活的PPARγ可抑制AT1R基因表达,反之亦然[18]。Zhao等[19]证明,激活PPARγ可以下调AT1R表达,从而减弱AngⅡ诱导的胶原合成导致的纤维化,在受体水平抑制RAS系统的活性。心房纤维细胞中吡格列酮可抑制AngⅡ诱导的成纤维细胞表达和增殖[20-21]。这些研究表明,PPARγ激动剂的作用有一部分是通过AT1R介导的,预示着在纤维化进程中,PPARγ和AT1R必然存在联系。
从本实验中可以看到,照射+安慰剂组大鼠肺组织纤维化较其他组明显,AT1R表达也较其他组显著,应用吡格列酮干预后,放射性肺损伤、肺纤维化减轻,且随着给药剂量的增加,这种作用更加明显(图1,表1,P<0.05),而免疫组化提示肺组织AT1R的表达量明显减少(图2,P<0.05)。单独给药组和空白组之间无差异。Western blot和RT-PCR检测提示,吡格列酮干预后,AT1R 蛋白及mRNA表达量降低,并且与剂量强度相关,随着吡格列酮用量的增加,AT1R 蛋白及mRNA表达水平下降越明显,其抗肺纤维化效果越显著(图3~图5,P<0.05)。目前吡格列酮已用于临床治疗糖尿病,且有研究证实,PPARγ配体有抑制肺癌和放疗增敏的作用[22],预示着PPARγ激动剂应用于肺癌患者可能会获得多种临床价值。
综上所述,吡格列酮在放射性肺损伤中具有保护作用,其可能通过下调AT1的表达来实现对放射性肺纤维化的保护作用。但是具体通过何种信号通路及机制实现这一调节过程仍需更深入的研究[22-23]。
[1] Ding NH,Li JJ,Sun LQ.Molecular mechanisms and treatment of radiation-induced lung fibrosis[J].Curr Drug Targets,2013,14(11):1347-1356.
[2] Kulkarni AA,Woeller CF,Thatcher TH,et al.Emerging PPARγ-independent role of PPARγ ligands in lung diseases[J].PPAR Res,2012:705352.
[3] 曹硕,吴荣.血管紧张素Ⅱ醛固酮在放射性肺损伤中的表达[J].中国肿瘤临床,2013,40(5):253-256.
[4] Chen FP,Gong LK,Zhang L,et al.Early lung injury contributes to lung fibrosis via AT1 receptor in rats[J].Acta Pharmacol Sin,2007,28(2):227-237.
[5] Gao S,Wu R,Zeng Y.Up-regulation of peroxisome proliferator-activated receptor gamma in radiation-induced heart injury in rats[J].Radiat Environ Biophys,2012,51(1):53-59.
[6] Xu L,Xiong S,Guo R,et al.Transforming growth factor β3 attenuates the development of radiation-induced pulmonary fibrosis in mice by decreasing fibrocyte recruitment and regulating IFN-γ/IL-4 balance[J].Immunol Lett,2014,162(1 Pt A):27-33.
[7] Burgess HA,Daugherty LE,Thatcher TH,et al.PPARgamma agonists inhibit TGF-beta induced pulmonary myofibroblast differentiation and collagen production:implications for therapy of lung fibrosis[J].Am J Physiol Lung Cell Mol Physio,2005,288(6):L1146-L1153.
[8] Standiford TJ,Keshamouni VC,Reddy RC.Peroxisome proliferator-activated receptor-γ as a regulator of lung inflammation and repair[J].Proc Am Thorac Soc,2005,2(3):226-231.
[9] Simon DM,Arikan MC,Srisuma S,et al.Epithelial cell PPAR γ is an endogenousregulatorofnormallung maturation and maintenance[J].Proc Am Thorac Soc,2006,3(6):510-511.
[10]Belvisi MG,Mitchell JA.Targeting PPAR receptors in the airway for the treatment of inflammatory lung disease[J].Br J Pharmacol,2009,158(4):994-1003.
[11]Ciudin A,Hernandez C,Simó R.Update on cardiovascular safety ofPPAR γ agonists and relevance to medicinal chemistry and clinical pharmacology[J].Curr Top Med Chem,2012,12:585-604.
[12]Deng YL,Xiong XZ,Cheng NS.Organ fibrosis inhibited by blocking transforming growth factor-β signaling via peroxisome proliferator-activated receptor γ agonists[J].Hepatobiliary Pancreat Dis Int,2012,11(5):467-478.
[13]Aoki Y,Maeno T,Aoyagi K,et al.Pioglitazone,a peroxisome proliferator-activated receptor gamma ligand,suppresses bleomycin-induced acute lung injury and fibrosis[J].Respiration,2009,77(3):311-319.
[14]Lang YD,Hung CL,Wu TY,et al.The renin-angiotensin system mediates hyperoxia-induced collagen production in human lung fibroblasts[J].Free Radic Biol Med,2010,49(1):88-95.
[15]Parra ER,Ruppert AD,Capelozzi VL.Angiotensin Ⅱ type 1 and 2 receptors and lymphatic vessels modulate lung remodeling and fibrosis in systemic sclerosis and idiopathic pulmonary fibrosis[J].Clinics(Sao Paulo),2014,69(1):47-54.
[16]Lang YD,Hung CL,Wu TY,et al.The renin-angiotensin system mediates hyperoxia-induced collagen production in human lung fibroblasts[J].Free Radic Biol Med,2010,49(1):88-95.
[17]Molteni A,Moulder JE,Cohen EF,et al.Control of radiation-induced pneumopathy and lung fibrosis by angiotensin-converting enzyme inhibitors and an angiotensin Ⅱ type 1 receptor blocker[J].Int J Radiat Biol,2000,76(4):523-532.
[18]Tiyerili V,Becher UM,Aksoy A,et al.AT1-receptor-deficiency induced atheroprotection in diabetic mice is partially mediated via PPAR γ[J].Cardiovasc Diabetol,2013,12:30.
[19]Zhao SM,Li HW,Guo CY,et al.Cardiac fibrosis in diabetic rats:regulation and mechanism of activation of the PPARgamma signal pathway[J].Chin J Physiol,2010,53(4):262-267.
[20]Gu J,Liu X,Wang QX,et al.Beneficial effects of pioglitazone on atrial structural and electrical remodeling in vitro cellular models[J].J Mol Cell Cardiol,2013,65:1-8.
[21]Takeda K,Ichiki T,Tokunou T,et al.Peroxisome proliferator-activated receptor gamma activators downregulate angiotensin Ⅱ type 1 receptor in vascular smooth muscle cells[J].Circulation,2000,102(15):1834-1839.
[22]Han EJ,Im CN,Park SH,et al.Combined treatment with peroxisome proliferator-activated receptor(PPAR)gamma ligands and gamma radiation induces apoptosis by PPARγ-independent up-regulation of reactive oxygen species-induced deoxyribonucleic acid damage signals in non-small cell lung cancer cells[J].Int J Radiat Oncol Biol Phys,2013,85(5):e239-e248.
[23]Burgess HA,Daugherty LE,Thatcher TH,et al.PPARgamma agonists inhibit TGF-beta induced pulmonary myofibroblast differentiation and collagen production:implications for therapy of lung fibrosis[J].Am J Physiol Lung Cell Mol Physio,2005,288(6):L1146-L1153.
Protective effects of pioglitazone on radiation induced lung fibrosis
WU Rong*,SUN Yu-nan,ZHANG Zhen-yong,ZENG Yue-can,CAO Shuo
(Department of Medical Oncology,Shengjing Hospital of China Medical University,Shenyang 110022,China)
Objective To investigate the protective effects of pioglitazone on radiation induced lung fibrosis,and the effects on the expression of AT1 receptor.Methods Sixty SD rats were divided into 5 groups.The blank group:without any intervention.The irradiation plus placebo group:receiving 12 Gy irradiation plus placebo intervention.The single drug group:receiving only 10 mg/(kg·d) pioglitazone intervention.The irradiation plus pioglitazone a group:receiving 12 Gy irradiation plus 10 mg/(kg·d)pioglitazone intervention.The irradiation plus pioglitazone b group:receiving 12 Gy irradiation plus 20 mg/(kg·d)pioglitazone intervention.HE and Masson staining were used to observe the lung tissue injury.The distributions of AT1R in lung tissue were observed by immunohistochemistry.The expression of AT1R protein and mRNA were detected by Western blot and RT-PCR.Results HE and Masson staining indicated that the lung tissue of irradiation rats showed degeneration and necrosis,the lung tissue appeared obvious fibrosis.When the rats were treated with pioglitazone after irradiation,the lung injury and fibrosis decreased.The immunohistochemical staining showed that after irradiation,the expressions of AT1R of lung tissue was more obvious than those of blank group and the single drug group.The expressions of AT1R of irradiation plus pioglitazone group was less obvious than that of irradiation plus placebo group.The Western blot and RT-PCR indicated that after the pioglitazone intervention,the expressions of AT1 protein and mRNA of irradiation rats were significantly inhibited.Conclusion Pioglitazone has protective effects on radiation induced lung fibrosis,possibly through the down-regulation of the expression of AT1R.
Radiation induced lung fibrosis;Pioglitazone;Angiotensin Ⅱ type 1 receptor;PPARγ
2014-10-09
中国医科大学附属盛京医院肿瘤科,沈阳 110022
国家自然科学基金资助项目(81201803)
10.14053/j.cnki.ppcr.201501004
*通信作者
