高剂量阿米卡星在PICU败血症患儿体内药代动力学的初步研究
2015-06-01翁志媛张又祥罗梅娟
翁志媛,张又祥,肖 雪,罗梅娟
高剂量阿米卡星在PICU败血症患儿体内药代动力学的初步研究
翁志媛,张又祥,肖 雪,罗梅娟
目的 初步探讨5 mg/kg阿米卡星在PICU患儿体内的药代动力学和血液动力学的关系。方法 纳入符合条件的30例革兰阴性败血症患儿进行阿米卡星药物治疗研究,通过非房室模型计算每例患儿的阿米卡星的药代动力学。结果 阿米卡星在革兰阴性败血症患儿体内平均药物分布为(0.36±0.07)L/kg,平均血液清除率为(3.88±0.97)mL/(min·kg)。肌酐清除率(CCR)与血清肌酸酐(SCr)相关性差异有统计学意义。结论 对PICU患儿应用高剂量阿米卡星(≥25 mg/kg)需要考虑败血症对血液动力学的影响,要密切监测败血症患儿血药浓度变化。
阿米卡星;药代动力学;败血症;重症患儿;高剂量
0 引言
重症感染患儿的治疗对于PICU医生是一个巨大挑战。重症患儿感染具有高发病率和高死亡率的特点[1-2]。阿米卡星是氨基糖苷类抗菌药物,在重症败血症和脓毒性休克患儿的治疗中具有重要的作用,在PICU中广泛应用于治疗危及生命的G-菌感染,具有良好的治疗效果[3-6]。阿米卡星具有与其他氨基糖苷类药物不同的结构,更适于治疗严重的感染。阿米卡星不会被普通细菌酶和低耐药性细菌所激活[7]。其药代动力学(PK)和药效学(PD)的关系与其他氨基糖苷类相似,具有剂量依赖性,药效具有浓度依赖性[8]。氨基糖苷类药物的药代动力学在PICU败血症患儿体内可能产生变化,进而影响患儿体内有效药物浓度[9]。因此,临床上评估阿米卡星剂量,普通人群的剂量-年龄关系不适用于重症患儿。这些新的药代动力学变化可能使阿米卡星的抗感染效果受到严重影响。因此,对于PICU败血症患儿,最佳的阿米卡星剂量可能高于常规剂量[10]。虽然已有氨基糖苷类药物代谢动力学研究[7,11-12],但是,高剂量的阿米卡星应用于PICU败血症患儿体内的药代动力学研究很少[10-13]。另外,由于PICU患儿可以具有不同的种族,患有不同疾病,关于氨基糖苷类药物代谢动力学资料的解释和指导实际临床应用比较复杂[14-15]。因此,本研究初步探讨首剂量5 mg/kg阿米卡星在重症败血症患儿体内的代谢动力学和血液动力学的关系,为此药的临床应用提供参考。
1 资料与方法
1.1 一般资料 收集2012年1月至2013年7月来我院PICU住院的30例严重败血症患儿。本项研究已经通过人与动物医学研究伦理学委员会的批准,每例患儿监护人被告知研究目的,并签署知情同意书。纳入标准:住院日期2012年1月至2013年7月;入院年龄≤28 d;符合全国统一新生儿败血症诊断标准;>1次血培养G-菌阳性;排除标准:大面积烧伤患儿(>20%体表面积),腹水,肾功能不全(肌酐清除率<60 mL/min),耳蜗前庭功能异常,重症肌无力,氨基糖苷类药物过敏,脑膜炎,心内膜炎,免疫缺陷,氨基糖苷类药物治疗超过2周者。根据抗菌药物治疗的经验,首剂量5 mg/kg阿米卡星静脉注射超过60 min,可以联合应用β内酰胺类或者青霉素类抗菌药物。
1.2 血药浓度检测 在静脉输液的0、0.25、0.5、1.5、4.0、8.0、12.0、18、24 h时,通过输液装置对每例患儿采集5 mL血液标本(不加抗凝剂),当血液完全凝集后(15~30 min),在4 ℃下进行离心,收集血清放入-80 ℃冰箱保存。通过荧光偏光免疫测定法,应用TDx分析仪(Germany)检测血清中阿米卡星的药物浓度。根据仪器使用说明,仪器检测的低限值是0.6 mg/L,低浓度时(5 mg/L)、中等浓度(15 mg/L)和高浓度(30 mg/L)的精确度分别是3.18%、2.62%和2.50%。
1.3 数据收集整理 记录所有患儿住院的基本信息,包括:年龄、性别、体重(TBW),根据APACHE Ⅱ(The Acute Physiology and Chronic Health Evaluation)对疾病进行严重性分级[16],记录中心静脉压(CVP),并进行入院和24 h后各项实验室检查:全血细胞计数(CBC),血清肌酸酐(SCr),血尿素氮(BUN),肝功能实验,电解质检测等。通过Cockcroft and Gault 方程式评估肌酸酐清除率(CrCl)[17]。
1.4 药代动力学检测 应用Non-compartmental模型分析每例患儿阿米卡星的药物代谢动力学的各个指标[18],药物分布的总容量Vd(Total volume of distribution),总体清除率Cl(Total body clearance),代谢半衰期(t1/2),24 h内曲线下面积AUC(Area under the curve),峰值(完全输液阿米卡星30 min后的浓度),波谷(开始输液24 h后的浓度)。国外有研究发现,预测Vd平均值0.4 L/kg、峰值>64 μg/mL为最佳浓度,毒性的阈值通过波谷>5 μg/mL来确定[10-12]。

2 结果
2.1 研究对象基本资料 30例重症患儿被确诊为严重败血症,具有阿米卡星治疗适应证,其基本信息和实验室检查结果见表1。

表1 一般资料
2.2 药物代谢动力学结果 阿米卡星主要的药代动力学参数见表2,血清浓度-时间曲线见图1。阿米卡星在重症患儿体内Vd和Cl分别为(0.36±0.07)L/kg、(3.88±0.94)mL/(min·kg),与非重症患儿[0.25 L/kg、1.37 mL/(min·kg)]比较,差异有统计学意义(P<0.05)[19-20]。
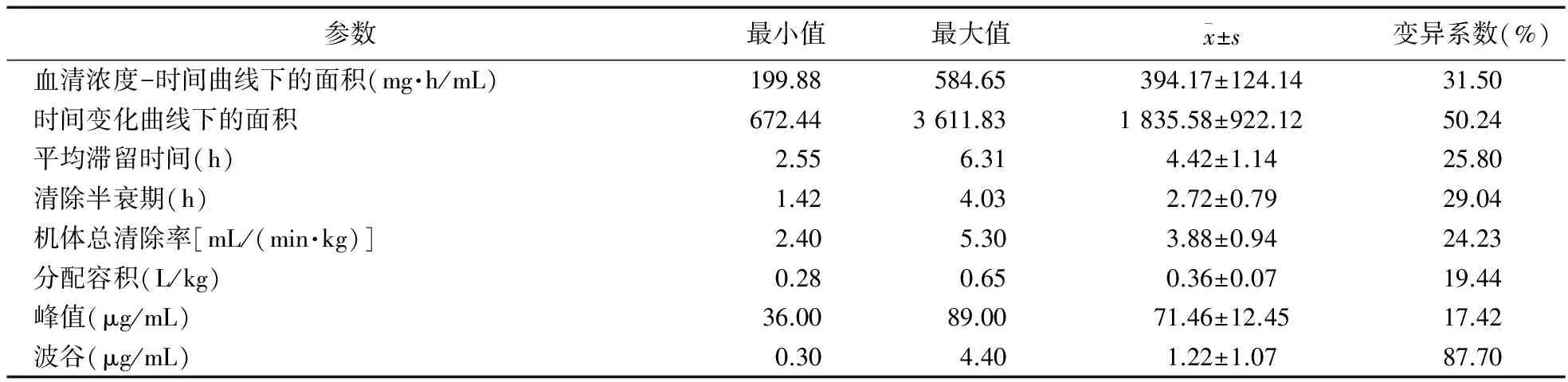
表2 研究对象的药代动力学参数结果
2.3 阿米卡星血液药物检测结果 75%重症患儿血清中阿米卡星的峰值浓度>64 μg/mL(见图2),患儿波谷浓度均≤5 μg/mL(见图3)。阿米卡星药代动力学各个参数之间的关系,患儿Vd、Cl和患儿的年龄、体重、APACHEⅡ、评分,CrCl和SCr之间都具有一定的相关性,见表3。APACHEⅡ评分与阿米卡星的Vd之间具有明显的相关性(P<0.05)。患儿阿米卡星Cl中,CrCl 与SCr之间具有明显的相关性(P<0.05)。其他变量与阿米卡星CI、Vd之间未发现明显的相关性。

图1 阿米卡星的浓度-时间曲线

表3 阿米卡星药代动力学与患儿相关因素间的关系

图2 阿米卡星的峰值浓度分布图

图3 阿米卡星波谷浓度的分布图
3 讨论
目前,高剂量阿米卡星对PICU败血症患儿的应用研究很少[10-13]。对于重症败血症患儿,阿米卡星的药代动力学产生很大的变化,因此,为达到有效血药浓度,需要给予更高剂量阿米卡星。重症患儿一般不会局限于同一种族人群,表现在疾病种类、严重程度和器官功能上均不同[14]。大部分在PICU应用药物的剂量都是参考非PICU患者或者正常志愿者临床试验研究的结果,这些研究的前提都是基于PICU患儿药代动力学参数和非PICU患儿相同[21-22]。
重症患儿的氨基糖苷类药物的药代动力学会受到很多因素的影响,表现为Vd增加,可以导致氨基糖苷类药物的血清药物峰值浓度下降[6-23]。本研究发现,重症患儿体内氨基糖苷类药物的平均Vd是(0.36±0.07)L/kg,明显高于非重症患儿的0.25 L/kg,差异有统计学意义[19]。该结果与许多关于败血症患儿研究结果相一致,证明败血症可以诱导Vd的改变[24-25]。
重症患儿体内Vd的变化受到许多因素的影响。细菌的内毒素可以导致大量炎性介质产生,影响血管内皮功能和增加渗透性[26]。水肿可以通过增加Vd和降低抗菌药物的血药浓度,导致临床上抗菌药物治疗失败[27]。并且,重症患儿体内的毛细血管渗透性,输液疗法,全胃肠外营养(TPN)都有可能扩充细胞外液和Vd,从而导致氨基糖苷类药物的血药浓度稀释[28]。通过APACHEⅡ评分结果提示,随着疾病加重,氨基糖苷类药物的Vd升高[29]。本研究发现,阿米卡星的Vd结果受到APACHEⅡ评分的影响,这与相关研究结果基本一致[29-30]。由APACHEⅡ评分的败血症严重性与氨基糖苷类药物的Vd具有一定相关性。本研究发现,败血症患儿的阿米卡星Cl明显高于非PICU患儿的Cl,高代谢败血症的庆大霉素清除率是非败血症患儿的1.5倍[23]。重症败血症患儿中,败血症引起的病理生理改变是由应激、血液动力学状态等决定的。药物干预对氨基糖苷类药物Cl的变化具有决定作用。机体因受到感染或者外伤等应激后,基础代谢率、氧耗量、血流速度和器官再灌注增加。重症败血症患儿肾动脉血流速度比非PICU患儿无器官功能障碍者高,从而促进氨基糖苷类药物的全身运输和代谢的速度[31]。
阿米卡星主要由肾小球滤过代谢,肾脏功能改变严重影响药物的清除率[32]。本研究结果发现,药物的清除率与Cl和CrCl具有明显的相关性,与相关研究结果一致[12-33]。阿米卡星的首剂量与药物的Vd具有一定的比例关系[34],因此,充足的首剂量药物对于保持有效的药物浓度具有重要的作用[35],从而也可以减少细菌耐药性发生的可能性。氨基糖苷类药物的肾毒性与波谷的药物浓度相关[36]。本研究发现,所有患儿的药物波谷浓度低于5 μg/mL。最佳氨基糖苷类的药物浓度对于增加药效、减少并发症具有重要的作用[5]。因此,基于我们的发现,通过应用5 mg/kg阿米卡星,虽然大部分患儿可以达到最佳峰值浓度,但是,在部分患儿体内仍然没有达到目标峰值浓度。因为阿米卡星具有浓度剂量依赖性,我们可以给予≥5 mg/kg的剂量,增强药物的效果。同时,因为低波谷的药物浓度,可以减少药物肾毒性的风险。
总之,阿米卡星的药效下降很可能与Vd和Cl的增加有关,因此,根据患儿的血液动力学变化,调整阿米卡星药物首剂量达到最佳药效,对于快速、有效地控制重症败血症具有重要意义。为了使阿米卡星的药效最大化,需要进行血液阿米卡星药物浓度监测和≥25 mg/kg的首剂量,这有利于确定更加精确的阿米卡星药物峰值浓度,从而使其发挥最大的效果,同时尽可能减少药物毒性。
[1] Brun-Bulsson C.PICU-acquired infections and sepsis:more of a deadly duo[J].Intensive Care Med,2008,34(5):793-795.
[2] Zeni F,Freeman B,Natanson C.Anti-inflammatory therapies to treat sepsis and septic shock:a re-assessment[J].Crit Care Med,2009,25(7):1095-1100.
[3] Kumar A,Roberts D,Wood KE,et al.Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock[J].Crit Care Med,2010,34:1589-1596.
[4] Leibovici L,Shraga I,Drucker M,et al.The benefit of appropriate empirical antibiotic treatment in patients with blood-stream infection[J].J Intern Med,2011,244(5):379-386.
[5] Fauvelle F,Perrin P,Belfayol L,et al.Fever and associated changes in glomerular filtration rate erase anticipated diurnal variations in aminoglycoside pharmacokinetics[J].Antimicrob Agent Chemother,2012,38(3):620-623.
[6] Vanhaeverbeek M.Pharmacokinetics of once-daily amikacin in elderly patients[J].Antimicrob Agent Chemother,2012,31:185-187.
[7] Lortholary O,Tod M,Cohen Y,et al.Aminoglycosides[J].Med Clin North Am,2012,79(4):761-787.
[8] Olsen KM,Rudis MI,Rebuck JA,et al.Effect of once-daily dosing vs.multiple daily dosing of tobramycin on enzyme markers of nephrotoxicity[J].Crit Care Med,2012,32(8):1678-1682.
[9] Buijk SE,Mouton JW,Gyssens IC,et al.Experience with a once-daily dosing program of aminoglycosides in critically ill patients[J].Intens Care Med,2012,28(7):936-942.
[10]Taccone FS,Laterre PF,Spapen H,et al.Revisiting the loading dose of amikacin for patients with severe sepsis and septic shock[J].Crit Care,2010,14(2):R53.
[11]Bressolle F,Gouby A,Martinez JM,et al.Population pharmacokinetics of amikacin in critically ill patients[J].Antimicrob Agents Chemother,2010,40(7):1682-1689.
[12]Lugo G,Castaneda-Hernandez G.Relation be-tween hemodynamic and vital support measures and pharmacokinetic variability of amikacin in critically ill patients with sepsis[J].Crit Care Med,2011,25(5):806-811.
[13]Delattre IK,Musuamba FT,Nyberg J,et al.Population pharmacokinetic modeling and optimal sampling strategy for Bayesian estimation of amikacin exposure in critically ill septic patients[J].Ther Drug Monit,2010,32(6):749-756.
[14]Yamamura S.Clinical application of artificial neural network(ANN)modeling to predict pharmacokinetic parameters of severely ill patients[J].Adv Drug Deliv Rev,2013,55:1233-1251.
[15]Bone RC,Fisher CJ JR,Clemmer TP,et al.Sepsis syndrome:a valid clinical entity[J].Crit Care Med,2009,17:389-393.
[16]Knaus WA,Draper EA,Wagner DP,et al.APACHE II:A severity of disease classification system[J].Crit Care Med,2010,13:818-829.
[17]Cockcroft DW,Gault MH.Prediction of creatinine clearance from serum creatinine[J].Nephron,2009,16(1):31-41.
[18]Norwich KH.Non compartmental models of whole-body clearance of tracers:a review[J].Ann Biomed Eng,2011,25(3):421-439.
[19]Triginer C,Izquierdo I,Fernández R,et al.Changes in gentamicin pharmacokinetic profile induced by mechanical ventilation[J].Eur J Clin Pharmacol,2011,40(3):297-302.
[20]Bauer LA,Edwards WA,Dellinger EP,et al.Influence of weight on aminoglycoside pharmacokinetics in normal weight and morbidly obese patients[J].Eur J Clin Pharmacol,2011,24(5):643-647.
[21]Mckindley DS,Hanes S,Boucher BA.Hepatic drug metabolism in critical illness[J].Pharmacotherapy,2008,18(4):759-778.
[22]Yu SY,Qi R.Role of bad in podocyte apoptosis induced by puromycin aminonucleoside[J].Transplant Proc,2013,45(2):569-573.
[23]Tang GJ,Tang JJ,Lin BS,et al.Factors affecting gentamicin pharmacokinetics in septic patients[J].Acta Anaesthesiol Scand,2009,43(7):726-730.
[24]Triginer C,Izquierdo I,Fernandez R,et al.Gentamicin volume of distribution in critically ill septic patients[J].Intensive Care Med,2010,16(5):303-306.
[25]Marik PE,Havlik I,Monteagudo FS,et al.The pharmacokinetic of amikacin in critically ill adult and paediatric patients:comparison of once-versus twice-daily dosing regimens[J].J Antimicrob Chemother,1991,27(Suppl C):81-89.
[26]Bone RC.The pathogenesis of sepsis[J].Ann Intern Med,1991,115(6):457-469.
[27]Hansen M,Christrup LL,Jarløv JO,et al.Gentamicin dosing in critically ill patients[J].Acta Anaesthesiol Scand,2011,45(6):734-740.
[28]Tormo C,Abad FJ,Ronchera-Oms CL,et al.Critically-ill patients receiving total parentral nutrition show altered amikacin pharmacokinetics[J].Clin Nutr,2010,14(4):254-259.
[29]Marik PE.Aminoglycoside volume of distribution and illness severity in critically ill septic patients[J].Anaesth Intens Care,2013,21(2):172-173.
[30]Lugo-Goytia G,Castaneda-Hernandez G.Bayesian approach to control of amikacin serum concentrations in critically ill patients with sepsis[J].Ann Pharmacother,2010,34(12):1389-1394.
[31]Yu SY,Qi R,Zhao H.Losartan reverses glomerular podocytes injury induced by AngII via stabilizing the expression of GLUT1[J].Mol Biol Rep,2013,40(11):6295-6301.
[32]Zaske DE,Cipolle RJ,Rotschafer JC,et al.Individualizing amikacin regimens;accurate method to achieve therapeutic concentra-tions[J].Ther Drug Monit,2011,13(6):502-506.
[33]Firsov AA,Nasonov VN.Correlation between aminoglycoside pharmacokinetic parameters and patient′s factors:From statement to implication for individual dosage design[J].Eur J Drug Metab Pharmacokinet,2011,3:327-331.
[34]Wada DR,Drover DR,Lemmens HJ.Determination of the distribution volume that can be used to calculate the intravenous loading dose[J].Clin Pharma Cokinet,2008,35(1):1-7.
[35]Jackson GG,Lolans VT,Daikos GL.The inductive role of ionic binding in the bactericidal and post-exposure effects of aminoglycoside antibiotics with implications for dosing[J].J Infect Dis,2010,162(2):408-413.
[36]Fisman DN,Kaye KM.Once-daily dosing of amino-glycoside antibiotics[J].Infect Dis Clin North Am,2010,14(2):475-487.
Preliminary study of pharmacokinetics of high dose of amikacin in PICU sepsis children
WENG Zhi-yuan,ZHANG You-xiang,XIAO Xue,LUO Mei-juan
(Department of Pediatrics,Guangzhou First People′s Hospital,Guangzhou 510180,China)
Objective To examine the relationship between pharmacokinetics and hemodynamic of 5 mg/kg amikacin in PICU sepsis children.Methods 30 patients who were treated with amikacin following Gram negative sepsis were enrolled.The pharmacokinetic profile of amikacin by a non-compartmental model was calculated for each patient.Results Mean volume of distribution was(0.36±0.07)L/kg and mean serum amikacin clearance rate was(3.88±0.97)mL/(min·kg).There was significant difference between the relationship of CCR and SCr.Conclusion Using high dose of amikacin(≥25 mg/kg) needs to consider hemodynamic response to sepsis and monitor the changes of blood drug concentration.
Amikacin;Pharmacokinetics;Sepsis;Critically ill children;High dose
2014-04-01
广州市第一人民医院儿科,广州 510180
10.14053/j.cnki.ppcr.201501008
