新型肿瘤靶向药物TMTP1-DKK应用于宫颈癌治疗的初步研究
2015-06-01张振中
魏 睿,李 飞,张振中,程 腾,奚 玲
·论著·
新型肿瘤靶向药物TMTP1-DKK应用于宫颈癌治疗的初步研究
魏 睿,李 飞,张振中,程 腾,奚 玲*
目的 探讨TMTP1-DKK在治疗高转移宫颈癌的潜在应用价值。方法 选择高转移和低转移配对宫颈癌细胞系SiHa和C-33A,Transwell试验分别确证其转移能力;Rhodamine标记TMTP1,免疫荧光检测Rhodamine-TMTP1对SiHa、C-33A的亲和能力;CCK8检测TMTP1-DKK和TMTP1-VK处理后对SiHa和C-33A细胞的杀伤率,Transewell检测TMTP1-DKK和TMTP1-VK处理后对SiHa细胞侵袭能力的影响。结果 SiHa细胞侵袭能力强于C-33A,TMTP1亲和实验显示TMTP1对高转移细胞系SiHa亲和力明显高于C-33A,TMTP1-DKK对SiHa生存率影响明显强于C-33A,差异有统计学意义(P<0.05)。结论 TMTP1-DKK能特异性地杀伤高侵袭能力的宫颈癌细胞SiHa,但对低转移能力细胞C-33A杀伤效应不明显。提示TMTP1-DKK可以作为高转移宫颈癌靶向化疗药物的可能性。
TMTP1;宫颈癌;肿瘤转移;靶向治疗
0 引言
肿瘤复发转移是肿瘤患者手术治疗后导致患者生存率和生活质量下降的重要因素之一。癌症患者中的 70%经手术治疗、放疗和化疗后是有效的,但是其中治疗后的一部分患者会发生转移。而微小病灶转移用传统方法例如细致的临床体格检查,病理检查,生物化学以及放射性诊疗手段很难发现,这些都会导致肿瘤患者的复发。肿瘤复发患者5年生存率不到50%,尽管现在有很多新型的治疗方法问世,但是发生肿瘤转移患者的5年生存率并没有显著提高。宫颈癌治疗后复发或者未控率为29%~38%,复发是该病的主要死因,包括局部复发和远处转移[1]。近年来,肿瘤靶向治疗发展迅速,备受人们的重视,包括小分子抑制剂、单克隆抗体和小分子多肽[2]。TMTP1是华中科技大学附属同济医院肿瘤分子生物医学中心通过细菌鞭毛肽库技术筛选得到的,具有分子量小、易于合成、细胞穿透能力强和无免疫原性等优点,该肽能特异性结合高转移肿瘤细胞,包括前列腺癌、乳腺癌、胃癌、耐药卵巢癌,但是对低转移细胞系和正常细胞无作用[3-5]。它可以作为靶向治疗的分子载体,携带小分子毒性药物靶向对抗肿瘤的原发灶和转移灶。研究发现,抗微生物活性肽D(KLAKLAK)2与靶向线粒体启动凋亡的多肽CNGRC相偶联后,可增强抗肿瘤的效应[6]。该多肽D(KLAKLAK)2与促凋亡的抗微生物肽结构相似,并且在真核细胞外保持相对的无毒性,与其他的靶向肽相偶联后,可诱导线粒体肿胀,促进细胞的凋亡。本研究将TMTP1和D(KLAKLAK)2偶联到一起命名为TMTP1-DKK,将对照肽为错构肽和D(KLAKLAK)2偶联一起命名为TMTP1-VK,选用2种宫颈癌细胞系SiHa和C-33A,检测TMTP1-DKK在治疗宫颈癌方面的可能性。
1 材料和方法
1.1 仪器和试剂 全波段酶标仪(美国Bio-tek公司);相差显微镜(日本Olympus公司);细胞培养箱(美国Termo公司)。试剂:FITC-TMTP1-DKK(西安华辰公司);FITC-TMTP1-VK(西安华辰公司);CCK-8(日本Dojindo公司);SiHa宫颈癌细胞系(美国ATCC公司);C-33a宫颈癌细胞系(美国ATCC公司);Transewell小室(美国Corning公司);DMEM培养基(美国Gibco公司);胎牛血清(中国四季青公司)。
1.2 方法
1.2.1 细胞培养及药物预处理 人宫颈癌细胞系C-33A和SiHa置于DMEM完全培养基(10%胎牛血清,DMEM培养基)中,37 ℃、5%CO2培养箱中培养,细胞融合率达90%时进行胰蛋白酶消化,传代或种于孔板,细胞爬片上进行下一步实验。按照药物处理和实验目的分为实验组NK和对照组VK。
1.2.2 体外侵袭实验 将4 ℃放置的液态的Matrigel胶铺置在Transwell小室的下层,务必无气泡,置于37 ℃、5%CO2饱和湿度培养箱30 min;将消化成单细胞悬液的对照组和处理组C-33A和SiHa细胞4 000个,以120 μL含2%FBS的DMEM培养基的体积种于Transwell上层小室中,下层中加入400 μL 20%FBS的3T3上清。继续于37 ℃、5%CO2培养箱中培养48 h。用棉签轻擦去未穿过的细胞后,用PBS洗3遍,再用4%多聚甲醛固定10 min。PBS洗3遍后,用0.1%结晶紫染色10 min,PBS洗涤3遍。使用正置显微镜进行观察和拍照,把Transwell小室反过来,可清楚地看到小室底膜上下室附着的细胞,随即选取5个视野计数细胞个数。
1.2.3 TMTP1对SiHa和C-33A细胞亲和能力 将胰酶消化过的SiHa和C-33A单细胞悬液调整密度后,分别种于24孔板中的爬片上,十字摇匀37 ℃、5%CO2培养箱中,待密度达到50%时,加入含3 μmol的Rhodamine-TMTP1,避光下37 ℃、5%CO2培养箱2 h,PBS洗3遍后,4%多聚甲醛固定10 min,PBS洗3遍后,加入细胞核染液(DAPI)室温染色8 min,PBS洗3遍后,放置爬片于载玻片上,加入抗免疫荧光淬灭剂封片,在激光共聚焦显微镜下观察拍照。
1.2.4 CCK8法测TMTP1-DKK和TMTP1-VK对宫颈癌细胞系SiHa和C-33A细胞系增殖抑制试验 将胰酶消化过的SiHa和C-33A单细胞悬液在调整密度后,以每孔100 μL体积,5 000个细胞接种于96孔板,边缘用无菌PBS添空,贴壁24 h后,更换培养基,每孔加入含有5、10、20、40、80 μM的TPMTP1-DKK和TMPT1-VK的DMEM培养基100 μL,摇匀,每组浓度设3个副孔,并设无多肽无细胞的对照组。置于37℃、5%CO2培养箱中培养至24 h后,加入37 ℃预热的Cell counting kit-8(Dojindo,日本),继续培养2 h,酶标仪450 nm处读取吸光度值。计算生长抑制率(IR)=[(对照组-实验组)/对照孔]×100%。实验重复3次。

2 实验结果
2.1 体外侵袭实验 4 000个没有处理的SiHa和C-33A细胞分别种植在Transewell小室,24 h后通过随机选取5个视野计数,结果表明,在相同条件下宫颈癌细胞系SiHa具有较强的侵袭能力,差异有统计学意义(P<0.05)。见图1-A、图1-B。
2.2 TMTP1对SiHa和C-33A细胞亲和能力实验 3 μM Rhodamine-TMTP1分别作用于宫颈癌细胞SiHa和C-33A,3 h后细胞爬片在激光共聚焦显微镜下观察并拍照示:TMTP1作用于SiHa细胞后显示较强的红色荧光,而C-33a相对较弱。即TMTP1对SiHa细胞相对于C-33a有较好的亲和性。见图1-C。
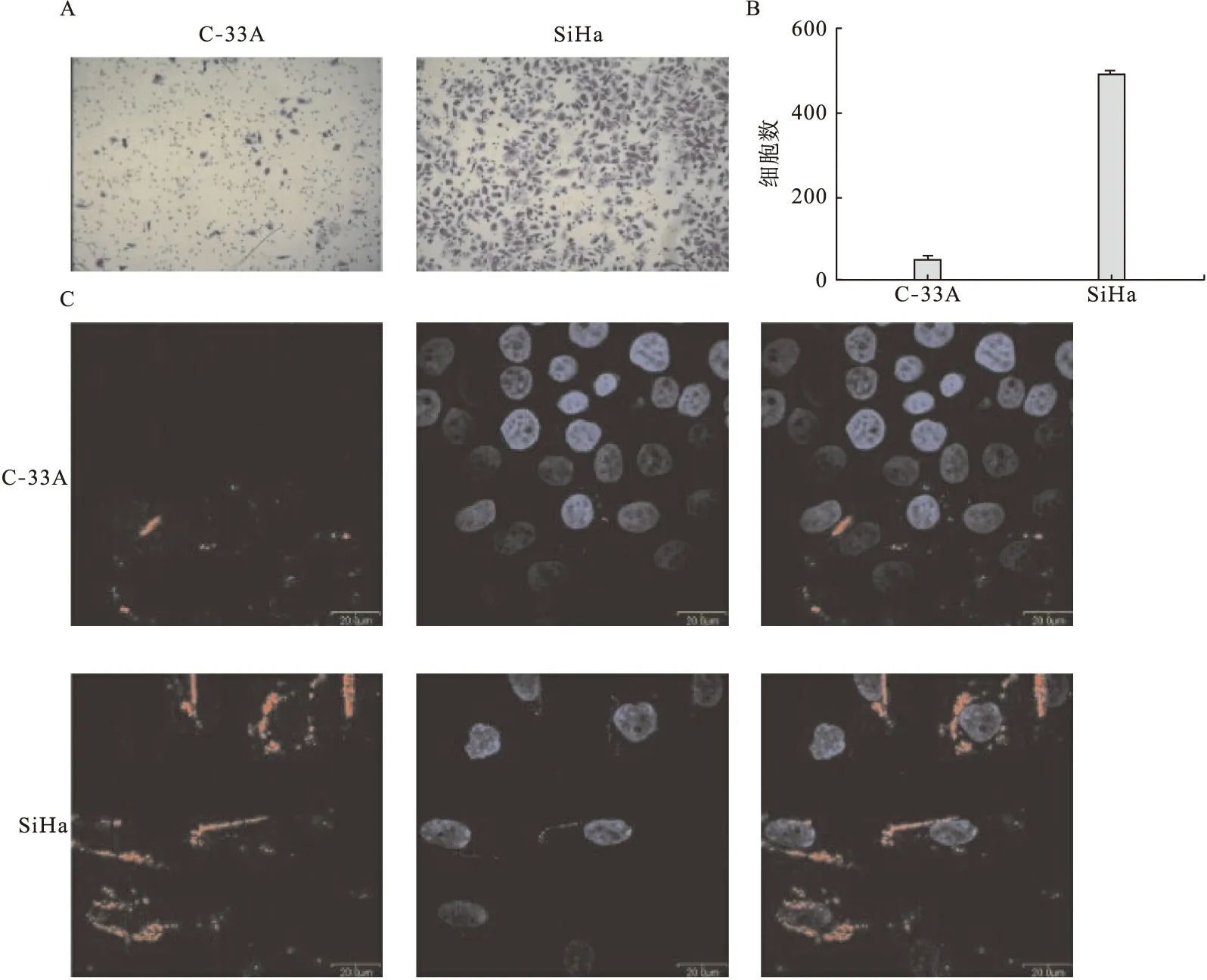
图1 TMTP1对不同侵袭能力的宫颈癌细胞SiHa和C-33A的亲和性
2.3 CCK8法测TMTP1-DKK和TMTP1-VK对宫颈癌细胞系SiHa和C-33A细胞系增殖抑制试验 使用浓度分别为5、10、20、40、80 μM的TMTP1-DKK和TMTP1-VK作用于SiHa和C-33A细胞24 h,通过CKK-8检测TMTP1-DKK对SiHa和C-33A增殖影响,发现TMTP1-DKK和TMTP1-VK在5、10、20 μM浓度时,对SiHa和C-33A的杀伤无差异性,在浓度为40、60、80 μM时,TMTP1-DKK对SiHa有抑制增殖作用(P<0.05),TMTP1-VK对SiHa杀伤无差异性,TMTP1-DKK和TMTP1-VK对C-33A增殖无抑制作用。见图2。

图2 TMTP1-DKK和TMTP1-VK对宫颈癌细胞SiHa和C-33A增殖的影响
2.4 TMTP1-DKK抑制SiHa体外侵袭迁移能力实验 选取对SiHa无增殖抑制的低浓度10 M TMTP1-DKK和TMTP1-VK处理后的细胞种植在Transwell小室,24 h后通过随机选取5个视野计数,结果表明,该浓度下TMTP1-DKK明显抑制SiHa细胞的体外侵袭能力,TMTP1-VK基本无影响,差异有统计学意义(P<0.05)。见图3。
3 讨论
目前,分子靶向治疗已成为恶性肿瘤的治疗手段之一,针对肿瘤细胞的增殖转移通路、抑制血管淋巴管生成等特异靶点进行治疗的一种全新的治疗模式已被用于临床[7-8]。最近发现一些新型多肽能够特异性地穿透肿瘤细胞以及肿瘤细胞相关的内皮细胞。例如Corti等[9-10]利用肽库筛选技术在体内外筛选获得并证实一系列短肽特异性结合肿瘤血管,RGD序列可与整合素特异性结合,并且可对多种肿瘤具有特异的靶向效应。一些小分子多肽除了可以结合特定的受体,增强细胞穿透性,还可以通过与脂质体、微胶粒、树枝状大分子共轭将药物靶向癌细胞[11-12],提高药物疗效[13-14]。
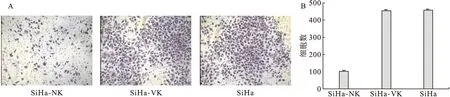
图3 TMTP1-DDK和TMTP1-VK对SiHa体外侵袭能力的影响
体内外实验证实,TMTP1不能结合低转移潜能或不转移的肿瘤细胞,可结合高转移潜能肿瘤细胞,甚至能识别并结合只有少数细胞组成的不典型的肝脏微转移灶,因此,TMTP1是构建重组融合毒素的理想靶向分子,这种融合毒素理论上能选择性杀伤高转移性肿瘤细胞,而对正常组织细胞没有毒性。动物试验表明,TMTP1和抗菌肽偶联能有效地抑制胃癌的进展和转移[4]。钱敏等[15]研究发现,TMTP1-TAT-NBD通过抑制NF-κB基因的激活,进而抑制细胞的增殖和克隆形成,促进卵巢癌细胞的凋亡。研究发现,抗微生物多肽D(KLAKLAK)2与靶向线粒体启动凋亡的多肽CNGRC相偶联后,可增强抗肿瘤的效应。该多肽D(KLAKLAK)2与促凋亡的抗微生物肽结构相似,并且在真核细胞外保持相对的无毒性,与其他的靶向肽相偶联后,可诱导线粒体肿胀,促进细胞的凋亡。前期实验表明TMTP1-GG-D(KLAKLAK)能特异性地促进高转移前列腺癌细胞系PC-3M-1E8和胃癌细胞系MKN-45sci的凋亡,但是对低转移的前列腺癌细胞PC-3M-2B4和正常乳腺上皮细胞MCF-10A以及正常肝细胞LO2无作用[16]。本实验结果显示TMTP1-DDK对高转移能力的宫颈癌细胞有特异性的靶向杀伤效应,而对低转移细胞基本没有作用。该多肽通过靶向杀伤高转移能力细胞是否存在复杂机制及通路?是否在肿瘤生长及转移过程中起到相关的靶向遏制效应?仍有待进一步的深入研究证实。
肿瘤的侵袭转移分子机制是一系列复杂而多步骤的病理过程。最近药物发现,侧重针对分子的靶向治疗的推理性药物设计,这些药物针对的是肿瘤的发生、发展和转移过程[17]。本实验结果表明,TMTP1-DDK针对宫颈癌高转移能力的细胞有特异的杀伤效应,对低转移和正常细胞基本没有作用,减轻了对化疗机体的毒副作用,在临床应用上可以联合化疗药物,增强靶向杀伤肿瘤转移灶。
[1] Bazaeva IIa,Gorbunova VA,Kravets OA,et al.Chemoradiotherapy for locally advanced cervical cancer[J].Vopr Onkol,2014,60(3):280-287.
[2] Absar S,Nahar K,Choi S,et al.Serum albumin-protamine conjugate for biocompatible platform for targeted delivery of therapeutic macromolecules[J].J Biomed Mater Res A,2014,102(8):2481-2490.
[3] Yang W,Luo D,Wang S,et al.TMTP1,a novel tumor-homing peptide specifically targeting metastasis[J].Clin Cancer Res,2008,14(17):5494-5502.
[4] Ma XY,Li S,Luo DF,et al.Antitumor and antimetastatic effect of antimicrobial peptide conjugated with tumor homing peptide TMTP1 on the transplanted prostate cancer and gastric cancer in nude mice[J].Zhonghua Zhong Liu Za Zhi,2013,35(10):737-741.
[5] Xiao M,Hong Z,Sun L,et al.TMTP1,a novel tumor-homing peptide,specifically targets hematological malignancies and their metastases[J].J Huazhong Univ Sci Technology Med Sci,2011,31(5):608-613.
[6] Kolevzon N,Kuflik U,Shmuel M,et al.Multiple triphenylphosphonium cations as a platform for the delivery of a pro-apoptotic peptide[J].Pharm Res,2011,28(11):2780-2789.
[7] El-Habashy SE,Nazief AM,Adkins CE,et al.Novel treatment strategies for brain tumors and metastases[J].Pharm Pat Anal,2014,3(3):279-296.
[8] Kuroki M,Shirasu N.Novel treatment strategies for cancer and their tumor-targeting approaches using antibodies against tumor-associated antigens[J].Anticancer Res,2014,34(8):4481-4488.
[9] Corti A,Pastorino F,Curnis F,et al.Targeted drug delivery and penetration into solid tumors[J].Med Res Rev,2012,32(5):1078-1091.
[10]Pasqualini R,Moeller BJ,Arap W.Leveraging molecular heterogeneity of the vascular endothelium for targeted drug delivery and imaging[J].Semin Thromb Hemost,2010,36(3):343-351.
[11]Panwar P,Pandey B,Lakhera PC,et al.Preparation,characterization,and in vitro release study of albendazole-encapsulated nanosize liposomes[J].Int J Nanomedicine,2010,5:101-108.
[12]Gaucher G,Marchessault RH,Leroux JC.Polyester-based micelles and nanoparticles for the parenteral delivery of taxanes[J].J Control Release,2010,143(1):2-12.
[13]Chang DK,Lin CT,Wu CH,et al.A novel peptide enhances therapeutic efficacy of liposomal anti-cancer drugs in mice models of human lung cancer[J].PloS One,2009,4(1):e4171.
[14]Yoneda Y,Steiniger SC,Capkova K,et al.A cell-penetrating peptidic GRP78 ligand for tumor cell-specific prodrug therapy[J].Bioorg Med Chem Lett,2008,18(5):1632-1636.
[15]钱敏.TMTP1-TAT-NBD对卵巢癌细胞系的体外作用机制[D].湖北:华中科技大学,2012.
[16]Ma X,Xi L,Luo D,et al.Anti-tumor effects of the peptide TMTP1-GG-D(KLAKLAK)(2)on highly metastatic cancers[J].PloS One,2012,7(9):e42685.
[17]Guan YY,Luan X,Xu JR,et al.Selective eradication of tumor vascular pericytes by peptide-conjugated nanoparticles for antiangiogenic therapy of melanoma lung metastasis[J].Biomaterials,2014,35(9):3060-3070.
Anti-tumor effects of the peptide TMTP1-DKK on different cervical cancers
WEI Rui,LI Fei,ZHANG Zhen-zhong,CHENG Teng,XI Ling*
(Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To investigate the remarkable specificity and anti-tumor ability of peptide TMTP1-DKK on highly metastatic cervical tumorsinvitro.Methods Cervical cancer cells SiHa and C-33A that had different metastatic capacities were used.The cell invasion was investigated using the Transwell system.Rhodamine was coupled to the peptides TMTP1.Immunofluorescence assay was carried out to determine the specific binding capacities of the TMTP1,SiHa and C-33A.The inhibition rates of cells growth was measured by CKK-8 assay.The SiHa and C-33A cells were treated with different concentrations of TMTP1-DKK and TMTP1-VKinvitro,and the biological behavior changes of cells were assessed by migration and invasion through Transwell assay.Results Cervical cancer cell SiHa had higher metastatic ability than C-33A.Rhodamine-TMTP1 bound specifically to highly metastatic tumor cell line,SiHa,however,Rhodamine-TMTP1 did not bind to thenometastatic cervical cancer cell C-33A.TMTP1-DKK showed higher anti-tumor effects on highly metastatic SiHa compared to C33A,and the difference was significant(P<0.05).Conclusion TMTP1-DKK can inhibit the proliferation of highly metastatic cervical cancer cell SiHa,but it has little effect onnometastatic cervical cancer cell C-33A.These results suggest TMTP1-DKK may be a powerful candidate therapeutic agent for metastatic tumors.
TMTP1;Cervical cancer;Metastatic tumors;Targeted therapy
2014-09-15
华中科技大学同济医学院附属同济医院肿瘤生物医学中心,武汉430030
国家自然科学基金面上项目(81172468);华中科技大学研究生创新创业基金项目(01-09-070115)
10.14053/j.cnki.ppcr.201501001
*通信作者
