Rapamycin增强上皮性卵巢癌细胞株对顺铂的敏感性研究
2015-06-01张海燕
张海燕,孙 红
Rapamycin增强上皮性卵巢癌细胞株对顺铂的敏感性研究
张海燕,孙 红*
目的 比较单独mTOR抑制剂Rapamycin、单独顺铂或联合2种制剂对上皮性卵巢癌SKOV3、ES-2细胞增殖和凋亡的影响。方法 采用Western blot检测Rapamycin对mTOR的抑制效应,检测顺铂对mTOR信号通路的影响度。采用单独Rapamycin、单独顺铂或联合2种制剂作用于上皮性卵巢癌SKOV3和ES-2细胞,运用MTT和FCM比较不同治疗方案对其增殖和凋亡的影响。结果 在正常培养条件下,100 nmol/L Rapamycin作用24 h,上皮性卵巢癌细胞内p-mTOR表达显著抑制;顺铂可影响上皮性卵巢癌ES-2细胞mTOR信号通路的激活情况;与单独顺铂作用和单独Rapamycin作用比较,联合两种制剂显著增加SKOV3和ES-2细胞的早期凋亡率,抑制细胞增殖(P均<0.05)。结论 mTOR信号通路在上皮性卵巢癌顺铂化疗中发挥调节作用,Rapamycin可通过抑制mTOR激活而增强顺铂的杀伤作用。
上皮性卵巢癌;mTOR;Rapamycin;顺铂
0 引言
卵巢癌(Ovarian cancer,OC)是女性生殖系统常见的恶性肿瘤之一,病死率位居妇科恶性肿瘤首位。化疗在卵巢癌治疗中占据着重要的地位。以铂类为基础的联合治疗为上皮性卵巢癌的一线化疗方案,但铂类药物的毒副反应以及抗药性问题越来越突出,成为治疗的瓶颈。PI3K/AKT/mTOR信号通路在上皮性卵巢癌的发生、发展以及化疗耐药方面发挥着重要作用。本文拟采用顺铂作用于上皮性卵巢癌SKOV3、ES-2细胞,观察不同时间、不同浓度作用下,mTOR信号通路激活情况;比较单独抑制剂(Rapamycin)、单独顺铂以及联合2种制剂的治疗方案对SKOV3、ES-2细胞的增殖及凋亡的影响,观察Rapamycin对顺铂抗肿瘤效应的影响,为筛选有效的化疗方案提供实验依据。
1 材料与方法
1.1 细胞 人上皮性卵巢癌细胞株SKOV3、ES-2细胞均购自ATCC。将SKOV3、ES-2细胞按照106/mL密度接种于100 mL的培养瓶中,用含10% FBS、1%链青霉素的DMEM高糖培养液,在37 ℃、5%CO2的培养箱中培养,每2天换液,细胞生长至80%~90%,胰酶消化、传代。取对数生长期细胞用于实验。
1.2 主要试剂 兔抗人磷酸化mTOR单克隆抗体、兔抗人mTOR抗体、兔、鼠抗人GAPDH单克隆抗体、Rapamycin均购自美国Cell Signal公司。MTT、AnnexV-PI凋亡试剂盒购自美国Invitrogen公司。
1.3 Western blot检测p-mTOR表达 收集施加不同处理因素的细胞5×106个,4 ℃ PBS洗涤2次,加入RIPA 100 μL,蛋白酶抑制剂1 μL,冰上裂解30 min,以12 000 r/min速度在4 ℃离心30 min;95 ℃变性5 min,8%聚丙烯酰胺凝胶电泳,270 mA半干湿转膜90 min(Bio-Rad);5%脱脂奶粉封闭1 h;加入一抗(mTOR1∶1 000、p-mTOR 1∶800)4 ℃孵育过夜,PBST洗膜3次,每次15 min;加入荧光二抗(1∶3 000)37 ℃孵育1 h,PBST洗膜3次,每次15 min;Odessey检测、拍照和分析。
1.4 MTT法检测细胞抑制率 根据Western blot结果,配置药物浓度;细胞接种96孔板,分4组:①阴性对照组,即加入无药物的培养液;②阳性对照组,即加入含有DMSO不含药物的培养基;③空白对照组,即无细胞只加不含药物的培养液;④Rapamycin实验组,即加入含有0.001、0.01、0.1、1、10、100 μmol/L不同浓度的Rapamycin的培养液。每个浓度设置3个平行孔;细胞培养48 h后,弃去上清,加入200 μL DMSO,充分溶解后,放置酶标仪OD450,读出结果并分析。
1.5 流式细胞仪检测细胞凋亡 根据MTT和Western blot结果,选择作用浓度。细胞接种6孔板,分3组:①单独顺铂(20 μmol/L)组;②单独抑制剂Rapamycin(0.1 μmol/L)组;③顺铂(20 μmol/L)联合Rapamycin(0.1 μmol/L)组。加药处理24 h后,常规消化收集细胞,Annexin V-PI双染色,流式细胞仪分析。每种条件做3个平行孔,并重复3次。细胞培养48 h后,弃去上清,胰酶消化、PBS洗涤后,按照凋亡试剂盒步骤进行固定,染色,上机检测。

2 结果
2.1 顺铂诱导上皮性卵巢癌ES-2细胞中AKT磷酸化 顺铂以20 μmol/L加入上皮性卵巢癌ES-2细胞上清液中(原上清液中含5%FBS),结果显示:作用5 min后,p-AKT表达明显增加,30 min最显著,随后至120 min时略下降并持续在一定水平。见图1-A。将不同浓度顺铂加入上皮性卵巢癌ES-2细胞上清液中(原上清液中含5% FBS),结果显示:暴露120 min后,20 μmol/L可显著增加p-AKT表达,但随着浓度增加,p-AKT表达略呈下降趋势。见图1-B。
2.2 顺铂诱导ES-2细胞内mTOR磷酸化 顺铂以20 μmol/L浓度加入上皮性卵巢癌ES-2细胞上清液中(原上清液中含5% FBS),结果显示:作用15 min后,p-mTOR表达明显增加,30 min最显著,随后至120 min时略下降并持续在一定水平。见图2-A。将不同浓度顺铂加入上皮性卵巢癌ES-2细胞上清液中(原上清液中含5% FBS),结果显示:暴露120 min后,20 μmol/L可显著增加p-mTOR表达,但随着浓度增加,p-mTOR表达略呈下降趋势。见图2-B。
2.3 Rapamycin抑制SKOV3、ES-2细胞中p-mTOR表达 上皮性卵巢癌SKOV3和ES-2细胞接受Rapamycin作用24 h后,采用IGF-1 50 ng/mL继续刺激30 min,Western blot检测发现Rapamycin 0.1 μmol/L显著抑制p-mTOR表达,参照对照组,活性分别下降了83.7%、87.2%,见图3。
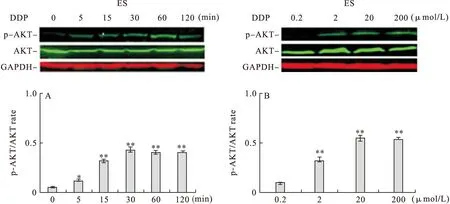
图1 Western blot检测不同浓度的顺铂作用ES-2细胞不同时间,p-AKT表达水平的变化

图2 Western blot检测不同浓度的顺铂作用ES-2细胞不同时间,p-mTOR表达水平的变化

图3 Western blot检测Rapamycin抑制卵巢癌SKOV3、ES-2细胞中p-mTOR表达
2.4 Rapamycin抑制SKOV3、ES-2细胞增殖 采用不同浓度梯度Rapamycin作用细胞,MTT结果提示,Rapamycin抑制SKOV3、ES-2细胞生长,呈浓度依赖性,但其抑制作用相对于Triciribine较弱。见图4。

图4 MTT检测Rapamycin对上皮性卵巢癌SKOV3、ES-2细胞生长抑制情况
2.5 Rapamycin联合顺铂显著促进上皮性卵巢癌SKOV3、ES-2细胞凋亡 流式细胞仪分别检测单独Rapamycin 100 nmol/L。单独顺铂20 μmol/L以及两者联合作用对SKOV3、ES-2细胞凋亡率的影响。结果显示,细胞接受不同因素处理24 h后,联合用药组对两种细胞的凋亡率均显著高于单独顺铂组以及单独Rapamycin组(P<0.01)。见图5。
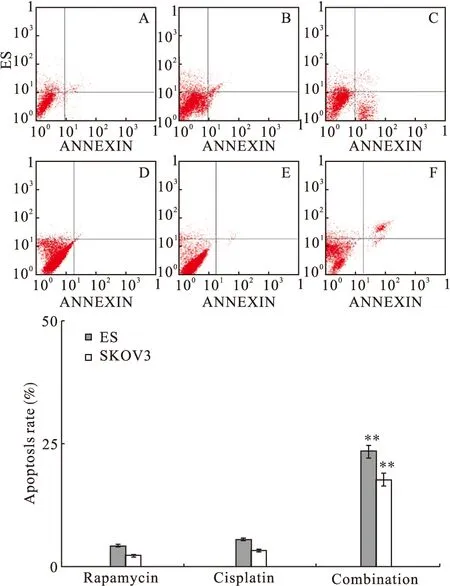
图5 流式细胞仪检测SKOV3、ES-2细胞凋亡率
3 讨论
PI3K/AKT信号通路是细胞生存和抗凋亡的重要传导通路之一,并且与肿瘤的化疗耐受关系密切。Kim等[1]报道,紫杉醇可通过下调PI3K活性,使AKT失活,从而促使细胞凋亡。Abdul等[2]发现,蒽环类抗菌药物(Anthracycline)能够提高PI3K活性,继而激活PI3K下游蛋白AKT,从而活化NF-κB,抑制细胞凋亡。Li等[3]研究认为,阿霉素可增加磷酸化AKT及其下游底物GSK-3β、FOXO3α和Bim表达,但大剂量阿霉素也可抑制PI3K/AKT信号通路的激活,从而促进细胞凋亡。Martelli等[4]研究发现,依托泊苷可激活AKT/NF-κB而延迟细胞凋亡时间,PI3K激酶抑制剂LY294002则可显著降低癌细胞对依托泊苷的抗性,从而提高细胞对药物的敏感性。因此,寻找化疗激发的细胞自我保护机制,因势诱导是克服化疗耐药的根本之道。
目前有关铂类化合物对PI3K/AKT信号通路的影响的研究结论存在分歧。Westfall等[5]及Zhang等[6]均报道,卡铂可激活卵巢癌细胞株PI3K信号通路,PI3K抑制剂LY294002可以阻断此现象,从而增强癌细胞对卡铂的敏感性。Weir等[7]研究发现,姜黄素通过调节卵巢癌耐药细胞株中AKT和p38-MAPK信号转导,促进细胞G2/M期停滞,逆转对顺铂的耐受。Lee等[8]研究发现,顺铂通过抑制卵巢癌OVCAR3细胞中AKT磷酸化,促进细胞凋亡。本研究结果显示,20 μmol/L顺铂刺激5 min,上皮性卵巢癌ES-2细胞中p-AKT表达增加,30 min最显著,随后至120 min时略下降并持续在一定水平。采用不同作用浓度的顺铂作用ES-2细胞120 min,结果显示,顺铂20 μmol/L可显著增加p-AKT表达,但随着浓度增加,p-AKT表达略呈下降趋势,这与卡铂研究结果相似。本研究结果显示:20 μmol/L顺铂刺激15 min,ES-2细胞中p-mTOR表达明显增加,30 min最显著,随后至120 min时略下降并持续在一定水平;不同浓度的顺铂作用于ES-2细胞120 min,20 μmol/L可显著增加p-mTOR表达,但随着浓度增加,p-mTOR表达略呈下降趋势。由此可见,顺铂诱导卵巢上皮性癌ES-2细胞中PI3K/AKT信号通路下游靶位mTOR激活,发挥着IGF-1样作用。
雷帕霉素(Rapamycin)是一种大环内酯类免疫抑制抗菌药物,能选择性地与胞浆中广泛存在的FK506结合蛋白(FKBP)高亲和力特异性结合,形成Rapamycin-FKBP复合物,该复合物能与胞浆中mTOR蛋白高亲和力特异性结合,强烈抑制mTOR激酶活性,使之对下游底物的磷酸化调节作用减弱或消失,阻断各种生长因子转导的信号下传[9]。本文结果表明,Rapamycin对SKOV3、ES-2细胞生长抑制的强度明显低于顺铂,但Rapamycin可显著增强顺铂促进SKOV3、ES-2细胞凋亡的效应,从而增加细胞对顺铂化疗的敏感性。目前研究显示,mTOR激酶抑制剂对多种恶性肿瘤细胞有明显抑制作用[10-11],NVP-BEZ235作为PI3K/mTOR双重激酶抑制剂,可明显抑制上皮性透明性细胞癌的增殖[12],无疑是很有前景的抗肿瘤药物,同时也预示着在卵巢癌化疗中,合理利用信号通路激酶抑制剂,将有利于增强化疗效果,可望成为预防和逆转耐药的有效途径。
[1] Kim SH,Juhnn YS,Song YS.Akt involvement in paclitaxel chemoresistance of human ovarian cancer cells[J].Ann N Y Acad Sci,2007,1095:82-89.
[2] Abdul-Ghani R,Serra V,Gyorffy B,et al.The PI3-K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1[J].Oncogene,2006,25(12):1742-1752.
[3] Li S,Zhou Y,Wang R,et al.Selenium sensitizes MCF-7 breast cancer cells to doxorubicin-induced apoptosis through modulation of phospho-AKT and its downstream substrates[J].Mol Cancer Ther,2007,6(3):1031-1038.
[4] Martelli AM,Nyakern M,Tabellini G,et al.Phosphoinositide 3-kinase/AKT signaling pathway and its therapeutical implications for human acute myeloid leukemia[J].Leukemia,2006,20(6):911-928.
[5] Westfall SD,Skinner MK.Inhibition of phosphatidylinositol 3-kinase sensitizes ovarian cancer cells to carboplatin and allows adjunct chemotherapy treatment[J].Mol Cancer Ther,2005,4(11):1764-1771.
[6] Zhang HY,Zhang PN,Sun H.Aberration of the PI3K/AKT/mTOR signaling in epithelial ovarian cancer and its implication in cisplatin-based chemotherapy[J].Eur J Obstet Gynecol Reprod Biol,2009,146(1):81-86.
[7] Weir NM,Selvendiran K,Kutala VK,et al.Curcumin induces G2/M arrest and apoptosis in cisplatin-resistant human ovarian cancer cells by modulating AKT and p38 MAPK[J].Cancer Biol Ther,2007,6(2):178-184.
[8] Lee S,Choi EJ,Jin C,et al.Activation of PI3-K/PKB pathway By PENT reduction and PI3-KCA mRNA amplification contributes to cisplatin resistance in an ovarian cancer cell line[J].Gynecol Oncol,2005,97(1):26-34.
[9] Memmott RM,Dennis PA.AKT-dependent and-independent mechanisms of mTOR regulation in cancer[J].Cell Signal,2009,21(5):656-664.
[10]Smolle E,Taucher V,Pichler M,et al.Targeting signaling pathways in epithelial ovarian cancer[J].Int J Mol Sci,2013,14(5):9536-9555.
[11]Husseinzadeh N,Husseinzadeh HD.mTOR inhibitors and their clinical application in cervical,endometrial and ovarian cancers:a critical review[J].Gynecol Oncol,2014,133(2):375-381.
[12]Oishi T,Itamochi H,Kudoh A,et al.The PI3K/mTOR dual inhibitor NVP-BEZ235 reduces the growth of ovarian clear cell carcinoma[J].Oncol Rep,2014,32(2):553-558.
Enhanced effects of rapamycin on cisplatin-based chemotherapy in epithelial ovarian cancer cells
ZHANG Hai-yan,SUN Hong*
(Hospital of Obstetrics and Gynecology,Affiliated to Fudan University,Shanghai 200011,China)
Objective To explore the effects of rapamycin or rapamycin combined with cisplatin on cell proliferation and apoptosis in SKOV3 and ES-2 cells.Methods Western blot was used to detect the inhibiting effect of rapamycin on mTOR and the optical concerntration of rapamycin in SKOV3 and ES-2 cells.Methyl thiazolyl tetrazolium and flow cytometry were used to detect the growth rate and early apoptosis rate after cisplatin-based chemotherapy,rapamycin treatment or combination treatment,respectively.Results The activation of mTOR was dramatically inhibited after exposuring to 100 nmol/L rapamycin under normal culture condition(P<0.05).Cisplatin could affect the activation of mTOR signaling pathway of ES-2 cells in epithelial ovarian cancer.Compared with single use of cisplatin and rapamycin,the combination use of the two agents could significantly enhance the early apoptosis rate of SKOV3 and ES-2 cells,and inhibit the proliferation of them (P<0.05).Conclusion mTOR signaling pathway could regulate the cisplatin-based chemotherapy in epithelial ovarian cancer,rapamycin could enhance the killing effect of cisplatin by inhibiting the activation of mTOR.
Epithelial ovarian cancer;mTOR signaling;Rapamycin;Cisplatin
2014-08-29
复旦大学附属妇产科医院,上海 200011
国家自然科学基金(81001150);高等院校教育部博士点基金(20100071120090);上海科委医学引导项目(10411960800)
10.14053/j.cnki.ppcr.201501002
*通信作者
