BNIP3在心肌梗死GK糖尿病大鼠中的表达及氯化钴对心肌细胞的影响
2015-06-01王聿杰齐国先郑晓伟
王聿杰 齐国先 郑晓伟
BNIP3在心肌梗死GK糖尿病大鼠中的表达及氯化钴对心肌细胞的影响
王聿杰 齐国先 郑晓伟
目的 通过制作糖尿病大鼠和非糖尿病大鼠心肌梗死模型,研究BNIP3在糖尿病大鼠心肌梗死中的表达,探讨慢性氯化钴处理对糖尿病大鼠血糖及心肌细胞凋亡的影响。 方法 应用体质量200~250g的雄性GK(Goto-kakizaki)糖尿病大鼠及其对照雄性Wistar大鼠,通过开胸手术结扎麻醉大鼠冠状动脉左前降支制作大鼠在体心肌梗死模型,心肌梗死模型制作前测量血糖,手术成功后分组喂养大鼠3周。3周后,测量血糖,剪取心脏,检测缺血坏死区BNIP3的表达。 结果 与GK假手术组及心肌梗死组相比,GK心肌梗死+氯化钴处理组血糖降低;与GK心肌梗死组相比,GK心肌梗死+氯化钴处理组BNIP3基因表达减少;与Wistar假手术组及Wistar心肌梗死组相比,Wistar心肌梗死+氯化钴组血糖未见明显变化,与Wistar心肌梗死组相比,Wistar心肌梗死+氯化钴处理组BNIP3蛋白及基因表达亦无明显变化。 结论 慢性氯化钴处理降低糖尿病大鼠血糖,减少BNIP3凋亡基因在缺血坏死区的表达,表明高血糖可能促进心肌细胞凋亡,降低血糖可以减少心肌细胞凋亡。
BNIP3; 糖尿病大鼠; 心肌梗死; 心肌细胞凋亡
2型糖尿病是冠心病最常见的合并症之一。研究表明,冠心病合并糖尿病或者心肌梗死后发生应激性高血糖症患者病情严重程度增加,且愈后不佳[1],其机制成为临床研究的热点。多项研究都证明高葡萄糖会诱发心肌细胞发生凋亡。本试验通过制作糖尿病大鼠和非糖尿病大鼠心肌梗死模型,研究BNIP3在糖尿病大鼠心肌梗死中的表达,探讨慢性氯化钴处理对糖尿病大鼠血糖及心肌细胞凋亡的影响。
1 材料和方法
1.1 实验动物及主要试剂 Wistar大鼠购自中国医科大学盛京医院实验动物部,Goto-kakizaki(GK)糖尿病大鼠购自上海斯莱特实验动物有限责任公司,抗BNIP3抗体(武汉博士德公司),Trizol 试剂(Ivitrogen公司),氯化钴(Sigma公司)。
1.2 心肌梗死模型的制备 应用体质量在200~250 g的雄性GK糖尿病大鼠及其对照雄性Wistar大鼠进行实验。心肌梗死模型制作前测量血糖。通过开胸手术结扎麻醉大鼠冠状动脉左前降支制作大鼠在体心肌梗死模型。手术成功后分组饲养大鼠3周。
1.3 实验分组及处理 实验分组:Wistar假手术组,Wistar心肌梗死组, Wistar心肌梗死+氯化钴处理组,GK假手术组, GK心肌梗死组, GK心肌梗死+氯化钴处理组,每组动物至少存活6只。Wistar和GK假手术组经历手术过程,但只挂线不结扎冠状动脉左前降支,心肌梗死组结扎冠状动脉左前降支,心肌梗死+氯化钴处理组,于术前2 d开始饮用1.5 mmol/L氯化钴的水,术后给予饮用含2 mmol/L氯化钴的水,每组动物均不限制饮食。分组喂养3周时,测量血糖,活体剪取心脏,生理盐水冲洗后,每组中2个心脏冻存于-70 ℃冰箱中,留待生化检测,另4个心脏存于4%多聚甲醛溶液中固定,沿左室长轴由心底至心尖做厚切片(结扎左前降支的心肌梗死组,由结扎处至心尖做厚切片),石蜡包埋切片。
1.4 血糖的测定 术前及术后3周血糖的测定均采用同一方法:10%的水合氯醛3 ml/kg腹腔注射麻醉大鼠后,用眼科剪断尾采血,应用美国强生血糖仪(SureStep Plus,LifeScan)及配用的血糖试纸测量血糖。
1.5 Western blot检测 提取心肌总蛋白并调至同一浓度水平后聚丙烯酰胺凝胶电泳(每孔加样20 μl)、转膜、封闭,分别加入BNIP3 (19 kD)和β-actin (42 kD)一抗(兔抗鼠多克隆抗体,均1∶200稀释),4 ℃孵育过夜、洗膜,加入二抗(兔IgG 1∶400)孵育1 h,自动凝胶成像分析系统测定条带平均积分光密度(IOD),将各个蛋白IOD分别与内参β-actin IOD比值作为相应蛋白半定量指标。
1.6 RT-PCR检测 采用 Trizol试剂一步法提取心肌细胞总RNA,紫外分光光度计测定纯度并定量。根据GenBank提供的BNIP3和内参照β-actin 的mRNA序列,应用软件Primer Premier 5.0自行设计引物,序列见表1。应用凝胶图像分析系统进行灰度分析,BNIP3基因的表达值以BNIP3吸光度值/β-actin吸光度值×100%表示。每个样品的RT-PCR反应至少重复3次。

表1 应用于RT-PCR引物
PCR反应条件:94 ℃、5 min,1个循环;94 ℃、30 s,56 ℃、30 s,72 ℃、1 min,35个循环; 72 ℃、5 min后结束扩增反应。取5 μl PCR产物与2 μl Lodding Buffer 混合,进行2%琼脂糖凝胶电泳,100 V 1.5 h,电泳结束后凝胶成像仪分析。

2 结果
2.1 血糖比较 术前Wistar大鼠各组之间血糖无差异,GK糖尿病大鼠各组之间血糖亦无差异,但Wistar大鼠和GK糖尿病大鼠之间比较血糖差异明显(P<0.01)。在Wistar大鼠中,术前与术后3周相比,血糖值无差异。在GK糖尿病大鼠中,假手术组与心肌梗死组血糖术前与术后3周无变化,而在GK心肌梗死+氯化钴处理组,术前与术后3周血糖变化明显(P<0.01)。见表2。
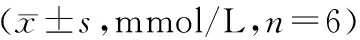
表2 术前及术后3周各组血糖的比较
注:与相同处理方法Wistar组比较,**P<0.01;与术前比较,△△P<0.01
2.2 BNIP3蛋白表达 在Wistar大鼠中,与Wistar假手术组相比,Wistar心肌梗死组及Wistar心肌梗死+氯化钴处理组BNIP蛋白表达明显增加(P<0.01)。但Wistar心肌梗死组与Wistar心肌梗死+氯化钴处理组相比BNIP蛋白表达无差异(P=0.812)。而在GK糖尿病大鼠中,与GK假手术组相比,GK心肌梗死组及GK心肌梗死+氯化钴处理组BNIP3蛋白表达增加(P<0.01),并且与GK心肌梗死组比较,GK心肌梗死+氯化钴处理组BNIP3蛋白表达减少 (P=0.02)。与Wistar心肌梗死组相比,GK心肌梗死组BNIP3 蛋白表达增加 (P=0.008)。见图1及表3。
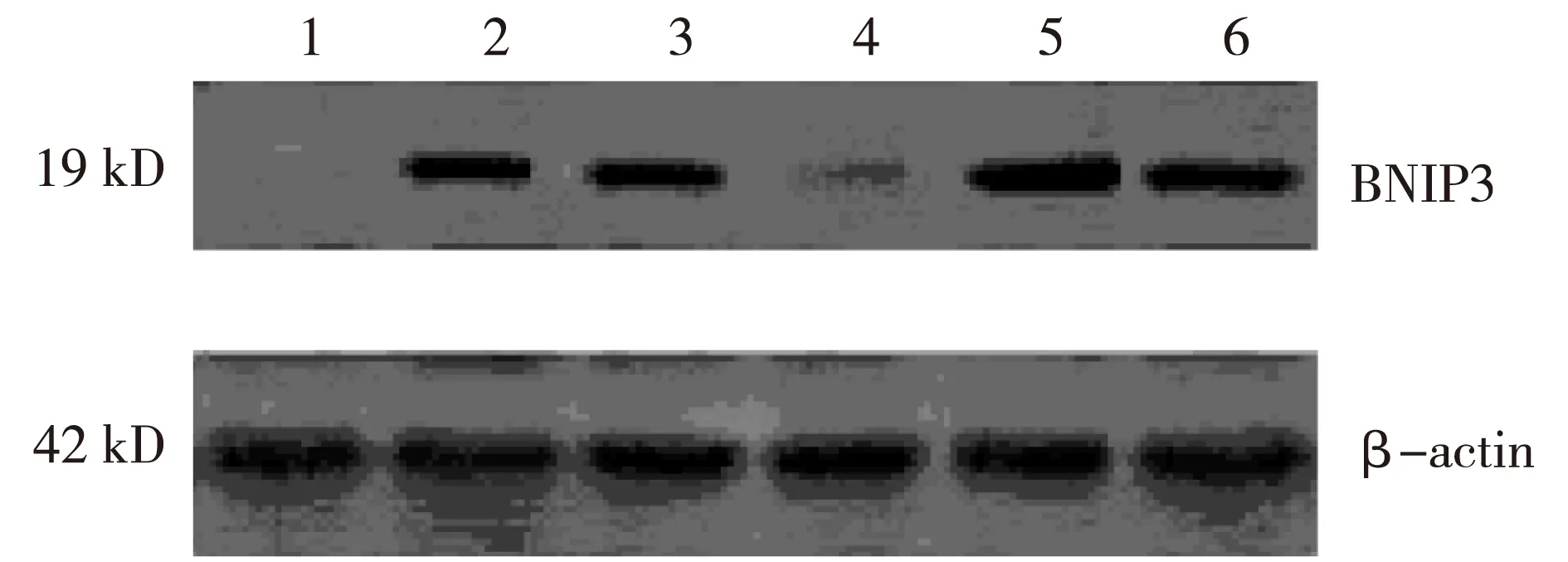
注:1. Wistar假手术组;2. Wistar心肌梗死组;3. Wistar心肌梗死+氯化钴处理组;4. GK假手术组;5. GK心肌梗死组;6. GK心肌梗死+氯化钴处理组
2.3 BNIP3 mRNA表达 在Wistar大鼠中,与Wistar假手术组相比,Wistar心肌梗死组及Wistar心肌梗死+氯化钴处理组BNIP3 mRNA表达明显增加(P<0.01)。但Wistar心肌梗死组与Wistar心肌梗死+氯化钴处理组相比BNIP3 mRNA表达无差异(P=0.726)。而在GK糖尿病大鼠中,与GK假手术组相比,GK心肌梗死组及GK心肌梗死+氯化钴处理组BNIP3 mRNA表达增加(P<0.01),并且与GK心肌梗死组比较,GK心肌梗死+氯化钴处理组BNIP3 mRNA表达减少,二者之间具有统计学意义(P=0.014)。GK心肌梗死组与Wistar心肌梗死组相比,GK心肌梗死组BNIP3 mRNA表达增加,二者之间差异显著(P=0.006)。见图2及表3。
3 讨论
近年研究发现细胞凋亡在缺血性心脏病的发生发展中发挥重要作用,在心肌梗死早期,细胞凋亡是心肌细胞死亡的主要形式,细胞坏死跟随在细胞凋亡之后,凋亡在早期心室重构中起重要作用。而在心肌梗死后期,仍然有心肌细胞凋亡存在,且与进行性心室重构、心力衰竭密切相关[2-3]。

注:1. Wistar假手术组;2. Wistar心肌梗死组;3. Wistar心肌梗死+氯化钴处理组;4. GK假手术组;5. GK心肌梗死组;6. GK心肌梗死+氯化钴处理组
注:与假手术组比较,**P<0.01;与相同处理方法Wistar组比较,△△P<0.01;与心肌梗死组比较,▲P<0.05
高血糖是糖尿病的一个主要的病理因素,高血糖引起静脉、动脉和外周神经的各种病理改变。在培养的牛主动脉内皮细胞,高血糖引起损伤的病理机制涉及:葡萄糖诱导的蛋白激酶C亚型的激活,葡萄糖衍生的高等糖化终产物(AGEs)生成增加,通过醛糖还原酶通路葡萄糖流出增加[4]。高血糖增加活性氧簇(ROS)的产生,而ROS的产生增加可以被电子传递链复合体Ⅱ、氧化磷酸化解偶联剂、解偶联蛋白-1和二氧化锰超氧化物歧化酶阻断,线粒体ROS恢复正常水平阻止葡萄糖诱导的蛋白激酶C亚型的激活AGEs生成、山梨(糖)醇积聚和核因子-κB(NF-κB)激活[5]。越来越多的证据表明线粒体电子传递链过氧化物的过多产生可能在糖尿病合并症的病理机制中起着主要和关键的作用[5-6]。
钴作为体内的一个微量元素,在元素周期表中属于ⅧB族。多项研究表明氯化钴处理可以降低糖尿病大鼠血糖[7],其可能的机制有多种:氯化钴可以引起STZ糖尿病大鼠GLUT1表达增加[8],增强大鼠葡萄糖转运[9],抑制糖原异生作用[10],恢复STZ 糖尿病大鼠肝糖原水平而对肌糖原没有影响[11],氯化钴降低STZ 糖尿病大鼠肝脏、心脏和大动脉的脂质过氧化反应[12-13]。本研究结果显示:氯化钴降低糖尿病大鼠血糖,而不降低非糖尿病大鼠血糖,考虑的机制可能与降低高血糖引起的氧化应激反应以及增加胰岛素敏感性有关。
BNIP3是一个缺氧诱导的凋亡调节蛋白,由缺氧诱导因子1(hypo inducible factor 1, HIF-1)诱导表达[14-15]。HIF-1α可通过增加一些促凋亡蛋白的表达,介导缺氧诱导的细胞凋亡。Bcl-2家族中的多个调节蛋白如Bak和Bax等都在HIF-1介导的凋亡中发挥作用。BNIP3是属于Bcl-2家族BH3-only结构域亚家族的一个线粒体促凋亡蛋白,可因缺氧或HIF-1α过表达而激活[16]。正常情况下BNIP3在大多数组织检测不到,在多种细胞缺氧可强烈诱导BNIP3表达[17-19]。
本实验结果表明,GK糖尿病大鼠及其对照Wistar大鼠在心肌梗死后,其缺血坏死区BNIP3表达均增加,说明缺氧可以诱发和加重心肌细胞凋亡,而慢性氯化钴处理可以降低GK糖尿病大鼠血糖,同时降低BNIP3在缺血坏死区的表达。本实验结果表明冠心病合并糖尿病的病人,积极控制血糖对于缺血心肌可以起到积极的调节和保护作用,可以改善病情及预后,这有助于改善心功能并降低心肌梗死的死亡率。
总之,通过慢性氯化钴处理降低糖尿病大鼠血糖,可能减轻高血糖引起的缺氧心肌氧化应激反应和增加缺氧心肌对胰岛素的敏感性,并减少BNIP3凋亡基因在GK糖尿病大鼠心肌缺血坏死区的表达,可以改善心脏功能,并改善预后和降低心肌梗死的死亡率,为冠心病合并糖尿病患者积极控制血糖提供了理论基础和科学依据。
[1] Li H, Liu Z, Wang J, et al. Susceptibility to myocardial ischemia reperfusion injury at early stage of type1 diabetes in rats[J]. Cardiovasc Diabetol, 2013, 12:133.
[2] Abbate A,Biondi Zoccai G G,Bussani R,et al. Increased myocardial apoptosis in patients with unfavorable left ventricular remodelingand early symptomatic post-infarction heart failure[J]. J Am Coll Cardiol,2003,41(5):753-760.
[3] Baldi A,Abbate A,Bussani R,et al.Apoptosis and post-infarction left ventricular remodeling[J]. J Mol Cell Cardiol,2002,34(2):165-174.
[4] Nishikawa T, Edelstein D, Du XL, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage[J]. Nature, 2000, 404(6779):787-790.
[5] Ceriello A. New insights on oxidative stress and diabetic complications may lead to a “causal” antioxidant therapy[J]. Diabetes Care, 2003,26(5): 1589-1596.
[6] Brownlee M. Biochemistry and molecular cell biology of diabetic complications[J]. Nature, 2001,414(6865): 813-820.
[7] 王聿杰,张世光,郑晓伟,等.慢性氯化钴处理对GK糖尿病大鼠缺氧诱导因子1的表达及心肌梗死面积的影响[J].生物化学与生物物理进展,2008,35(6):712-718.
[8] Ybarra J, Behrooz A, Gabriel A, et al.Glycemia-lowering effect of cobalt chloride in the diabetic rat: increased GLUT1 mRNA expression[J].Mol Cell Endocrinol,1997, 133(2):151-160.
[9] Eaton RP. Cobalt chloride-induced hyperlipemia in the rat: effects on intermediary metabolism[J]. Am J Physiol, 1972, 222(6):1550-1557.
[10]Saker F, Ybarra J, Leahy P, et al.Glycemia-lowering effect of cobalt chloride in the diabetic rat: role of decreased gluconeogenesis[J]. Am J Physiol, 1998, 274(6 Pt 1):E984-E991.
[11]Nomura Y, Okamoto S, Sakamoto M, et al. Effect of cobalt on the liver glycogen content in the streptozotocin-induced diabetic rats[J]. Mol Cell Biochem, 2005, 277(1/2):127-130.
[12]Yildirim O, Büyükbingöl Z. Effects of supplementation with a combination of cobalt and ascorbic acid on antioxidant enzymes and lipid peroxidation levels in streptozocin-diabetic rat liver[J]. Biol Trace Elem Res, 2002, 90(1/3):143-154.
[13]Yildirim O, Büyükbingöl Z.Effect of cobalt on the oxidative status in heart and aorta of streptozotocin-induced diabetic rats[J]. Cell Biochem Funct, 2003, 21(1):27-33.
[14]Guo K, Searfoss G, Krolikowski D, et al. Hypoxia induces the expression of the pro-apoptotic gene BNIP3[J]. Cell Death Differ, 2001, 8(4):367-376.
[15]Giaccia A, Siim BG, Johnson RS. HIF-1 as a target for drug development[J]. Nat Rev Drug Discov, 2003, 2(10):803-811.
[16]Lomonosova E, Chinnadurai G.BH3-only proteins in apoptosis and beyond: an overview[J]. Oncogene, 2008, 27 (Suppl 1):S2-S19.
[17]Mellor HR, Harris AL.The role of the hypoxia-inducible BH3-only proteins BNIP3 and BNIP3L in cancer[J].Cancer Metastasis Rev, 2007, 26(3/4):553-566.
[18]Azad MB, Chen Y, Henson ES, et al.Hypoxia induces autophagic cell death in apoptosis-competent cells through a mechanism involving BNIP3[J].Autophagy, 2008, 4(2):195-204.
[19]Kubli DA, Ycaza JE, Gustafsson AB.Bnip3 mediates mitochondrial dysfunction and cell death through Bax and Bak[J]. Biochem J, 2007, 405(3):407-415.
Expression of BNIP3 and effect of cobalt chloride in GK diabetic rats with myocardial infarction
WANGYu-jie.DepartmentⅡofVeteranOfficers’Wards,GeneralHospitalofShenyangMilitaryAreaCommand,PLA,Shenyang110015,China;QIGuo-xian,ZHENGXiao-wei.CardiovascularDepartmentofFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China.
Objective To investigate the expression of BNIP3 gene in GK diabetic rats with myocardial infarction, and to explore the effect of chronic treatment of cobalt chloride on blood glucose and cardiomyocytes apoptosis in myocardial infarction models of diabetic rats and non-diabetic rats. Methods The experiments were carried out in male GK(Goto-kakizaki) diabetic rats and male Wistar rats (both weighing 200-250 g). Left anterior descending coronary artery (LADCA) was ligated with silk ligature in anesthetized rats. Rats were divided into six groups and raised with different treatments for 3 weeks. Before and 3 weeks after operation, the level of blood glucose of each rat was measured. Three weeks after operation, the hearts of the rats were excised, then BNIP3 expression was detected in all groups. Results Compared with GK sham-operated group and GK operated group, the level of blood glucose of GK operated group treated with cobalt chloride decreased; Compared with GK operated group, BNIP3 expression in GK operated group treated with cobalt chloride decreased; Compared with Wistar sham-operated group and Wistar operated group, blood glucose didn’t significantly change in Wistar operated group treated with cobalt chloride; Compared with Wistar operated group, BNIP 3 expression didn’t change in Wistar operated group treated with cobalt chloride. Conclusions Chronic treatment with cobalt chloride can decrease the level of blood glucose in GK diabetic rats, and also decrease BNIP3 expression in ischemic zone and necrosis of GK diabetic rats, which indicate high blood glucose may promote cardiomyocytes apoptosis, and decreasing high blood glucose can decrease cardiomyocytes apoptosis.
BNIP3; diabetic rats;myocardial infarction; cardiomyocytes apoptosis
国家自然科学基金资助课题(30500212)
110015辽宁省沈阳市,中国人民解放军沈阳军区总医院第二干部病房(王聿杰); 110001辽宁省沈阳市,中国医科大学附属第一医院心血管内科(齐国先,郑晓伟)
R 587.1
A
10.3969/j.issn.1003-9198.2015.07.010
2014-10-20)
