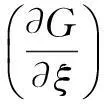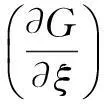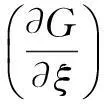物理化学教学内容研究交流研讨会纪要
2015-06-01张树永王新平侯文华
张树永 王新平 侯文华
( 1 山东大学化学与化工学院 山东济南 250100;
2 大连理工大学化学学院 辽宁大连 116024;
3 南京大学化学化工学院 江苏南京 210093)
物理化学教学内容研究交流研讨会纪要
张树永1王新平2侯文华3
(1山东大学化学与化工学院山东济南 250100;
2大连理工大学化学学院辽宁大连 116024;
3南京大学化学化工学院江苏南京 210093)
摘要2015年4月16~17日,高等教育出版社在山东青岛组织召开了物理化学教学内容研究交流研讨会,就自发变化和可逆过程的定义、可逆与平衡、自发与不可逆的关系、环境熵和总熵、环境的热力学界定和总熵判据、反应的方向与限度等问题进行了研讨。本文是此次会议的纪要,希望对纠正物理化学教学中的一些偏颇甚至错误的认识有所裨益。
关键词物理化学教学内容研讨会纪要
A Summary of the Seminar on Physical Chemistry Teaching
Zhang Shuyong1Wang Xinping2Hou Wenhua3
(1SchoolofChemistryandChemicalEngineering,ShandongUniversity,Jinan250100,Shandong,China;
2College of Chemistry, Dalian University of Technology, Dalian 116024, Liaoning, China;
3School of Chemistry and Chemical Engineering, Nanjing University, Nanjing 210093, Jiangsu, China)
AbstractOnApr. 16-17, 2015,the“SeminaronPhysicalChemistryTeaching”sponsoredbyHigherEducationPresswasheldinQingdao,Shandong.Duringthisseminar,someimportantproblemsanddisputesincludingthedefinitionsofspontaneouschangeandreversibleprocess,therelationshipbetweenreversibilityandequilibrium,therelationshipbetweenspontaneityandirreversibility,entropyofsurroundingsanduniverseentropy,thermodynamicdefinitionofsurroundings,universeentropycriterion,reactiondirectionandreactionlimitwerediscussed.Somedeepinsightsofdefinitionsandsettlementsofdisputesweremade.Thispaperisasummaryofthisseminar,whichismeaningfulandhelpfulforboththetextbookauthorsandtheteachersofphysicalchemistry.
KeyWordsPhysicalchemistry;Teaching;Seminar;Summary
2015年4月16~17日,由高等教育出版社组织的物理化学教学内容研究交流研讨会在山东青岛召开。来自全国13所高校的27位长期从事物理化学教学的老教师和年轻一线教师出席了此次会议。会议由山东大学张树永教授、南京大学侯文华教授先后主持。
高等教育出版社化学化工分社分社长鲍浩波首先介绍了召开此次会议的目的以及会议的要求,明确此次会议将主要围绕自发变化和可逆过程的定义、可逆与平衡、自发与不可逆的关系、环境熵和总熵、环境的热力学界定和总熵判据、反应的方向与限度等在物理化学教学中存在混淆和争论的问题展开。
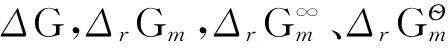
会议交流并讨论的内容包括:
1自发变化和可逆过程
“自发”关注的是变化发生的倾向和进行的方向。所谓自发变化(spontaneouschange)是指在所处条件下,不需环境对系统做功,系统就可以自行发生的变化。反之就是非自发变化。“所处条件下”不一定是常温常压,如石墨转化为金刚石在高温高压下可以自发发生。自发变化一般都具有对外做功的潜力。
“可逆”关注的是过程进行的方式。过程进行的方式有2种:可逆或者不可逆。所谓可逆过程(reversibleprocess)就是在变化过程中,系统每时每刻都处于平衡态,系统的热力学状态函数都具有确定值。真正的可逆过程是由一系列平衡状态点组成的,但因为平衡态是稳定状态,任何从平衡态到非平衡态的过程都不可能自发进行,所以可逆过程是一个理想化的、不可能实现的过程。
通常所说的“可逆过程”是通过外界施加微小的干扰(微扰)使系统的平衡发生微小偏离(但无限接近平衡)而后过渡到下一个平衡态(不必考虑弛豫的时间)的一系列微小变化组成的过程。其基本特征是:系统无限接近平衡态、每一步变化都十分微小、整个过程进行得无限缓慢、每一步变化都既可正向进行又可逆向进行并可使系统和环境都复原而不留下任何改变。可逆过程的特点是过程的驱动力无限小而且可正可负,其根本特征是当系统复原时环境也可以复原而不留下任何其他变化。
所以,“可逆”是指过程变化的方式和系统与环境复原的程度。
可逆过程是抽象的、理想化的过程而非现实过程。通过假设可逆过程可以预测变化的理论极限、计算不可逆过程的熵变等,具有重要的理论意义。
可逆过程在状态图上可用一条连续的、一阶和二阶皆可求导的实线表示。不可逆过程在状态图上则是不连续的。
自发变化总以不可逆的方式进行,但反过来说不可逆过程必然自发则不正确。气体的混合、热从高温物体向低温物体的传输都是“自发”的“不可逆”过程,一旦发生就会自动进行下去,直至达到某种限度(如气体均匀混合、温度均一等)。压强差很小的膨胀、温度差很小的热传导虽然具有可逆过程的一部分特征,平时也称之为可逆过程,但不难发现,经历逆过程使系统复原后,环境付出了功而得到了热,而从热力学第二定律的观点看,这些过程显然是不可逆的。
自发仅表示过程有自动进行的趋势而不表示过程可以实际发生。即自发表述的是可能性而非现实性。如H2(g)和O2(g)反应生成H2O(l)以及N2(g)和H2(g)合成NH3(g),在常温常压下都是自发过程,但在所处条件下(常温常压)却都难以进行。
不自发过程既可以按照可逆方式也可以按照不可逆的方式进行。可见“自发”和“非自发”与“不可逆”和“可逆”之间并没有对应关系,不宜混用。
2可逆过程与平衡
平衡是指系统所有宏观性质不再随时间改变的状态。达到平衡时,系统的温度、压强、化学组成和相组成都固定不变,系统各热力学函数都有确定数值。
可逆是说过程变化的方式,平衡是说系统的状态。过程对应于始态到终态的状态变化,而平衡则是状态不变。所以,可逆与平衡是完全不同的概念。
应该区分“可逆过程”与“动态平衡”的概念。在100 ℃、常压下,水与水蒸气处于平衡状态。此时水的气化(正向过程)和水蒸气的冷凝(逆向过程)等速进行,净效果为0,故属于动态平衡。此时,系统并不存在从宏观状态1到宏观状态2的变化,故无所谓过程,更无所谓可逆。但在100 ℃,常压下,可以将水经过准静态过程变成水蒸气,也可以将水蒸气经过准静态过程变成水,此时才发生从水到水蒸气或者从水蒸气到水的状态变化过程,才可以用是否可逆进行表述。与其类似,在范霍夫平衡箱中的反应和可逆电池中的充放电反应等也都是可逆过程。
3判据
3.1 关于封闭系统(熵判据和总熵判据)
对于绝热系统,ΔS系统≥0。其中,“>”表示过程能够发生,过程不可逆;“=”表示系统处于平衡态或者过程能发生且为可逆过程;不存在ΔS系统<0的情况。
对于隔离系统,ΔS隔离≥0。其中,“>”表示能够自发进行,过程不可逆;“=”表示系统处于平衡态;不存在ΔS隔离<0的情况。
对于有热和功交换的封闭系统,需考虑系统和环境的总熵变(universe entropy)ΔS总=ΔS系统+ΔS环境。其中,对于环境熵变(ΔS环境),因为环境为无限大,系统的变化并不会导致环境性质的实质性改变,所以,通常认为系统与环境之间的能量交换总是以可逆的方式进行的。所以,可以通过假设可逆过程方便地求算ΔS环境。
当ΔS总>0时,系统发生不可逆过程,但不一定自发,进行的限度是熵达到最大;当ΔS总=0时,系统处于平衡状态或者过程能发生且为可逆过程;不存在ΔS总<0的情况。要用ΔS总判断变化是否自发,环境只能与系统发生有限的热交换,而不能对系统做功。不宜将系统和环境合在一起作为孤立系统来处理系统的自发性问题。
3.2 关于封闭系统的等温过程(Helmholtz自由能判据)
一个实际发生的过程,一定有ΔA≤W。其中W=We+Wf,We为体积功(或称膨胀功),Wf为非体积功(也称非膨胀功或有效功)。ΔA 如果封闭系统发生等容过程(不做体积功)又不做有效功,则可以用ΔA≤0进行讨论。即ΔA<0时为自发过程,不可逆;ΔA=0为达到平衡态或者过程按可逆方式进行。 与ΔS不同,采用ΔA判据不需要考虑环境。 任何可以实际发生的过程,一定有ΔG≤Wf。ΔG 对于不做有效功的系统(Wf=0),可以采用ΔG≤0进行讨论。即ΔG<0,变化能够自发发生;ΔG=0,系统处于平衡态或者过程以可逆的方式进行。即任何自发的变化都向着吉布斯自由能降低的方向进行,直至ΔG=0为止。 在非等压条件或者虽然等压但系统压力(p系统)不等于环境压力(p环境)时,不能使用ΔG判据。 4其他概念辨析 系统之外,与系统密切相关、系统的变化能够影响的部分称为环境。 环境是抽象出来的庞大物体,具有恒定的温度和压强,能够为系统的等温、等压过程提供客观条件。因为环境的温度和压强恒定,当系统与环境发生热交换时,对于环境而言都可以理解为以可逆的方式进行。 试图定义环境的状态并将环境与系统合并作为孤立系统看待的观点与环境的定义与性质相矛盾。 功和热都属于能量。热是由于系统与环境的温度不同所导致的能量传递。其他形式的能量传递统称为功,包括电能、化学能、电磁能、辐射能、机械能等所有形式的能量。 在含有大量反应物的反应系统中,对指定反应式,发生反应进度为1摩尔的化学反应时,系统吉布斯自由能的改变值为ΔrGm。 与会者一致认为,这是多年来第一次就物理化学教学中的具体问题召开研讨会,进行深入的交流和研讨。这种交流和研讨对于明辨相关概念,纠正一些错误认识,保证物理化学教材编写质量和物理化学教学质量都具有重要意义。这个会议以后将持续举办下去,希望有更多的教材编著者和一线教师能够参与相关讨论并从中受益。 中图分类号O6;G64 doi:10.3866/pku.DXHX20150388 10.3866/pku.DXHX201503923.3 关于封闭系统的等温等压过程(Gibbs自由能判据)
4.1 环境
4.2 功和热