短芒大麦草青贮微生物特性研究及优良乳酸菌筛选
2015-06-01陶雅李峰高凤芹孙启忠
陶雅,李峰,高凤芹,孙启忠*
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.农业部牧草资源与利用重点实验室,内蒙古 呼和浩特 010010)
短芒大麦草青贮微生物特性研究及优良乳酸菌筛选
陶雅1,2,李峰1,高凤芹1,2,孙启忠1,2*
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.农业部牧草资源与利用重点实验室,内蒙古 呼和浩特 010010)
以短芒大麦草为研究对象,利用传统培养法从叶围和青贮发酵体系中分离出乳酸菌、大肠杆菌、好氧细菌、酵母菌和霉菌,并计数;结合细菌形态学、生理生化特征及16S rDNA序列分析鉴定分离出的乳酸菌菌株;通过研究乳酸菌的生长曲线、产酸特性及耐酸性,筛选优质乳酸菌。以期探明短芒大麦草叶围及青贮发酵体系中微生物菌群特性及青贮料中乳酸菌多样性,筛选出具有促发酵效果的乳酸菌菌株,为有益微生物饲料研发奠定基础。试验结果表明,短芒大麦草经青贮发酵后各微生物菌群数量发生不同程度变化,乳酸菌数量由0 cfu/g FM增加到4.00×108cfu/g FM,酵母菌数量由8.50×105cfu/g FM增加到1.02×108cfu/g FM,而好氧细菌、大肠杆菌和霉菌数量变化不明显;从短芒大麦草青贮发酵体系分离得到4株乳酸菌,经鉴定Lx36为Lactobacilluspentosus,Lx37为Lactobacillusbrevis,Lx53为Pediococcuspentosaceus,Lx54为Lactobacillusparabuchneri;筛选得到1株益于青贮的乳酸菌株Lx36,约在20 h后进入稳定生长期,OD值达到4.21,且发酵12 h的pH仅为4.08,并可以在pH=3.0环境条件下生长。综上所述,青贮发酵是体系中各种微生物相互作用的过程,微生物菌群的数量及变化直接影响青贮饲料发酵品质。短芒大麦草青贮饲料中乳酸菌种类较丰富,筛选得到的戊糖乳杆菌繁殖速度快、产酸能力强同时表现出了较强的耐酸性,具有潜在的生产应用价值,适宜用作促发酵的青贮添加剂菌种。
短芒大麦草;青贮;微生物特性;乳酸菌
短芒大麦草(Hordeumbrevisubulatum)产量高、适口性好、适应性广且具有较强的耐盐性,其青草利用期长、叶量丰富、草质柔软、营养品质好、粗蛋白含量高,是一种良好的放牧—刈割兼用型多年生禾草[1-3]。开发短芒大麦草青贮饲料,能够有效地利用青绿植物中的营养成分、提高饲料的适口性、扩大饲料来源、解决季节性饲草不平衡、促进饲料的均衡供应。
乳酸菌是影响青贮发酵品质的主要因素之一。近年,欧美畜牧业发达的国家及日本致力于开发乳酸菌等添加物,改善青贮饲料的发酵品质和营养价值的研究。而我国对于青贮乳酸菌的研究起步比较晚,对青贮乳酸菌资源的收集、发酵特性以及遗传特性研究比较落后,拥有自主知识产权的乳酸菌及其制剂较少[4],得到大量推广应用的更是微乎其微。本试验以短芒大麦草为材料,对青贮过程中起作用的微生物菌群进行初步研究,探明该青贮料中乳酸菌多样性,并选出性状优良的乳酸菌,为制备有益微生物饲料奠定基础。
1 材料与方法
1.1青贮原料
以短芒大麦草为供试材料,采自内蒙古赤峰市林西县良种场,于2013年8月短芒大麦草处于初花期,从田间按梅花形布点法选取5个区域取样刈割。
1.2青贮调制
将刈割的短芒大麦草铡成2~3 cm,充分混合均匀后,按照四分法选取适量的样品装入聚乙烯袋,设3次重复,每袋约200 g,用真空包装机抽成真空并封口,室温条件下放置60 d后开封取样分析。
1.3仪器设备
生物安全柜为ESCO公司的AC2-S型;恒温培养箱为MEMMERT公司的INB400型;立式压力蒸汽灭菌器为上海申安医疗器械厂的LDZX-50KBS型;台式恒温摇床为太仓市实验设备厂的THZ-D型;光学显微镜为OLMPUS的 BX51型;高速冷冻离心机为Thermo公司Fresco 21型;PCR仪为BIO-RAD的Peltier Thermal Cycler;凝胶成像仪为ALphaImage;电泳仪为北京六一仪器厂的dyy-6c型;紫外分光光度计为北京普析通用仪器有限责任公司的TU-1901型。
1.4培养基及试剂
液体、固体MRS培养基、NA培养基和PDA培养基购自广东环凯微生物科技有限公司;BLB培养基购自日水制药株式会社;细菌全基因组DNA提取试剂盒、2×Taq PCR MasterMix、溶菌酶等购自天根生化科技有限公司;扩增引物购自上海桑尼生物科技有限公司。
1.5试验方法
1.5.1微生物计数 采用稀释平板涂布法对短芒大麦草原料和青贮料中微生物菌群进行计数,称取5 g待测样品,放入装有45 mL无菌水的三角瓶内,置于摇床振荡30 min,将得到的溶液继续用无菌水做10倍梯度的稀释,分别吸取10-1,10-3和10-5三个稀释度悬液20 μL,均匀涂于MRS、BLB、NA和PDA平板培养基上,MRS培养基上的菌落(乳酸菌)于37℃厌氧环境下培养,BLB、NA和PDA培养基上菌落(大肠杆菌、好氧细菌、酵母菌和霉菌)则直接置于37℃恒温培养箱内,48 h后对各平板上的菌落数进行计测。
1.5.2乳酸菌的分离与纯化 挑取MRS培养基上生长的典型菌落,在MRS平板上反复划线分离,直到获得该菌的纯培养。对获得的各菌株进行革兰氏染色[5]和过氧化氢酶试验[6]。凡是呈革兰氏阳性、过氧化氢酶阴性的菌株,均认为是疑似乳酸菌,保存备用。
1.5.3乳酸菌的生理生化特征鉴定 乳酸菌发酵葡萄糖产气试验参照凌代文和东秀珠[6]的方法进行。在不同温度(10,15,40,45℃)、pH(pH=3.0,3.5,4.0,4.5,5.0,7.5,8.0)和NaCl浓度(3.0%和6.5%)条件下生长试验以及利用API 50CH检测乳酸菌对49种不同碳源发酵能力检测参照Duan等[7]方法进行。
1.5.4乳酸菌菌株的16S rDNA序列分析及系统进化树的构建 乳酸菌DNA的提取按照天根细菌全基因组DNA提取试剂盒说明进行。以提取菌株的DNA为模板,应用引物序列27f:5′-AGAGTTTGATCCTGGCTCAG-3′和1492r:5′-AAGTCGTAACAAGGTAACC-3′进行PCR扩增,PCR反应体系(50 μL)为:2×Taq PCR Master Mix 25 μL,引物27f和1492r(10 μmol/L)各2 μL,模板2 μL,加ddH2O补足至50 μL。PCR扩增程序为:94℃预变性5 min;94℃,变性50 s;55℃,退火50 s;72℃,延伸2 min,30个循环后,72℃延伸10 min,4℃保存。利用1.5%琼脂糖凝胶电泳检测PCR产物,PCR扩增片段约为1500 bp,将PCR产物送上海桑尼生物科技有限公司进行双向测序。将测序获得的所有菌株序列信息利用Blast检索系统在GenBank数据库中进行Blast比对,选择适当数量与目的基因序列同源性相对较高的标准菌株的16S rDNA序列与测定菌株的16S rDNA序列,共同用MEGA 5.1软件构建系统进化树。
1.5.5产酸速率测定 将乳酸菌按3%的接种量转入MRS液体培养基中,于37℃培养12 h,每隔2 h测定不同菌株发酵液pH,以培养时间为横坐标,pH为纵坐标绘制产酸速率曲线[8]。
1.5.6生长曲线的测定 将乳酸菌按3%的接种量转入MRS液体培养基中,于37℃培养36 h,每隔2 h取1次样品,在620 nm下测定样品的吸光度值,以培养时间为横坐标,对应的吸光度值为纵坐标绘制生长曲线[8]。
2 结果与分析
2.1短芒大麦草叶围及青贮体系微生物计数
短芒大麦草新鲜样品与青贮样品中微生物种类和数量见表1,新鲜样品上附着的微生物数量最多的是好氧细菌,为3.15×107cfu/g FM,其次是大肠杆菌和酵母菌,而乳酸菌和霉菌未检测到,经过青贮发酵后,乳酸菌数量明显增多,达到了4.00×108cfu/g FM,酵母菌的数量也有所增加,而大肠杆菌、好氧细菌和霉菌数量几乎没有变化。

表1 短芒大麦草微生物计数Table 1 Microbiological analysis of the H.brevisubulatum cfu/g FM
cfu:菌落形成单位Colony forming unit;FM:鲜物质Fresh matter.
2.2乳酸菌的生理生化特征
从短芒大麦草青贮样品中共分离出4株乳酸菌,分别命名为Lx36、Lx37、Lx53、Lx54,各菌株生理生化特征见表2、3。 所有分离到的菌株均表现为革兰氏阳性、过氧化氢酶阴性,其中Lx36和Lx53发酵葡萄糖不产生CO2,属同型发酵乳酸菌,而Lx37和Lx54为异型发酵乳酸菌;根据这4株乳酸菌生理生化特性可将其分成2个类群:类群Ⅰ包含Lx36、Lx37、Lx54,这3株菌均为杆菌,可在40℃、45℃、3.0% NaCl浓度和pH=4.5,5.0,7.5,8.0的环境条件下生长,其中Lx36在5和10℃下不生长,Lx37在5℃、6.5% NaCl浓度和pH=3.0,3.5,4.0条件下弱生长,Lx54在6.5% NaCl浓度和pH=3.0条件下不生长,而在pH=3.0时弱生长。这3株菌均可以利用果糖、半乳糖、葡萄糖、麦芽糖、密二糖和葡萄糖酸盐,其中Lx36可以发酵苦杏仁苷、纤维二糖、甘露醇、甘露糖、海藻糖,而Lx37和Lx54不能发酵这几种碳源,Lx54可以发酵松三糖、棉籽糖和蔗糖,而Lx37不能利用这几种碳源,所以将3株菌株初步鉴定[6,9]属于乳杆菌属(Lactobacillus);类群Ⅱ包含Lx53,该菌为球菌,在5℃和pH=3.0,3.5条件下不生长,可以发酵核糖、麦芽糖、海藻糖和熊果苷,不能利用松三糖、鼠李糖、乳糖、蔗糖、淀粉、甘油、甘露醇和α-甲基-D-葡萄糖苷,其生理生化性状与片球菌属相似,初步鉴定属于片球菌属(Pediococcus)。
2.3乳酸菌的16S rDNA 序列分析以及系统发育树构建
将测序获得的所有16S rDNA序列信息在NCBI数据库和EzTaxon数据库中进行Blast相似性比对,结果见表4。所有序列与数据库中已知16S rDNA基因序列的相似性均在99.0%~100.0%之间。

表2 青贮饲料中乳酸菌的生理生化特征Table 2 The physiological biochemical characteristics of lactic acid bacteria strains isolated from silage
+:生长Positive;-:不生长Negative;w:微弱生长Weakly positive.
由系统发育分析可以看出(图1),4株乳酸菌分别属于乳杆菌属和片球菌属,其中:Lx36与Lactobacilluspentosus的系统位置最接近,相似度为100.00%,Lx37与Lactobacillusbrevis处于同一进化分支上,相似度达100.00%,Lx53与Pediococcuspentosaceus的系统进化位置最接近,相似度为99.97%,Lx54与Lactobacillusparabuchneri处于同一进化分支上,相似度达100.00%。
2.4乳酸菌生长曲线及繁殖速度比较
4株乳酸菌的生长曲线见图2,从曲线中可以看出4株乳酸菌均在2 h后进入对数生长期,其中Lx53、Lx54和Lx37约在14 h左右进入稳定生长期,生长速度依次递减,生长较为缓慢,而Lx36生长速度较快,明显高于其他3株乳酸菌,约在20 h后进入稳定生长期,20 h时其OD值达到4.21。可见4株乳酸菌中Lx36的繁殖速度最快。
2.5乳酸菌产酸速率及产酸能力比较
4株乳酸菌发酵过程中产酸速率曲线如图3所示。从图中可以看出,Lx37和Lx54发酵液的pH下降较为缓慢,发酵12 h的pH分别为5.28和5.35,Lx53发酵液的pH下降较快,发酵12 h的pH为4.51,而Lx36发酵液的pH下降最快,从2 h便开始急剧下降,其发酵12 h的pH仅为4.08。可见4株乳酸菌中Lx36的产酸能力最强。

表3 乳酸菌API 50 CH 碳源发酵结果Table 3 API 50 CH fermentation patterns of lactic acid bacteria strains isolated from silage
+:90%菌株为阳性90% or more of the strains are positive;-:90%菌株为阴性90% or more of the strains are negative;w:弱阳性Weakly positive.

表4 乳酸菌株16S rDNA序列Blast比对结果Table 4 Blast results of 16S rDNA sequences of lactic acid bacteria strains
3 讨论
青贮发酵过程是各种微生物共同作用的结果,参与青贮过程的微生物包括青贮原料上附着的微生物,引起青贮饲料发酵的微生物以及引起青贮腐败变质的微生物等[10],在整个青贮过程中微生物的数量存在动态变化[11]。Kobayashi等[12]研究认为,附生乳酸菌的数量影响最终发酵品质,如果牧草表面附生乳酸菌数量过低,则会导致青贮料发酵品质和营养价值下降。检测附生乳酸菌的数量可以预测自然青贮发酵充分与否及是否有必要添加菌剂促进发酵[13]。本研究中短芒大麦草青贮前后乳酸菌数量变化较大,青贮前并未在新鲜样品上检测出乳酸菌,青贮发酵后样品中乳酸菌含量高达108cfu/g FM,酵母菌的数量由105cfu/g FM变化到108cfu/g FM,而大肠杆菌、好氧细菌和霉菌的数量变化不明显。可见短芒大麦草在青贮发酵过程中,随着厌氧和酸性环境的形成,乳酸菌迅速繁殖,数量增加;酵母菌在厌氧条件下可利用青贮饲料中的糖分进行繁殖,数量也有所增加;大肠杆菌和部分好氧细菌,耐酸性不强,当发酵体系pH逐渐降低时,这两类细菌的生长受到抑制,但是可能由于短芒大麦草附生乳酸菌数量太低,导致发酵效果不理想[12],青贮后发酵体系pH并未迅速降低到能够显著抑制这两类细菌的程度,所以其数量没有显著降低。Zhang[14]研究了青贮原料和青贮料中微生物种类和数量,青贮前乳酸菌数量在101~107cfu/g、肠细菌数量为102~108cfu/g、酵母菌数量为101~107cfu/g、霉菌数量为102~106cfu/g,青贮后这几类微生物数量分别为105~109cfu/g、低于102cfu/g、102~106cfu/g和104cfu/g,本研究结果基本与其相符,但短芒大麦草青贮后肠细菌和酵母菌数量较高。
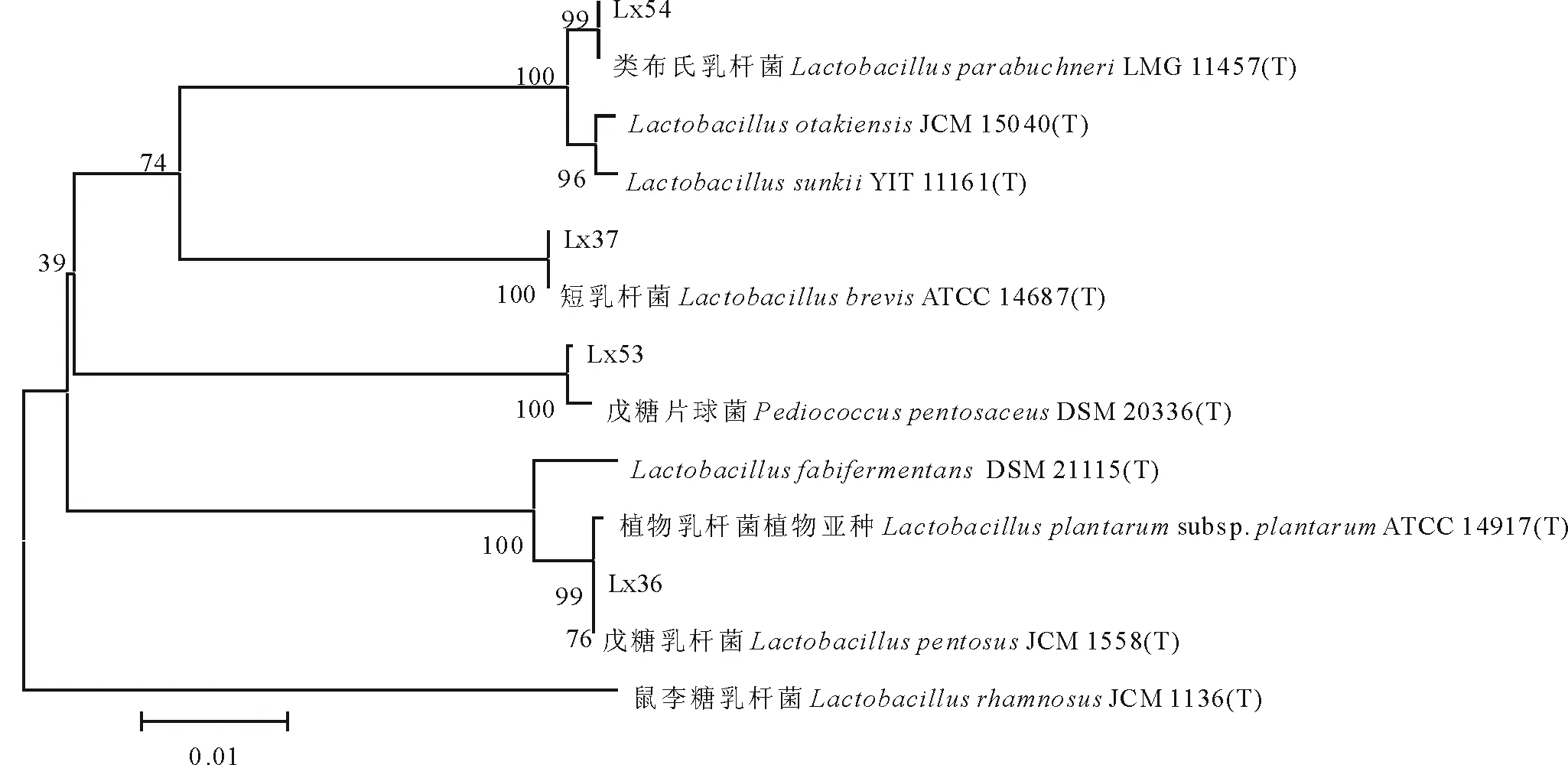
图1 基于 16S rDNA 序列分析结果的系统发育树

图2 乳酸菌生长曲线
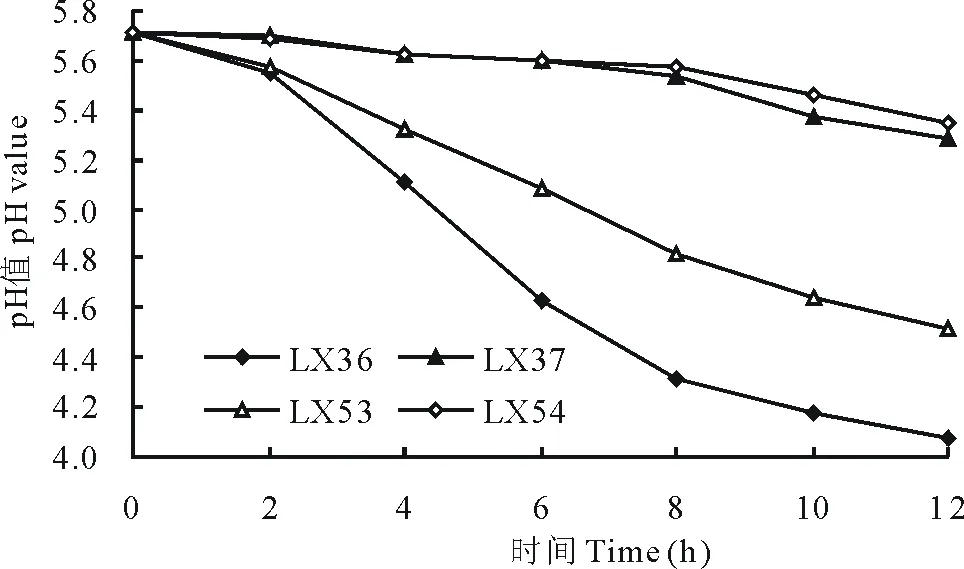
图3 乳酸菌产酸速率曲线
本研究对短芒大麦草青贮乳酸菌多样性研究在国内外尚属首例,通过MRS培养基从短芒大麦草青贮发酵体系分离得到4株乳酸菌,根据表型特征、生理生化特性初步鉴定3株属于乳杆菌属,1株属于片球菌属,杆菌较球菌丰富。通常情况下乳酸杆菌对酸的耐受性要高于乳酸球菌,当环境酸度较高时,乳酸球菌的生长受到抑制,活力降低、数量减少[9]。由于分离出的4株乳酸菌碳源发酵模式与模式菌株均存在差异,因此单纯利用表型相似性并不能把这些菌株鉴定到种的水平。16S rDNA序列分析既可以在种属水平上对细菌进行较为准确的鉴定,也可以对细菌亚种进行鉴定[15],经分析4株菌的16S rDNA序列与参考菌株的16S rDNA 序列相似性都在99%以上,因此Lx36鉴定为Lactobacilluspentosus,Lx37鉴定为Lactobacillusbrevis,Lx53鉴定为Pediococcuspentosaceus,Lx54鉴定为Lactobacillusparabuchneri。
乳酸菌是促使青贮饲料发酵的主要微生物,将其用作饲料青贮的生物添加剂,可有效地调节青贮料内微生物区系,抑制有害菌的活动[16-17],调控青贮发酵过程,从而提高青贮发酵品质。因此那些繁殖速度快,产酸、耐酸能力强的乳酸菌常被筛选出来用作发酵促进剂[18]。早期用作青贮添加剂的菌株大部分来自奶牛及乳产品[19],但是结果并不理想,而从青贮饲料中分离出的乳酸菌更宜适应青贮环境,从中筛选青贮用优良乳酸菌则为一种高效、快速的方法。通过研究短芒大麦草青贮饲料中分离出4株乳酸菌的生长特性、产酸特性以及耐酸性,发现戊糖乳杆菌Lx36为同型发酵乳酸菌,可以迅速繁殖,使酸性快速下降,并且耐酸,这些完全符合Whittenbury[20]、Wieringa和Beck[21]制定的乳酸菌剂筛选标准的一些核心观点。戊糖乳杆菌广泛存在于传统发酵蔬菜、发酵乳制品、发酵肉制品及醉鱼中[22-25],长期的食用历史使其被公认为具有发酵作用的安全菌[26],张想峰等[27]从新疆小芦苇青贮中分离出2株戊糖乳杆菌,发现其中1株具有较强的产酸能力,pH最低可达3.50, 是发酵过程中的主要产酸菌株,本试验结果与此一致。可见Lx36具有潜在的生产应用价值,适宜用作促发酵的青贮饲料发酵菌株。
4 结论
青贮发酵是体系中各种微生物相互作用的过程,微生物菌群的数量及变化直接影响青贮饲料发酵品质。短芒大麦草附生乳酸菌数量极少,因此单独青贮时最好加入适量乳酸菌剂以促进发酵,保证发酵完全。短芒大麦草青贮饲料中乳酸菌种类较丰富,共分离出4株乳酸菌,筛选得到的戊糖乳杆菌Lx36繁殖速度快、产酸能力强,同时表现出了较强的耐酸性,这一结果为其进一步开发用作青贮促发酵剂提供了理论依据。
[1] Sun Q Z.An excellent salt tolerance forage-Hordeumbrevisubulatum.Journal of Frage and Lifestock, 1996, (4):25-26.
[2] Wang B D.An excellent grass-Hordeumbrevisubulatum.China Pratacultural Science, 1987, 4(1):55-57.
[3] Ma M.Productivity and Nutrition Value of the Four Grasses[D].Lanzhou:Gansu Agricultural University, 2008.
[4] Yang Y, Shi C, Guo X S.Characterization and identification ofWeissellaspecies isolated fromKobresialittledaleigrowing in alpine meadows.Acta Prataculturae Sinica, 2014, 23(1):266-275.
[5] Du P.The Experimental Techniques in Dairy Microbiology[M].Beijing:China Light Industry Press, 2008.
[6] Ling D W, Dong X Z.The Experimental Techniques in Identification of Lactic Acid Bacteria[M].Beijing:China Light Industry Press, 1999.
[7] Duan Y, Tan Z, Wang Y,etal.Identification and characterization of lactic acid bacteria isolated from Tibetan Qula cheese.Journal of General and Applied Microbiology, 2008, 54(1):51-60.
[8] Zhang H J, Yu Z, Wang L,etal.Isolation and identification of lactic acid bacteria from silage and filtering of excellent strains.Acta Agrestia Sinica,2011, 19(1): 137-141.
[9] Buchanan R E, Glbboms N E.Bergey’s Manual of Systematic Bacteriology[M].Hong J H, Translation.Beijing:Science Press, 1986.
[10] Xu C C.Silage Science and Techonlogy[M].Beijing:Science Press, 2013.
[11] Si B W, Wang Z L, Sun Q Z,etal.Fermentation characteristics and changes of lactic acid bacteria isolated from ensilingLespedezahedysaroides.Pratacultural Science, 2012, 29(4):650-657.
[12] Kobayashi H, Cai Y, Uegaki R,etal.Microorganism composition, chemical composition and fermentation characteristics of the mixed sowing silage of timothy and orchardgrass at different cutting number.Nihon Chikusan Gakkaiho/Japanese Journal of Zootechnical Science, 2010, 81(3):345-352.
[13] Lin C J, Bolsen K K, Brent B E,etal.Epiphytic lactic acid bacteria succession during the pre-ensiling and ensiling periods of alfalfa and maize.Journal of Applied Bacteriology, 1992, 73(5):375-387.
[14] Zhang J G.Roles of biological additives in silage production and utilization.Research Advance in Food Science, 2002, 3:37-46.
[15] Woo P C, Lau S K, Teng J L,etal.Then and now:use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories.Clin Microbiol Infect, 2008, 14(10):908-934.
[16] Cai Y M, Kumai S, Liao Z,etal.Effect of lactic acid bacteria inoculants on fermentative quality of silage.Journal of Integrative Agriculture, 1995, 28(2):73-82.
[17] Cai Y M, Benno Y, Ogawa M,etal.Effect of applying lactic acid bacteria isolated from forage crops on fermentation characteristics and aerobic deterioration of silage.Journal of Dairy Science, 1999, 82(3):520-526.
[18] Seale D R.Bacterial inoculants as silage additives.Journal of Applied Bacteriology, 1986, 61:9-26.
[19] Moon N J, Ely L O, Sudweeks E M.Fermentation of wheat, corn, and alfalfa silages inoculated withLactobacillusacidophilusandCandidasp.at ensiling.Journal of Dairy Science, 1981, 64(5):807-813.
[20] Whittenbury R.An Investigation of the Lactic Acid Bacteria[D].UK:University of Edinburgh, 1961.
[21] Wieringa G W, Beck T.Investigations on the use of cultures of lactic acid bacteria in the preparation of silage in small containers.1.Obtaining activeLactobacilluscultures for inoculation trials.Das Wirtschaftseigene Futter, 1964, 10:34-44.
[22] Wu R,Tian H T, Sun J L,etal.Isolation, identification and fermentation characteristics study of lactic acid bacteria from picking vegetable.Food Research and Development, 2009, 30(2):51-54.
[23] Yang S Z, Zhang H X, Shi S,etal.Isolation, screening and identification of predominant lactic acid bacteria in salted duck.Food Science, 2010, 31(7):242-246.
[24] Guo L D, Wang X, Du P,etal.Study on characteristics of lactic acid bacteria isolated from traditional indigenous dairy products.Food Science, 2006, 27(3):60-64.
[25] Tang S, Liu Z W.Isolation and identification of microbes from vinasse fish.China Brewing, 2010, (12):120-123.
[26] Guo B H.Research trends and dynamics of beneficial lactic acid bacteria.China Dairy, 2001, (6):21-24.
[27] Zhang X F, Ainiwaer A, Mairemunisha W,etal.Isolation and identification ofLactobacillusfrom Xinjiang small reed silage.Xinjiang Agricultural Sciences, 2009, 46(6):1327-1331.
参考文献:
[1] 孙启忠.优良耐盐牧草-野大麦.草与畜杂志, 1996, (4):25-26.
[2] 王比德.优良禾草-野大麦.中国草业科学, 1987, 4(1):55-57.
[3] 马鸣.4种禾本科牧草生产性能及营养价值研究[D].兰州:甘肃农业大学, 2008.
[4] 杨杨, 石超, 郭旭生.高寒草甸魏斯氏乳酸菌的分离鉴定及理化特性研究.草业学报, 2014, 23(1):266-275.
[5] 杜鹏.乳品微生物学实验技术[M].北京:中国轻工业出版社, 2008.
[6] 凌代文, 东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社, 1999.
[8] 张慧杰, 玉柱, 王林, 等.青贮饲料中乳酸菌的分离鉴定及优良菌株筛选.草地学报, 2011, 19(1):137-141.
[10] 徐春城.现代青贮理论与技术[M].北京:科学出版社, 2013.
[11] 司丙文, 王宗礼, 孙启忠, 等.尖叶胡枝子青贮微生物数量变化及发酵特性.草业科学, 2012, 29(4):650-657.
[16] 蔡义民, 熊井清雄, 廖芷, 等.乳酸菌剂对青贮饲料发酵品质的改善效果.中国农业科学, 1995, 28(2):73-82.
[22] 吴蕊, 田洪涛, 孙纪录, 等.泡菜中乳酸菌优良菌株的分离鉴定及发酵性能的研究.食品研究与开发, 2009, 30(2):51-54.
[23] 杨士章, 张焕新, 施帅, 等.板鸭中优势乳酸菌的分离、筛选及鉴定.食品科学, 2010, 31(7):242-246.
[24] 国立东, 王欣, 杜鹏, 等.传统乳制品中乳酸菌的分离及性能研究.食品科学, 2006, 27(3):60-64.
[25] 唐思, 刘章武.醉鱼中菌种的分离筛选与鉴定研究.中国酿造, 2010, (12):120-123.
[26] 郭本恒.有益乳酸菌的研究趋势与动态.中国乳业, 2001, (6):21-24.
[27] 张想峰, 艾尼瓦尔·艾山, 买热木尼沙·吾甫尔, 等.新疆小芦苇青贮中乳酸杆菌的分离鉴定.新疆农业科学, 2009, 46(6):1327-1331.
Microbial characteristics ofHordeumbrevisubulatumsilage and screening for lactic acid bacteria with high fermentation performance
TAO Ya1,2, LI Feng1, GAO Feng-Qin1,2, SUN Qi-Zhong1,2*
1.GrasslandResearchInstitute,ChineseAcademyofAgriculturalScience,Huhhot010010,China; 2.KeyLaboratoryofGrasslandResourcesandUtilization,MinistryofAgriculture,Huhhot010010,China
A study has been undertaken to investigate the microbial community structure, microorganism populations and diversity of lactic acid bacteria inHordeumbrevisubulatumsilage.Lactic acid bacteria, coliform bacteria, aerobic bacteria, yeast and mold were isolated and counted by means of selective media.Lactic acid bacteria strains were identified by morphological observation, physiological and biochemical characteristics and partial 16S rDNA gene sequences.In order to assist the development of beneficial microorganisms for animal feed, the lactic acid bacteria strains with high fermentation performance were screened based on growth curves and their ability to produce and resist acid.The results showed that microorganism populations change in different ways through the fermentation process.Lactic acid bacteria populations increased from 0 to 4.00×108cfu/g FM and yeast populations grew from 8.50×105to 1.02×108cfu/g FM, whereas coliform bacteria, aerobic bacteria and mold populations did not change significantly.Four lactic acid bacteria strains were isolated fromH.brevisubulatumsilage which were identified at Lx36 isolation asLactobacilluspentosus, at Lx37 isolation asL.brevis, at Lx53 isolation asPediococcuspentosaceusand at Lx54 isolation asL.parabuchneri.Lx36 was screened out for high fermentation performance because it ceased to grow after 20 hours of cultivation, with an OD value of 4.21.The pH value of MRS broth (the bacterial growth medium) was only 4.08 after 12 hours of Lx36 cultivation, and the strain can survive in MRS broth with a pH of 3.0.These results indicate that silage fermentation is a process of microorganism interaction and that silage quality is directly influenced by the changing character of microorganism populations.Lactic acid bacteria species inH.brevisubulatumsilage were relatively abundant.L.pentosusscreened with a high ability to reproduce and to produce and resist acid, suggesting its potential value for practical applications.
Hordeumbrevisubulatum; silage; microbial characteristics; lactic acid bacteria
10.11686/cyxb2015138
http://cyxb.lzu.edu.cn
2015-03-11;改回日期:2015-05-20
中央公益性行业(农业)科研专项经费项目(201203042)和中国农业科学院创新工程牧草栽培与加工利用(CAAS-ASTIP-IGR 2015-02)资助。
陶雅(1982-),女,内蒙古呼和浩特人,助研,硕士。E-mail:taoya2001@126.com
*通信作者Corresponding author.E-mail:sunqz@126.com
陶雅, 李峰, 高凤芹, 孙启忠.短芒大麦草青贮微生物特性研究及优良乳酸菌筛选.草业学报, 2015, 24(12):66-73.
TAO Ya, LI Feng, GAO Feng-Qin, SUN Qi-Zhong.Microbial characteristics ofHordeumbrevisubulatumsilage and screening for lactic acid bacteria with high fermentation performance.Acta Prataculturae Sinica, 2015, 24(12):66-73.
