轮作对土壤养分、微生物活性及细菌群落结构的影响
2015-06-01陈丹梅陈晓明梁永江霍新建张长华段玉琪杨宇虹袁玲
陈丹梅,陈晓明,梁永江,霍新建,张长华,段玉琪,杨宇虹,袁玲*
(1.西南大学资源环境学院,重庆400716;2.贵州省遵义市烟草公司,贵州 遵义 563000;3.云南省烟草农业科学研究院,云南 昆明 650031)
轮作对土壤养分、微生物活性及细菌群落结构的影响
陈丹梅1,陈晓明2,梁永江2,霍新建2,张长华2,段玉琪3,杨宇虹3,袁玲1*
(1.西南大学资源环境学院,重庆400716;2.贵州省遵义市烟草公司,贵州 遵义 563000;3.云南省烟草农业科学研究院,云南 昆明 650031)
试验选择云南省具有代表性的烤烟-休闲-玉米(T-F-M)、烤烟-油菜-玉米(T-C-M)、烤烟-油菜-水稻(T-C-R)和烤烟-苕子-水稻(T-V-R)等4种轮作模式,通过测定土壤养分、酶活性及16S rDNA序列分析,研究了轮作对土壤养分、微生物活性及细菌群落结构的影响。结果表明,经过16年的不同轮作种植后,土壤pH值变化于6.2~7.1之间,有机质和有效氮、磷、钾提高或无显著变化,说明在高强度轮作种植条件下,辅以秸秆还田或冬季休闲均可保持或提高土壤肥力和生产力。土壤微生物量碳氮、蔗糖酶、脱氢酶、脲酶、磷酸酶和过氧化氢酶活性均以T-V-R最高,说明土壤生态环境改善,促进微生物繁衍,数量增加,活性增强。土壤细菌的16S rDNA读数依次为5395(T-F-M)、5864(T-C-M)、5528(T-C-R)和6614(T-V-R),分别代表885,973,969和987种(属)类的细菌,归属于变形菌、绿弯菌、放线菌、酸杆菌、拟杆菌等31个门,其中变形菌门的数量最多,占总量的24.69%~32.49%。此外,在4种轮作处理土壤中,前5种门类的细菌相同,15种优势菌株有6种(属)一样,均有较高的丰富度,但也因种植模式不同而变化,说明土壤是决定细菌组成的基本要素,种植模式可不同程度地改变它们的种群结构。从土壤有机质、有效养分、酶活性、微生物量碳氮、细菌种群结构和多样性等方面看,T-V-R 最佳,该种植模式具有潜在的推广应用价值。
轮作;养分;土壤酶;细菌;多样性
连续种植同一或近缘作物容易发生“连作障碍”。如土壤养分异常积累或过度消耗,病原微生物迅速繁衍,化感物质积累,土壤微生物种群结构失衡,作物产量品质降低等[1-2]。玉米(Zeamays)连作降低土壤有益微生物数量,增加真菌的相对比例,频繁发生作物病害[3]。西瓜(Citrulluslanatus)根系能分泌酚类物质, 产生自毒作用,抑制生长,降低产量[4]。烤烟(Nicotianatabacum)长期连作,提高黑胫病和赤星病的发病率,降低烟叶产量和质量[5]。相反,轮作能合理利用土壤养分,改变土壤理化和生物学性质,保持地力,增加产量,提高经济效益[6]。但是,轮作模式不同,对土壤理化和生物学性质的影响也不一样。连续5年实施水稻(Oryzasativa)-油菜(Brassicacampestris)轮作,土壤有机质含量显著高于水稻-小麦(Triticumaestivum)和水稻-黑麦草(Loliumperenne)轮作[7]。从土壤酶活性看,采用草莓(Fragariaananassa)-休闲种植模式的土壤蔗糖酶活性最高,草莓-水稻种植模式次之,草莓-甜瓜(Cucumismelo)轮作最低,最高比最低提高了94.1%[8];但在草莓-休闲种植的土壤中,酸性磷酸酶和过氧化氢酶活性分别比草莓-甜瓜种植模式降低22.9%和13.5%。在我国东北黑土上,实施黄瓜(Cucumissativus)连作、小麦-黄瓜和毛苕子(Viciavillosa)-黄瓜轮作,轮作显著增加根际细菌种类,减少结瓜后期的真菌种群,尤以毛苕子-黄瓜轮作最为显著[9]。
微生物是土壤的重要组成部分,可释放多种酶类,参与土壤有机质降解、腐殖质合成和养分循环等生物化学过程[10]。细菌是数量最多和种群最丰富的土壤微生物,人们通常采用分离培养、磷脂脂肪酸和PCR-DGGE等常规和分子生物学技术研究土壤微生物,但获得的细菌数量种类有限,不能充分反映土壤细菌多样化的组成和种群结构。454高通量测序技术是在PCR扩增的基础上,分析细菌16S rDNA和真菌18S rDNA序列,与基因库中的已知序列进行对比,鉴别微生物种(属)类,具有适用范围广、灵敏性高、可靠性好,同时检测活性和休眠微生物等特点[11]。
云南省是我国烤烟主产区,烤烟轮作比例达80%以上,烟地夏季主要轮作玉米和水稻,分别占种植面积的64.7%和27.6%,冬季一般种植油菜和绿肥或休闲,轮作年限一般为2~3年[12]。选择科学的轮作模式,减轻连作障碍,是保持整个农业生产健康和持续发展的重要措施[13],但相关研究较少。为了深入了解土壤细菌的数量、活性、组成结构和多样性,建立科学合理的轮作模式,本研究采用常规方法和454高通量测序技术,研究了云南省烟区主要轮作模式对土壤养分、微生物活性与细菌群落结构的影响。
1 材料与方法
1.1试验地概况
云南省烟草农业科学研究院试验基地(N 24°14′,E 102°30′),海拔1680 m,年均温度15.9℃,年降雨量918 mm,雨季(4-9月)降雨量占全年的79.5%,年日照时数2072 h。供试土壤为云南省典型、具有代表性的砂质红壤,pH 6.4,有机质10.70 g/kg,全氮0.54 g/kg,全磷0.11 g/kg,全钾6.43 g/kg,有效氮82.0 mg/kg,有效磷 9.0 mg/kg,有效钾160.0 mg/kg。
1.2试验处理
试验始于1998年,设置烤烟-休闲-玉米(flue cured tobacco-fallowness-maize, T-F-M)、烤烟-油菜-玉米(flue cured tobacco-canola-maize, T-C-M)、烤烟-油菜-水稻(flue cured tobacco-canola-rice, T-C-R)和烤烟-苕子-水稻(flue cured tobacco-vetch-rice, T-V-R)4种轮作模式。小区面积28 m2,重复3次,随机区组排列。烤烟、玉米和水稻5月初移栽,苕子和油菜秋末播种。根据当地大田生产情况,油菜施用纯氮90 kg/hm2,P2O530 kg/hm2;玉米和水稻施用纯氮112.5 kg/hm2,P2O540 kg/hm2;苕子施用纯氮75 kg/hm2。此外,水稻、玉米和油菜秸秆全部切碎还田;绿肥收割多次,未彻底收割的残桩全部翻压入土。在烤烟种植季节,基肥由N∶P2O5∶K2O=10∶10∶25烤烟专用肥提供,施氮量占施肥总量的70%;剩余30%的氮素由烤烟专用追肥(N∶P2O5∶K2O=10∶0∶25)提供,在移栽后7~10 d和30~40 d均分两次穴施。在玉米、油菜及苕子种植季节,化学氮磷分别由尿素和过磷酸钙提供。其中,玉米和油菜70%的氮和全部磷肥作基肥,剩余30%的氮分别在油菜云苔期和玉米大喇叭口期作为追肥穴施,苕子全施基肥。
1.3土样采集与分析
在2014年油菜和苕子旺长期,采集0~20 cm的耕层土壤(包括休闲处理),拣去杂物,取部分土壤晾干进行常规分析。采用电位法测定土壤pH;重铬酸钾容量法测定土壤有机质;碱解扩散法测定土壤碱解氮;NaHCO3提取法测定土壤有效磷;NH4Ac-火焰光度法测定土壤有效钾[14]。土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,酶活性以24 h后1 g土壤中生成的葡萄糖(glucose)mg数表示[15];磷酸酶活性用磷酸苯二钠比色法测定,酶活性以24 h后1 g土中释放的酚mg数表示[15];脲酶活性用苯酚钠-次氯酸钠显色法测定,酶活性以24 h后1 g土中NH4+-N的mg数表示[15];过氧化氢酶活性采用高锰酸钾滴定法测定,酶活性以每h内1 g土消耗0.1 mol/L KMnO4的mL数表示[15];脱氢酶活性采用TTC比色法测定,酶活性以24 h后1 g土中TPF(三苯基甲月替)的mg数表示[15]。另取部分土壤立即液氮冷冻备测微生物碳氮量和细菌16S rRNA序列。微生物碳氮量采用氯仿熏蒸-0.5 mol/L K2SO4提取,用K2Cr2O7氧化法测碳和腚酚蓝比色法测氮[16]。
在上海美吉生物科技有限公司进行细菌16S rDNA测序,参照454高通量测序方法,提取、扩增、纯化、定量和均一化细菌16S rDNA,利用Roche Genome Sequencer FLX测序平台进行测序[17]。然后,对有效序列进行去杂、修剪、除嵌合体序列等过滤处理,得到优化序列,通过聚类分析形成分类单元(operational taxonomic units,OTUs),采用BLAST程序对比GenBank(http://ncbi.nlm.nih.gov)中的已知序列,根据97%的相似度确定16S rDNA序列所代表的细菌种(属)类。
1.4数据处理
利用土壤细菌属(种)数(OTUs)和16S rDNA序列数(Reads)计算土壤细菌的种群特征值,包括多样性指数和优势度指数。
Shannon-Wiener多样性指数(H)的计算公式为:
Simpson优势度指数(D)的计算公式为:
其中,Sobs为获得OTUs的总数量;ni为细菌i的OTUs数量;N为获得细菌的总数量[18-19]。
细菌丰富度为某种细菌的16SrDNA读数占细菌16SrDNA总读数的百分数[20-21]。
1.5统计分析
用Excel进行基本计算,SPSS16.0软件进行统计分析,差异显著性水平为P<0.05。
2 结果与分析
2.1土壤pH、有机质与有效养分
在不同种轮作处理的土壤中,pH、有机质和有效养分的含量显著提高或无明显变化(表1)。与原始土壤相比,T-C-M和T-F-M显著提高土壤pH,从pH6.4提高到pH6.9~7.1,但T-C-R和T-V-R对土壤pH无显著影响。T-C-M、T-C-R和T-V-R不同程度地提高了土壤有机质含量,增幅变化于16.26%~45.14%之间,以T-V-R最为显著。T-C-R和T-V-R的有效氮较原始土壤分别提高10.0%和32.5%;在4种轮作处理的土壤中,有效磷含量是原始土壤的2.13~4.67倍;T-F-M使土壤有效钾增加64.06%。
2.2土壤酶活性
土壤酶活性因轮作模式不同而异(表2)。在T-V-R处理的土壤中,蔗糖酶、磷酸酶、脱氢酶、过氧化氢酶和脲酶活性最高。在T-F-M、T-C-M和T-C-R处理的土壤中,蔗糖酶活性无显著差异;脲酶活性的变化趋势同蔗糖酶。在T-C-M处理的土壤中,磷酸酶和脱氢酶活性最低,但脱氢酶活性与T-C-R处理无显著差异。在T-F-M和T-C-R处理的土壤中,过氧化氢酶活性无显著差异,但显著低于T-C-M和T-V-R。

表1 不同轮作模式对土壤pH、有机质和有效养分的影响Table 1 Selected properties of the soil under different rotation treatments
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note:In each column, different small letters indicate significant differences among cropping treatments atP<0.05, the same below.

表2 不同种植模式对土壤酶活性的影响Table 2 Influence of rotation modals on enzyme activities in soil
* 蔗糖酶活性Sucrase activity:mg 葡萄糖Glucose/(g·h);磷酸酶活性Phosphatase activity:mg pNP/(g·h);脱氢酶活性Dehydrogenase activity:mg TPF/(g·h);过氧化氢酶活性Catalase activity:mL(0.1 mol/L K2MnO4)/(h·g);脲酶活性Urease activity:mg NH4+-N/(g·h).
2.3微生物生物量
由图1可知,微生物量碳T-V-R处理最高,达到154.70 mg/kg;T-C-M和T-C-R次之;T-F-M最低,仅56.33 mg/kg。但是,微生物量氮的变化趋势与微生物量碳有所不同,T-V-R最高,T-C-M和T-F-M次之,T-C-R最低。在4种不同轮作模式处理中,微生物碳氮比差异显著。
2.4土壤细菌
2.4.1稀释曲线 随机抽取测序样品中的16S rDNA读数(reads),以细菌种(属)类数(OTUs)为纵坐标,16S rDNA读数为横坐标,获得稀释曲线(图2)[22]。结果表明,抽样读数大约在1500以下时,细菌种(属)类数迅速增加;读数在1500~4000之间,细菌种(属)数缓慢增加;读数超过4000之后,其种(属)类数的增长逐渐趋于平缓。此外,细菌稀释曲线的最高值因轮作处理不同而异,T-V-R最高,T-C-M和T-C-R次之,T-F-M最低。

图1 种植模式对土壤微生物量碳氮的影响

图2 不同轮作处理的土壤中细菌稀释性曲线
2.4.2细菌门类 在T-F-M、T-C-M、T-C-R和T-V-R处理的土壤中,细菌16S rDNA读数依次为5395,5864,5528和6614,分别代表885,973,969和987种(属)类的细菌,其中62.21%~69.72%的细菌读数小于5。土壤细菌分别归属于变形菌(Proteobacteria)、绿弯菌(Chloroflexi)、放线菌(Actinobacteria)、酸杆菌(Acidobacteria)、拟杆菌(Bacteroidetes)、浮霉菌(Planctomycetes)、芽单胞菌(Gemmatimonadetes)及厚壁菌(Firmicutes)等31个门,约有1%的细菌尚待确定所归属的门类(表3,图3)。其中,变形菌门的丰富度最高,占总量的24.69%~32.49%,平均29.51%。此外,在各处理的土壤中,前5种门类的细菌相同,依次为变形菌门、绿弯菌门、放线菌门、酸杆菌门和拟杆菌门,其丰富度因种植模式不同而异。
2.4.3优势菌株 在各处理的土壤中,前15种优势菌株的丰富度合计占总量的45.91%~48.58%。其中,以两种待定细菌(unclassified bacteria)的丰富度最高,平均占总量的26.68%和11.52%;第15种优势菌株的丰富度占总量的0.24%~0.44%。
表3 在不同轮作土壤中,15种优势细菌菌属(株)的丰富度
Table3 The abundance of top 15 predominant bacteria in soil with different rotation treatments


图3 不同种植处理的土壤中,前10个门类细菌16S rDNA序列数及其丰富度
由表3可知,在15种优势菌株中,待定细菌-1、待定细菌-2、酸杆菌、芽单胞菌、放线菌和绿弯菌共存于4种轮作模式的土壤中。其中,待定细菌-1和待定细菌-2的丰富度合计高达42.62%~45.68%,且不因轮作处理而发生改变;酸杆菌、放线菌和芽单孢菌属于已鉴定的前5种优势菌株。此外,伯克氏菌(Burkholderiaceae)共存于T-F-M、T-C-M和T-V-R处理的土壤;黏球菌、α-变形菌和酸微菌是T-F-M、T-C-R和T-V-R的共有细菌;β-变形菌同时存在于T-C-M、T-C-R和T-V-R处理的土壤。
在15种优势菌株中,梭菌仅发现于T-F-M处理的土壤;链霉菌、终极腐霉菌和黄杆菌为T-C-M处理土壤的独有菌株;在T-C-R处理的土壤中,独有菌株包括变形菌、假单胞菌、浮霉状菌和根瘤菌;在T-V-R处理的土壤中,中慢生型天山根瘤菌和贪噬菌为独有菌株。
2.4.4细菌群落特征值 在T-V-R的土壤中,细菌多样性指数最高,达到3.925;T-C-M次之,为3.756;T-F-M和T-C-R最低。但是,优势度指数T-F-M最高,达0.711,T-V-R最低,仅0.583(表4)。
3 讨论
经过16年的轮作种植,有机质和有效养分提高或无显著变化,土壤pH变化于6.2~7.1之间,仍然在粮、油、经、蔬等多种作物种植的适合范围之内,说明在高强度轮作种植条件下,辅以秸秆还田或冬季休闲均可保持或提高土壤肥力和生产力。此外,在各轮作处理的土壤中,有效磷高达19.2~42.0 mg/kg,是原始土壤 9.0 mg/kg的2.13~4.67倍,可以适量减施磷肥。综合土壤pH、有机质和有效养分的变化,以T-V-R种植模式最佳。
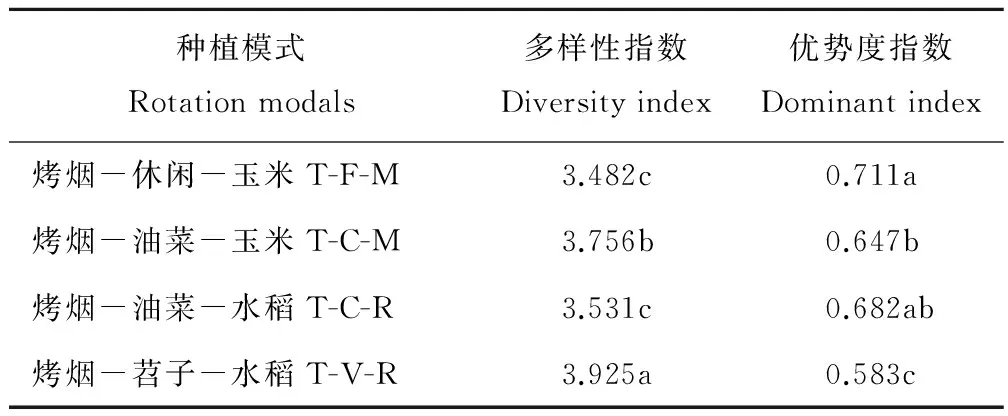
表4 各轮作处理土壤细菌群落特征值Table 4 Characteristic values of bacterial communities in soil under different rotation treatments
土壤有机质是微生物的碳源和氮源[23]。秸秆还田和轮作向土壤提供大量的、丰富多样的有机质,可满足不同微生物对碳源和养分的需要。在实施T-V-R轮作的过程中,水旱轮作,嫌/好气交替,创造了适合多种微生物繁衍的不同土壤环境;烤烟、水稻和苕子的近缘性小,有机成分差异较大,有益于不同微生物的繁殖生长。因此,T-V-R土壤中的微生物量碳氮最高,16S rDNA读数最大,细菌种(属)类最多。从土壤酶活性看,T-V-R轮作的蔗糖酶、脱氢酶、磷酸酶、过氧化氢酶和脲酶活性最强,推测微生物分泌的酶较多[24],土壤酶活性强促进有机质分解、腐殖质合成、养分转化、生物固氮、污染物清除等[25]。
在不同轮作处理的土壤中,土壤微生物量碳氮比高低相差约2.5倍,意味着它们的群落结构也发生了显著变化。本文采用454高通量测序方法,揭示了细菌从门类到种(属)的组成、优势菌株、丰富度和多样性特征等。结果表明,稀释性曲线呈迅速增加-缓慢增加-逐渐平缓的变化趋势,说明16S rDNA的样本量和测序数据合理,准确地反映了样本中的细菌数及组成情况;稀释曲线的峰值高低不一,意味着轮作处理影响细菌的多样性。一般认为,多样性指数表示生物群落中的物种多寡,数值愈大表示群落中的物种越丰富;优势度指数越大,生物群落内的奇异度越高,优势种群突出[26]。在健康稳定的生态环境中,生物多样性指数较高,优势度指数较低。T-V-R显著提高细菌群落的多样性指数,但降低优势度指数。因此,T-V-R处理的土壤生态环境较好,有益于细菌生长繁殖,数量增多,种群增加,密度增大。此外,在不同种植模式的土壤中,细菌的丰富度因轮作和它们的门、属、种不同而异,存在885~987种(属)的细菌,远远超过了目前的常规培养、磷脂脂肪酸和PCR-DGGE能达到的水平。因此,更能深入研究土壤细菌的组成和群落结构。值得注意的是,16S rDNA读数和细菌OTUs以T-V-R最高,T-F-M最低,说明T-V-R土壤中的细菌数和种(属)类最多。
在4种轮作处理的土壤中,前5种门类的细菌相同,但因种植模式不同而影响其丰富度。在前15种优势细菌中,有 6种(属)共同存在于各轮作处理的土壤中,均有较高的丰富度,也因种植模式不同而发生变化;其中待定细菌-1和待定细菌-2的丰富度合计高达42.62%~45.68%,居绝对优势地位。说明土壤是决定细菌组成的基本要素,种植模式可不同程度地改变细菌的种群结构。从优势菌株的功能看,丰富度最高的待定细菌-1和待定细菌-2尚待鉴定分类,需要明确其生物学功能;酸杆菌广泛存在于自然界的各种环境中,具有丰富的遗传和代谢多样性,对稳定生态系统贡献极大[27-28];放线菌也是自然界分布最广泛的微生物类群之一,参与土壤有机质转化,土壤结构形成,植物生长素和抗生素分泌[29];绿弯菌是活性污泥的组成成分之一[30],生活在好氧环境下,有利于土壤中有毒物质的降解。除T-C-R之外,其他3种轮作处理的土壤都存在伯克氏菌,且丰富度较高,它们能分泌生长素、ACC脱氨酶和铁载体,溶解矿物态无机磷,促进番茄(Lycopersiconesculentum)、美洲商陆(PhytolaccaAmericana)和籽粒苋(Amaranthushypochondriacus)生长,提高植物抗(耐)重金属的能力[31-32]。此外,T-V-R处理的土壤中还存在贪噬菌和中慢生型天山根瘤菌,前者参与有机磷、硝基酪氨酸、除草剂、三氯乙烯等的生物降解[33-34],中慢生型天山根瘤菌明显与苕子结瘤固氮有关。因此,优势细菌的作用与土壤功能密切相关。
总之,不同轮作方式均有益于保持或提高土壤肥力和土地生产力。从土壤有机质、有效养分、酶活性、微生物量、细菌种群结构和多样性等方面看,T-V-R最佳,是值得推广的一种种植模式。
[1] Wang F, Li S G, Xu F H,etal.The research progress on mechanism of continuous cropping obstacle.Chinese Soil and Fertilizer, 2013, 5:6-12.
[2] Yang J, Xie Y Z, Wu X D,etal.Stoichiometry characteristics of plant and soil in alfalfa grassland with different growing years.Acta Prataculturae Sinica, 2014, 23(2):340-345.
[3] Xin H Q, Xiao Z W, Yan J Z,etal.Effect of continuous cropping of maize on soil microbes and main soil nutrients.Pratacultural Science, 2011, 28(10):1777-1780.
[4] Zhang X H, Zhao Y J.Research progress on watermelon allelopathy.China Vegetables, 2013, 24:10-15.
[5] Jin Y, Yang Y H, Duan Y Q,etal.Effect of rotational cropping and continuous cropping on yield and quality of flue-cured tobacco.Southwest China Journal of Agricultural Science, 2004, 17:267-271.
[6] Wang Y Q.Study on rotation.Modern Agricultural Science and Technology, 2010, 2:108.
[7] Wang X H.Effect of different rotation systems on rice soil fertility.Tillage and Cultivation, 2003, 6:9-10.
[8] Yang X T, Zhou C, Li J H,etal.Effect of cropping system on yield of strawberry and soil biological property under plastic greenhouse condition.Chinese Journal of Eco-Agriculture, 2010, 18(2):312-315.
[9] Yu G B, Wu F Z, Zhou X G.Effects of rotations of cucumber with wheat and hairy vetch on soil micro-ecological environment.Acta Pedologica Sinica, 2011, 48(1):175-184.
[10] Kennedy A C, Smith K L.Soil microbial diversity and the sustainability of agricultural soils.Plant and Soil, 1995, 170:75-86.
[11] Yan S P, Yang R H, Leng S J,etal.High-fluxed DNA sequencing technology and its application in agricultural science research.Chinese Agricultural Science Bulletin, 2012, 28(30):171-176.
[12] Li T F, Wang S H, Wang B,etal.Current situation and suggestion to Yunnan tobacco rotation system.Tobacco Agricultural Science, 2006, 2:211-217.
[13] Yu F Y, Li Y J.Effect of rotation on soil fertility.Science and Technology Communication, 2011, 16:60.
[14] Yang J H.Soil Agrochemical Analysis and Environmental Monitoring[M].Beijing:China Press, 2008.
[15] Guan S Y.Soil Enzyme and Its Research Method[M].Beijing:Agriculture Press, 1986.
[16] Frostegard A, Tunlid A, Baat I E.Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals.Applied and Environmental Microbiology, 1993, 59:3605-3617.
[17] Herlemann Danie P R, Lundin D, Labrenz M.Metagenomic assembly of an aquatic representative of the verrucomicrobial class spartobacteria.MBIO, 2013, 4:1157-1169.
[18] Krebs C J.Ecological Methodology[M].New York:Harper Collins Publish, 1989.
[19] Patrick D S, Dirk G, Sarah L W.Reducing the effects of PCR amplification and sequencing artifacts on 16S rDNA-based studies.PLoS ONE(e27310), 2011, 6(12):1-14.
[20] Roesch L F W, Fulthorpe R R, Riva A,etal.Pyrosequencing enumerates and contrasts soil microbial diversity.The ISME Journal, 2007, (4):283-290.
[21] Lim Y M, Kim B K, Kim C,etal.Assessment of soil fungal communities using pyrosequencing.The Journal of Microbiology, 2010, 48(3):284-289.
[22] Amato K R, Yeoman C J, Kent A,etal.Habitat degradation impacts black howler monkey (Alouattapigra) gastrointestinal microbiomes.The ISME Journal, 2013, 7:1344-1353.
[23] Katarina H.Soil microbial community structure in relation to vegetation management on former agricultural land.Soil Biology & Biochemistry, 2002, 34(9):1299-1307.
[24] Shan G L, Chu X H, Luo F C,etal.Influence of exclosure period on soil microorganism and its enzyme activity in typical steppe.Grassland and Turf, 2012, 32(1):1-6.
[25] Nishino S F, Spain J C.Biodegradation of 3-nitrotyrosine byBurkholderiasp.strain JS165 andVariovoraxparadoxusJS171.Applied and Environmental Microbiology, 2006, 72(2):1040-1044.
[26] Hunter P R, Gaston M A.Numerical index of the discriminatory ability of typing systems-An application of Simpsons index of diversity.Journal of Clinical Microbiology, 1988, 26(11):2465-2466.
[27] Wise M G, Mcarthur J V, Shimkets L J.Bacterial diversity of a carolina bay as determined by 16S rRNA gene analysis:confirmation of novel taxa.Applied and Environmental Microbiology, 1997, 63(4):1505-1514.
[28] Barns S M, Takala S L, Kuske C R.Wide distribution and diversity of members of the bacterial kingdomAcidobacteriumin the environment.Applied and Environmental Microbiology, 1999, 65(4):1731-1737.
[29] Zhu Z X.Screening and Identification of Actinomyces from Soil and Study of Their Metabolites with Bioactivity[D].Haerbin:Northeast Agricultural University, 2011.
[30] Roller C, Wagner M, Amann R,etal.In situ probing of gram-positive bacteria with high DNA G+C content using 235-ribosomal-RNA-targeted oligonucleotides.Microbiology-UK, 1994, 140(10):2849-2858.
[31] Guo J K, Tang S R, Ju X H,etal.Effects of inoculation of a plant growth promoting rhizobacteriumBurkholderiasp.D54 on plant growth and metal uptake by a hyperaccumulatorSedumalfrediiHance grown on multiple metal contaminated soil.World Journal of Microbiology & Biotechnology, 2011, 27(1):2835-2844.
[32] Liao S Q, Guo J K, Wang F L,etal.The physiological and biochemical response ogP.AmericanaLinn.AndA.CrenentusL.to inoculation withBurkholderiasp.and its effect to Cs accumulation.Acta Scientiae Circumstantiae, 2012, 32(1):213-223.
[33] Futamata H, Nagano Y, Watanabe K,etal.Uniquekinetic properties of phenol-degradingVariovoraxstrains responsible for efficient trichloroethylene degradation in a chemostat enrichment culture.Applied and Environmental Microbiology, 2005, 71(2):904-911.
[34] SØrensen S R, Albers C N, Aamand J.Rapid mineralization of the phenyl urea herbicide diuron byVariovoraxsp.strain SRS16 in pure culture and within a two-member consortium.Applied and Environmental Microbiology, 2008, 74(8):2332-2340.
参考文献:
[1] 王飞, 李世贵, 徐凤花, 等.连作障碍发生机制研究进展.中国土壤与肥料, 2013, 5:6-12.
[2] 杨菁, 谢应忠, 吴旭东, 等.不同种植年限人工苜蓿草地植物和土壤化学计量特征.草业学报, 2014, 23(2):340-345.
[3] 邢会琴, 肖占文, 闫吉智, 等.玉米连作对土壤微生物和土壤主要养分的影响.草业科学, 2011, 28(10):1777-1780.
[4] 张小红, 赵依杰.西瓜化感作用研究进展.中国蔬菜, 2013, 24:10-15.
[5] 晋艳, 杨宇虹, 段玉琪, 等.烤烟轮作、连作对烟叶产量质量的影响.西南农业学报, 2004, 17:267-271.
[6] 王玉琴.关于轮作的探讨.现代农业科技, 2010, 2:108.
[7] 王先华.稻田不同轮作方式对培肥地力的作用.耕作与栽培, 2003, 6:9-10.
[8] 杨祥田, 周翠, 李建辉, 等.不同轮作方式下大棚草莓产量及土壤生物学特性.中国生态农业学报, 2010, 18(2):312-315.
[9] 于高波, 吴凤芝, 周新刚.小麦、毛苕子与黄瓜轮作对土壤微生态环境及产量的影响.土壤学报, 2011, 48(1):175-184.
[11] 闫绍鹏, 杨瑞华, 冷淑娇, 等.高通量测序技术及其在农业科学研究中的应用.中国农学通报, 2012, 28(30):171-176.
[12] 李天福, 王树会, 王彪, 等.云南烤烟轮作现状与对策分析.烟草农业科学, 2006, 2:211-217.
[13] 郁飞燕, 李友军.轮作对土壤肥力的影响.科技传播, 2011, 16:60.
[14] 杨剑虹.土壤农化分析与环境监测[M].北京:中国大地出版社, 2008.
[15] 关松荫.土壤酶及其研究法[M].北京:农业出版社, 1986.
[24] 单贵莲, 初晓辉, 罗富成, 等.围封年限对典型草原土壤微生物及酶活性的影响.草原与草坪, 2012, 32(1):1-6.
[29] 朱兆香.土壤放线菌的筛选、鉴定及其活性代谢产物的研究[D].哈尔滨:东北农业大学, 2011.
[32] 廖上强, 郭军康, 王芳丽, 等.美洲商陆和籽粒苋对接种伯克氏菌的生理生化响应及其对富集铯的影响.环境科学学报, 2012, 32(1):213-223.
Influence of crop rotation on soil nutrients, microbial activities and bacterial community structures
CHEN Dan-Mei1, CHEN Xiao-Ming2, LIANG Yong-Jiang2, HUO Xin-Jian2, ZHANG Chang-Hua2,DUAN Yu-Qi3, YANG Yu-Hong3, YUAN Ling1*
1.CollegeofResourcesandEnvironment,SouthwestUniversity,Chongqing400716,China; 2.GuizhouZunyiTobaccoCompany,Zunyi563000,China; 3.YunnanTobaccoAgricultureResearchInstitute,Kunming650031,China
A 16-year field experiment has been carried out to investigate the influence of crop rotations on soil nutrients, microbial activities and bacterial community structures.The study includes 454 pyrosequencing analysis of bacterial 16S rDNA.The experiment investigated four crop rotation treatments:1) flue-cured tobacco in summer, followed by winter fallowing and maize in summer (T-F-M); 2) flue-cured tobacco in summer, canola in winter and maize in summer (T-C-M); 3) flue-cured tobacco in summer, canola in winter and rice in summer (T-C-R); and 4) tobacco in summer,Viciavillosain winter and rice in summer (T-V-R).After 16-years of crop rotation, soil pH had changed from 6.2 to 7.1.Compared with original soil levels, organic matter and available nutrients (such as nitrogen, phosphorus and potassium) either varied very little or significantly increased, suggesting the retention or growth of fertility under intensive rotations that return straw into soil and fallow during winter.There were higher microbial biomass carbon and nitrogen and enzyme activity (for example, sucrase, phosphatase, dehydrogenase, catalase and urease) in soils under the T-V-R treatment than in any of the other treatments.The readings of bacterial 16S rDNA sequences were 5395 for T-F-M soils, 5864 for T-C-M, 5528 for T-C-R and 6614 for T-V-R, representing 885, 973, 969 and 987 bacterial genera or species respectively, attributed to 31 phyla including Proteobacteria, Chloroflexi, Actinobacteria, Acidobacteria and Bacteroidetes.Proteobacteria were the largest group, accounting for 24.69%-32.49% of soil bacteria.5 of the 31 bacterial phyla and 6 of the 15 predominant bacteria were found in all the treatments’ soils.It seems reasonable to suggest that crop rotation was a fundamental determinant of the abundance of soil bacterial components and community structures.Taking into account variations in organic matter, available nutrients, enzyme activities, microbial biomass, bacterial community structures and biodiversity, our experiment suggests that T-V-R could be the best rotation model to promote in the flue-tobacco cultivation areas of Yunnan province.Key words:rotation; nutrients; soil enzymes; bacteria; diversity
10.11686/cyxb2015002
http://cyxb.lzu.edu.cn
2015-01-05;改回日期:2015-02-11
遵义市烟草公司(2010ZY),云南省烟草公司(2013YN11),国家烟草专卖局(110201302016)和科技部“973”课题(2013CB127405)资助。
陈丹梅(1992-),女,四川绵阳人,在读博士。E-mail:544328279@qq.com*通信作者Corresponding author.E-mail:lingyuanh@aliyun.com
陈丹梅, 陈晓明, 梁永江, 霍新建, 张长华, 段玉琪, 杨宇虹, 袁玲.轮作对土壤养分、微生物活性及细菌群落结构的影响.草业学报, 2015, 24(12):56-65.
CHEN Dan-Mei, CHEN Xiao-Ming, LIANG Yong-Jiang, HUO Xin-Jian, ZHANG Chang-Hua, DUAN Yu-Qi, YANG Yu-Hong, YUAN Ling.Influence of crop rotation on soil nutrients, microbial activities and bacterial community structures.Acta Prataculturae Sinica, 2015, 24(12):56-65.
